Introducción
La hemorragia masiva gastrointestinal alta debida a la ruptura de várices esofágicas es una de las causas más importantes de muerte en pacientes con cirrosis1 y la complicación principal de la hipertensión portal (HP). La HP es un síndrome frecuente caracterizado por el aumento crónico de la presión portal1,2 y su tratamiento farmacológico se basa en la presunción de que la disminución sostenida en la presión portal reduce la incidencia de complicaciones hipertensivas.1-4 Por ende, para el tratamiento y prevención de las hemorragias varicosas agudas y recurrentes es de capital importancia la disminución de la HP.1-4
Los agentes betabloqueantes no selectivos probaron ser efectivos en la reducción de la presión portal al disminuir el flujo sanguíneo esplácnico5 y son utilizados en la prevención primaria y secundaria de la hemorragia secundaria a várices esofágicas.6,7 Sin embargo, la disminución media en la presión portal en respuesta al propranolol es de sólo un 15%8 y un tercio de los pacientes con cirrosis no responden a pesar de un bloqueo adecuado.9 Los marcados avances en la dilucidación de la fisiopatología de la HP llevaron a la utilización de tratamientos farmacológicos alternativos, lo cual produjo un cambio sustancial en el enfoque terapéutico de la HP.3
La angiotensina II (A-II) está considerada un mediador potencial de la HP intrahepática debido a que sus niveles plasmáticos se encuentran elevados en la cirrosis10,11 y a que su infusión induce un ascenso en la presión portal.12 Además, la A-II, al actuar por medio de los receptores AT1, puede provocar HP por el incremento en la resistencia intrahepática, la resistencia portocolateral y el flujo sanguíneo portal.13-15 Sobre la base de estos hallazgos se realizaron diversos estudios con inhibidores de la enzima convertidora de angiotensina (ECA) y antagonistas del receptor de A-II a fin de reducir la presión portal en pacientes con cirrosis.16 Recientemente se evaluaron el losartán17 y el irbesartán,18 ambos antagonistas del receptor de A-II, en personas con HP, con resultados promisorios.
No obstante, los resultados de los ensayos más recientes fueron controvertidos con respecto a los efectos de los antagonistas del receptor de A-II sobre la presión portal.
En este estudio presentamos los cambios hemodinámicos en el flujo sanguíneo portal de los pacientes con cirrosis luego de la administración a corto plazo de valsartán y analizamos los datos actuales relacionados con los antagonistas del receptor de A-II y la HP.
Materiales y métodos
Treinta y seis pacientes consecutivos con cirrosis, 18 varones y 18 mujeres, con una meida de edad de 50 ± 14 (14-70 años) fueron divididos en tres grupos de acuerdo con la clasificación de Child-Pugh,19 en cada uno de los cuales se incluyeron 12 individuos. Todos los participantes presentaban cirrosis confirmada por biopsia. Se obtuvo el consentimiento informado de todos los pacientes y el estudio se controló por el comité de ética local.
Criterios de exclusión
Pacientes con gran cantidad de ascitis (en los cuales no fue posible realizar las mediciones por ecografía Doppler), trombosis venosa portal, presión arterial menor de 80 mm Hg, insuficiencia cardíaca congestiva, antecedentes de alergia medicamentosa, uso de agentes betabloqueantes, edad avanzada y embarazo.
También se excluyeron las personas en tratamiento antihipertensivo y aquellas con hemorragia por várices esofágicas dentro de las 4 semanas previas al ensayo. En pacientes en terapia con diuréticos, se requirió que la dosis fuese constante en las 4 semanas anteriores a las mediciones basales; de otro modo también fueron excluidos. La medicación de rutina se continuó durante el estudio sin modificaciones.
Antes y después del tratamiento con valsartán, se determinaron el peso corporal, el recuento de glóbulos blancos, los niveles de aspartato aminotransferasa (AST), alanina aminotransferasa (ALT), fosfatasa alcalina (FAL), gamma-glutamil transferasa (GGT), bilirrubina total, proteínas totales, albúmina, potasio, tiempo de protrombina y aclaramiento de creatinina.
Mediciones hemodinámicas
Los exámenes por ecografía Doppler se realizaron en la unidad de diagnóstico por imágenes mediante un aparato Toshiba Sonolayer SSH-140A con un transductor convexo de 3.75 mHz. El ángulo del Doppler se mantuvo entre 30º y 60º. Los pacientes se examinaron en posición supina o decúbito lateral izquierdo durante la inspiración profunda. A fin de reducir la variabilidad de los resultados, las mediciones por ecografía Doppler se realizaron siempre por el mismo investigador, quien desconocía los datos de laboratorio de los participantes. Los parámetros de flujo sanguíneo se midieron a las 8 de la mañana, luego de una noche de ayuno.
Las mediciones se repitieron tres veces por la misma persona para disminuir los resultados falsos y las medias de los valores se aceptaron como valores verdaderos.
Mediante ecografía Doppler se midió la velocidad de flujo sistólico pico (PSFV), la velocidad de flujo diastólico (DFV), el índice de velocidad de flujo sistólico pico/velocidad de flujo diastólico (PSFV/DFV), el índice de resistencia (IR = PSFV - DFV/PSFV) y el índice de pulsatilidad (IP = PSFV - DFV/velocidad de flujo medio) en las arterias hepática, mesentérica superior y renales. En la vena porta se midieron el diámetro, la velocidad de flujo máximo y el volumen de flujo. El diámetro de la vena porta se midió en la parte interna de lado a lado, en el punto donde se obtuvieron las velocidades de flujo pico.
Los volúmenes de flujo se determinaron por la siguiente fórmula:
volumen de flujo (ml/min) = área de sección x velocidad de flujo medio x 60.
Las áreas de sección se midieron por la fórmula πr2 con la presunción de circularidad de la sección del vaso. La velocidad de flujo de la vena porta (VP) estimada se calculó mediante la utilización de un factor de corrección obtenido del tiempo promedio de la velocidad máxima (Fdmáx).
velocidad de flujo medio de la VP = Fdmáx x 0.57.20,21
Las mediciones en la ecografía Doppler se realizaron tres veces: al comienzo (basales), en el medio (4º día) y al final (8º día) del tratamiento. A todos los participantes se les administró una única dosis diaria de 80 mg de valsartán, un antagonista del receptor de A-II, luego de las mediciones basales y después del desayuno, a las 8 de la mañana, todos los días durante una semana. Durante este período de tratamiento de una semana, se monitorearon y registraron diariamente la presión arterial y el pulso, las muestras de orina de 24 horas y la aparición de efectos adversos.
Los datos obtenidos al final del estudio se expresaron como media ± DE. Se utilizó la prueba de la t de Student para datos pareados para el análisis estadístico de la diferencia entre los parámetros; valores basales y del período medio de tratamiento, basales y posteriores al tratamiento y en el período medio y postratamiento. Los resultados de los diferentes grupos se compararon por medio de la prueba de la t de Student para datos independientes. Cualquier diferencia significativa en los parámetros entre los grupos pretratamiento, en el período medio y postratamiento se investigaron por el análisis de varianza no paramétrico (prueba de análisis de dos varianzas de Friedman). El nivel mínimo de significación estadística se consideró en un valor de p < 0.05.
Resultados
Las características clínicas de los pacientes, de acuerdo con el estadio de Child- Pugh se muestran en la tabla 1. La relación entre los valores basales y postratamiento con respecto a los parámetros bioquímicos se observan en la tabla 2.
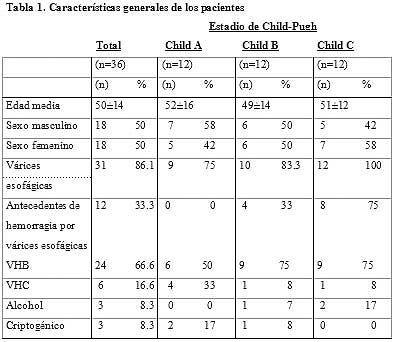
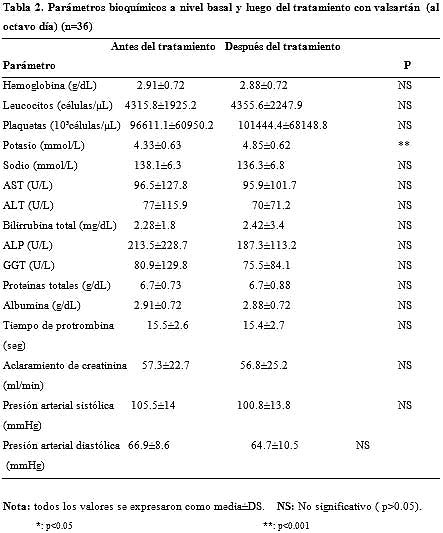
Los niveles séricos de potasio postratamiento aumentaron significativamente en comparación con los valores basales en todo el grupo analizado (n = 36; p < 0.001) y en los grupos A, B y C de la clasificación de Child (p < 0.05 para cada uno). Sin embargo, es de destacar que las concentraciones séricas medias de potasio al final del estudio permanecieron por debajo del límite superior normal.
Sorprendentemente, no se encontraron diferencias estadísticamente significativas entre los valores del aclaramiento de creatinina basales y postratamiento (p > 0.05). Además, tampoco fueron estadísticamente diferentes otros parámetros bioquímicos entre los períodos pretratamiento y postratamiento (p > 0.05).
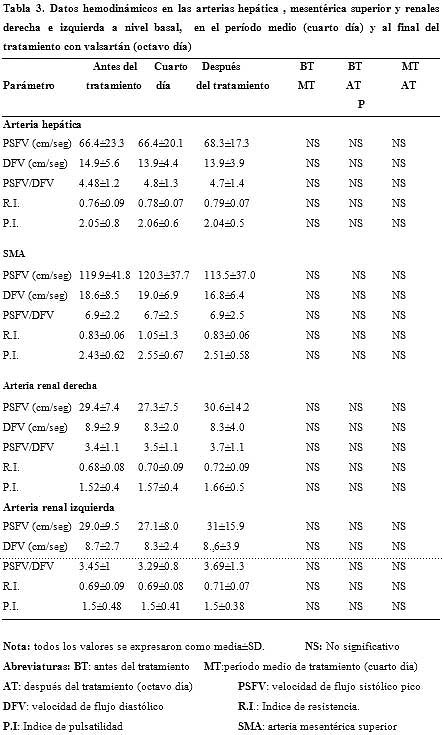
Los parámetros medidos con la ecografía Doppler color en las arterias hepática, mesentérica superior y renales derecha e izquierda en los períodos pretratamiento, en el período medio del tratamiento y postratamiento no mostraron diferencias significativas (n = 36; p > 0.05) con la administración de valsartán. Estos valores, con sus comparaciones, se muestran en la tabla 3. Sin embargo, la terapia con valsartán produjo una disminución significativa en los valores medidos a nivel basal, al cuarto día y al final del tratamiento, correspondientes al diámetro de la vena porta, la velocidad de flujo máximo y el volumen de flujo (n = 36; p < 0.05).
Estos resultados de muestran en la tabla 4.
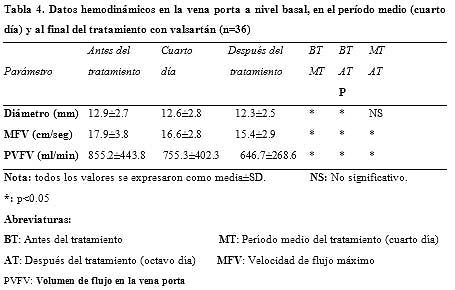
Se encontró una reducción significativa en el diámetro de la vena porta y la velocidad de flujo máximo en los grupos A, B y C de la clasificación de Child entre las mediciones obtenidas a nivel basal, en el período medio y al final del tratamiento (p < 0.05 para cada grupo). También hubo una disminución significativa en los valores correspondientes al volumen de flujo en la vena porta en los períodos pretratamiento, en el período medio y postratamiento (p < 0.001 en los grupos A y C de Child y p < 0.05 en el grupo B de Child). Estos valores y comparaciones se observan en la tabla 4.
La reducción en los valores de volumen de flujo de la vena porta encontrada en el período postratamiento con respecto al período pretratamiento fue del 24.4%.
Cuando la comparación se realizó sobre la base de la clasificación de Child, las disminuciones en los volúmenes de flujo de la vena porta en los pacientes de los grupos A, B y C en el período postratamiento respecto de los valores basales fueron del 32.4%, 18.5% y 20.3%, respectivamente. Los descensos encontrados en el volumen de flujo de la vena porta en todo el grupo (n = 36) y en los grupos A, B y C de la clasificación de Child se muestran en la figura 1.
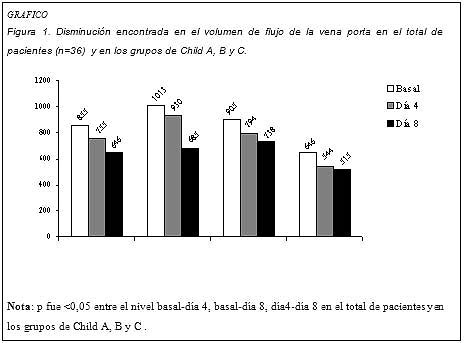
Discusión
Todos los antagonistas del receptor de A-II disminuyen el flujo sanguíneo portal por vasoconstricción arterial esplácnica refleja, la cual a su vez produce disminución en la presión sanguínea dependiente de la dosis.16,22 También se sostuvo que los antagonistas del receptor de A-II reducen la resistencia intrahepática.17 Sin embargo, en un estudio experimental se encontró que sólo en el 20% al 30% de los casos de resistencia intrahepática en la cirrosis es apropiado el tratamiento farmacológico.23 En consecuencia, la presión portal disminuye sólo en parte con los antagonistas de A-II y este descenso se atribuye a la reducción de la resistencia intrahepática.
Todos los antagonistas del receptor de A-II se administraron inicialmente por vía endovenosa con saralasina para disminuir la HP.24 No obstante, el uso a largo plazo de saralasina fue inapropiado debido a su duración de acción corta y a su mala biodisponibilidad oral.25 Además, la aparición de hipotensión sistémica pronunciada también obstaculizó estos intentos iniciales. El descubrimiento de antagonistas específicos del receptor de A-II sin actividad agonista intrínseca renovó el interés sobre el papel del sistema renina- angiotensina-aldosterona (SRAA) en la HP y los beneficios potenciales de su inhibición.
Recientemente, Schneider y col.17 informaron una disminución marcada (-46.8; 15.5% en la HP grave, y -44.1; 14.7% en la HP moderada) en el gradiente de presión venosa hepática en pacientes con cirrosis con la administración a corto plazo de losartán. Estos resultados fueron avalados por el estudio de Debernadi-Venon y col.,18 publicado en la forma de resumen, con la administración a largo plazo (ocho semanas) de irbesartán. En el presente ensayo encontramos disminuciones significativas en la tasa de flujo venoso portal y en el volumen de flujo. Se observó una disminución del 24.4% en el volumen de flujo portal al final de la primera semana del tratamiento con valsartán en todo el grupo de pacientes estudiado (p < 0.05); 16 pacientes (44.4%) de 36 tuvieron una reducción mayor al 20% en el volumen de flujo portal.
Estos resultados demostraron que la terapia con valsartán fue tan efectiva como los agentes betabloqueantes utilizados en los estudios de Gaiani y col.26 y de Piscaglia y col.,17 quienes comunicaron disminuciones del 32.9% y del 23.2%, respectivamente, en el volumen de flujo sanguíneo portal.
Sin embargo, sólo unos pocos ensayos evaluaron el uso de los antagonistas del receptor de A-II en la HP y sus resultados no fueron congruentes. En un informe reciente se encontró que el losartán fue tan efectivo como el propranolol en los pacientes con cirrosis y el número de personas que respondieron al losartán al día 14 de tratamiento fue significativamente más alto que con propranolol.28 Por el contrario, algunos otros estudios recientes no comunicaron efectos29 (o éstos fueron sólo moderados30) de los antagonistas del receptor de A-II sobre la presión venosa hepática. Es de destacar que la administración a largo plazo (6 semanas30 y 4 semanas31) de losartán no produjo una reducción significativa en el gradiente de presión portal.
Por otra parte surgieron preocupaciones acerca de la seguridad de los antagonistas del receptor de A-II debido a la hipotensión arterial y al deterioro de la función renal. El losartán produjo una leve, aunque estadísticamente significativa disminución en la presión arterial media.17 Además, en un estudio reciente con irbesartán, se informó que el 21% de los pacientes debieron suspender el tratamiento debido a hipotensión arterial.28 En el presente ensayo se produjo hipotensión sintomática en sólo dos personas en el primer día de tratamiento, aunque después de un corto período de reposo en cama, los valores de presión arterial retornaron a lo normal y no hubo recurrencias a pesar de la continuidad de la terapia.
Sólo en un estudio con irbesartán se observó una reducción significativa en el aclaramiento de creatinina.28 Sin embargo, en la mayoría de los ensayos que utilizaron antagonistas del receptor de A-II en pacientes con cirrosis no se informaron efectos deletéreos sobre la función renal. No se comunicó que el losartán17 y el irbesartán18 tuviesen efectos adversos renales. En este estudio tampoco observamos un cambio significativo en el aclaramiento de creatinina y en los exámenes Doppler de la arteria renal.
No obstante, encontramos un incremento significativo en los valores séricos de potasio en todo el grupo de estudio y en cada grupo de la clasificación de Child Pugh (p < 0.05). Los niveles séricos de potasio estuvieron por encima de los valores normales sólo en dos pacientes y, aun así, fueron menores de 6 mmol/l. En un ensayo comparativo con inhibidores de la ECA en personas con hipertensión esencial se comunicó que el valsartán produjo un incremento mayor del 20% en los valores séricos de potasio en el 4.4% de los pacientes.32 Sin embargo, en otros estudios que utilizaron otros antagonistas del receptor de A-II en pacientes con cirrosis no se encontraron cambios significativos en los niveles séricos de potasio.17,18 Estos resultados controvertidos pueden deberse a la presencia o ausencia de terapia diurética concomitante.
En conclusión, parece que la administración a corto plazo de los antagonistas del receptor de A-II tiene algunos efectos beneficiosos sobre la presión portal, especialmente en los estadios tempranos (sin ascitis) de la cirrosis. Además, el tratamiento con antagonistas de la A-II generalmente no se asocia con efectos adversos sobre la hemodinamia sistémica o renal en los estadios tempranos de la cirrosis, debido a que el SRAA no tiene un papel importante en el mantenimiento del tono vascular basal en esos estadios.14 Sin embargo, para que un determinado agente pueda considerarse efectivo sobre la presión portal, el efecto sobre la HP debe ser sostenido y crónico y los resultados de los estudios que evaluaron el tratamiento a largo plazo indicaron que los antagonistas del receptor de A-II son ineficaces para provocar el descenso de la presión portal.30,31 Además, en los casos de enfermedad hepática crónica avanzada hay una marcada activación del SRAA para compensar la vasodilatación periférica y mantener la presión arterial. Por ende, los efectos deletéreos sobre los parámetros hemodinámicos sistémicos y renales deben equilibrarse con los potenciales efectos de los inhibidores del receptor de la A-II sobre la reducción de la resistencia intrahepática.16 También puede haber un incremento en los niveles séricos de potasio, especialmente en los pacientes que, además, reciben diuréticos. Es necesaria la realización de estudios a largo plazo con un número suficiente de pacientes con cirrosis para cada grupo de la clasificación de Child-Pugh para dilucidar los aspectos controvertidos.
Los autores no manifiestan “conflictos de interés”.
BIBLIOGRAFÍA
-
Bosch J, Navasa M, García-Pagan JC, et al. Portal hypertension. Medical Clinics
of Norths America 1989; 73(4):931-953.
-
Bosch J. Medical treatment of portal hypretension. Digestion 1998; 59:547-
555.
-
D’Amico G, Pagliaro L, Bosch J. The treatment of portal hypertension: A meta
analytyic review. Hepatology 1995; 22:332-354.
-
Bosch J, García-Pagan JC, Feu F, et al. New approaches in the pharmacologic
treatment of portal hypertension. J of Hepatol 1993; 17:41-45.
-
Reichen J. Liver function and pharmacological considerations in pathogenesis
and treatment of portal hypertension. Hepatology 1990; 11:1066-1078.
-
Vlachogiannakos J, Goulis J, Patch D, et al. Primary prophylaxis for portal
hypertensive bleeding in cirrhosis. Aliment Pharmacol Ther 2000; 14:851-860.
-
Lebrec D, Poynard T, Bernau J, et al. A randomised controlled study of
propranolol for prevention of recurrent gastrointestinal bleeding in patients with
cirrhosis: a final report. Hepatology 1984; 4:355-358.
-
Grosszmann RJ, Bosch J, Grace ND, et al. Hemodynamic events in a
prospective randomised trial of propranolol versus placebo in the prevention of a
first variceal hemorrhage. Gastroenterology 1990; 99:1401-1407.
-
García-Tsao G, Grace ND, Groszmann RJ, et al. Short term effects of
propranolol on portal venous pressure. Hepatology 1986; 6:101-106.
-
Bosch J, Arroyo V, Betriu A, et al. Hepatic hemodynamics and the renin-
angiotensin-aldosterone system in cirrhosis. Gastroenterology 1980; 78:92-99.
-
García-Pagan JC, Bosch J, Rodes J. The role of vasoactive mediators in portal
hypertension. Semin Gastrointest Dis 1995; 6:140-147.
-
Ballet F, Chretien Y, Rey C, et al. Differential response of normal and cirrhotic
liver to vasoactive agents. A study in the isolated perfused rat liver. J Pharmacol
Exp Ther 1998; 244:233-235.
-
Bataller R, Gines P, Nicolas JM, Gorbig MN, García-Ramallo E, Gasull X, Bosch J,
Arroyo V, Rodes J. Angiotensin II induces contraction and proliferation of human
hepatic stellate cells. Gastroenterology 2000 Jun; 118(6):1149-56.
-
Helmy A, Jalan R, Newby DE, Hayes PC, Webb DJ. Role of angiotensin II in
regulation of basal and sympathetically stimulated vascular tone in early and
advanced cirrhosis. Gastroenterology 2000; 118(3):565-72.
-
Johnston CI. Angiotensin receptor antagonists: focus on losartan. Lancet 1995
25; 346(8987):1403-7.
-
Vlachogiannakos J, Tang AK, Patch D, Burroughs AK. Angiotensin converting
enzyme inhibitors and angiotensin II antagonists as therapy in chronic liver disease.
Gut 2001; 49(2):303-8.
-
Schneider AW, Kalk JF, Klien CP. Effect of losartan, an angiotensin II receptor
antagonist, on portal pressure in cirrhosis. Hepatology 1999; 29:334-339.
-
Debernadi-Venon W, Barleeti C, Marzano A, et al. Efficacy of irbesartan, an
angiotensin II receptor selective antagonist, in the treatment of portal
hypertension. Hepatology 1999; 330:219A.
-
Pugh RNH, Murray-Lyon IM, Dawson JL, et al. Transsection of the oesophagus
for bleeding oesophageal varices. Br J Surg 1973; 60:646-649.
-
Koçkar O, Koçkar MC, Erden A, et al. Relation between esophageal varices and
splanchnic and portal veins diameter and flow volumes determined by dupplex
Doppler ultrasonography in chronic parenchymal liver disease. The Turkish J of
Gastroenterol 1999; 10:216-220.
-
Nakano R, Iwao T, Oho K, et al. Splanchnic hemodynamic pattern and liver
function in patients with cirrhosis and esophageal or gastric varices. Am J
Gastroenterol 1997; 92(11):2085-9.
-
Heller J, Shiozawa T, Trebicka J, Hennenberg M, Schepke M, Neef M,
Sauerbruch T. Acute haemodynamic effects of losartan in anaesthetized cirrhotic
rats. Eur J Clin Invest 2003; 33(11):1006-12.
-
Bhathal PS, Grossman HJ. Reduction of the increased portal vascular resistance
of the isolated perfused cirrhotic rat liver by vasodilators. J Hepatol 1985;
1(4):325-37.
-
Arroyo V, Bosch J, Mauri M, et al. Effect of angiotensin II blockade on systemic
and hepatic hemodynamics and on renin-angiotensin-aldosterone system in
cirrhosis with ascites. Eur J Clin Invest 1981; 11:221-229.
-
Lebrec D. Pharmacolog?cal treatment of portal hypertension: Hemodynamic
effects and prevention of bleeding. Pharmac Therap 1994; 61:65-107.
-
Gaiani S, Bolondi L, Fenyves D, et al. Effect of propranolol on portosystemic
collateral circulation in patients with cirrhosis. Hepatology 1991; 14:824-829.
-
Piscaglia F, Gaiani S, Siringo S, et al. Splanchic Doppler ultrasound study of
propranolol and isosorbide-5-mononitrate for portal hypertension: chronic effects of
propranolol cannot be predicted by the acute challenge. Alim Pharm Ther 1998;
12:475-481.
-
De BK, Bandyopadhyay K, Das TK, Das D, Biswas PK, Majumdar D, Mandal SK,
Ray S, Dasgupta S. Portal pressure response to losartan compared with propranolol
in patients with cirrhosis. Am J Gastroenterol 2003; 98(6):1371-6.
-
Schepke M, Werner E, Biecker E, Schiedermaier P, Heller J, Neef M, Stoffel-
Wagner B, Hofer U, Caselmann WH, Sauerbruch T. Hemodynamic effects of the
angiotensin II receptor antagonist irbesartan in patients with cirrhosis and portal
hypertension. Gastroenterology 2001; 121(2):389-95.
-
Gonzalez-Abraldes J, Albillos A, Banares R, Del Arbol LR, Moitinho E, Rodriguez
C, Gonzalez M, Escorsell A, Garcia-Pagan JC, Bosch J. Randomized comparison of
long-term losartan versus propranolol in lowering portal pressure in cirrhosis.
Gastroenterology 2001; 121(2):382-8.
-
Tripathi D, Therapondos G, Lui HF, Johnston N, Webb DJ, Hayes PC. Chronic
administration of losartan, an angiotensin II receptor antagonist, is not effective in
reducing portal pressure in patients with preascitic cirrhosis. Am J Gastroenterol
2004; 99(2):390-4.
|


![]()

