Introducción
Millones de personas en todo el mundo padecen trastornos relacionados con la función renal, mientras que la prevalencia de insuficiencia renal crónica terminal (IRC) con necesidad de acceder al tratamiento con diálisis y trasplante está en ascenso. Tanto la diabetes como la hipertensión arterial son dos de las etiologías que más contribuyen a la presencia creciente de la IRC.
A pesar del avance en el conocimiento sobre la fisiopatogenia de la enfermedad renal y del mayor desarrollo tecnológico alcanzado en diálisis, la mortalidad de los pacientes con IRC, especialmente relacionada con trastornos cardiovasculares, continúa siendo elevada, particularmente en personas de edad avanzada, con diabetes y largo tiempo en diálisis.1,2 Estudios epidemiológicos muestran que la enfermedad cardiovascular en pacientes con IRC se manifiesta a menor edad y con mayor gravedad, en comparación con aquellos con función renal normal, y representa cerca del 50% de las muertes de los pacientes con IRC terminal. Foley y col. mostraron que la mortalidad de causa cardiovascular de los pacientes con IRC en diálisis es superior que en aquellos con función renal normal, independientemente de la raza y el sexo, y que esta diferencia es más marcada cuando más joven es la población, siendo cerca de 100 veces superior en la segunda y tercera décadas de la vida.3 Además de los factores de riesgo tradicionales para enfermedades cardiovasculares, en presencia de IRC aparecen otros relacionados con el estado urémico como la hiperfosfatemia, la sobrecarga de calcio, el incremento del producto fosfocálcico y el hiperparatiroidismo secundario4 (tabla 1).

El estudio de la enfermedad cardiovascular en la IRC es materia de creciente interés y en constante investigación. Se demostró que existe una estrecha relación entre la muerte de pacientes con IRC en diálisis, las calcificaciones cardiovasculares y de tejidos blandos y los trastornos del metabolismo fosfocálcico, lo que ha orientado las investigaciones hacia este campo de la nefrología en busca de soluciones a un problema que influye marcadamente en la supervivencia de dicha población.
Calcificaciones cardiovasculares
Una de las consecuencias más temidas de la hiperfosfatemia, el elevado producto fosfocálcico y el hiperparatiroidismo secundario, son las calcificaciones cardiovasculares manifestadas como depósitos de calcio en las arterias coronarias, válvulas cardíacas, miocardio, carótida, aorta y pequeños vasos periféricos, esta última conocida como arteriolopatía urémica calcificante (calcifilaxis) (figura 1). El depósito de calcio en las estructuras cardíacas se relaciona con un incremento del riesgo de eventos cardiovasculares como el infarto de miocardio, las arritmias, la enfermedad valvular y la insuficiencia cardíaca congestiva.4,5
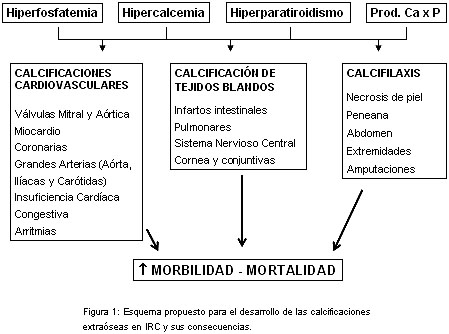
Calcificaciones vasculares
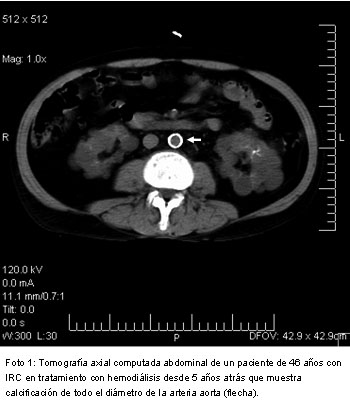
Estas involucran habitualmente las paredes de las arterias grandes y medianas, respetando las venas. Cuando el calcio se deposita en la íntima arterial lo hace sobre placas ateroscleróticas inflamadas, como se observa frecuentemente en la aorta, ilíacas, carótidas y coronarias (foto 1).6 Las microcalcificaciones de la íntima se producen a más temprana edad en pacientes con IRC respecto de aquellos con función renal normal.7 En pacientes diabéticos tratados con diálisis y de edad avanzada se observa mayor prevalencia de compromiso de la íntima y media de las arterias aorta, radial e ilíacas que comprometen la perfusión de los principales órganos toracoabdominales y los miembros inferiores.8
Si bien las placas ateroscleróticas calcificadas son comunes en la IRC, la lesión vascular más frecuentemente encontrada es la esclerosis de la media arterial que involucra la lámina elástica interna, conocida como “esclerosis de Mönckeberg”. Estudios de biología celular en medio urémico muestran que la esclerosis arterial es un proceso activo análogo a la formación ósea, donde diversos genes que habitualmente son expresados por los osteoblastos también se expresan en las células del músculo liso vascular. Así, diversas proteínas de la matriz ósea que intervienen en el proceso de remodelado óseo, como la osteocalcina, la proteína Gla y la osteopontina, se encuentran en la pared vascular calcificada. Otro elemento que apoya el concepto de la transformación ósea de las paredes vasculares es que el calcio depositado lo hace predominantemente como cristales de hidroxiapatita (fosfato de calcio) de manera análoga a la matriz ósea.9 De esta manera las células del músculo liso vascular sufren una transformación fenotípica que facilita la mineralización vascular convirtiendo el proceso en una verdadera osificación.10,11
Calcificación de las arterias coronarias
El depósito de calcio en las coronarias es poco común cuando sus paredes son normales, por lo general aparece en presencia de aterosclerosis y es considerado una parte integral de la placa aterosclerótica. Braun y col.12 comunicaron que la gravedad de las calcificaciones coronarias, medidas con angiografía coronaria; es de 2.5 a 5 veces mayor en pacientes con IRC en diálisis con respecto a aquellos con enfermedad cardíaca y función renal normal. Si bien las causas de las calcificaciones vasculares en la IRC están siendo intensamente investigadas, existe una estrecha relación con factores como la “dosis” provista de diálisis, la hiperfosfatemia, el producto fosfocálcico y la terapia con vitamina D (tabla 1). Goodman y col.,7 utilizando tomografía computarizada de haz de electrones (electron-beam computed tomography), como un método semicuantitativo para medir las calcificaciones coronarias, compararon la prevalencia de calcificaciones coronarias en pacientes jóvenes en diálisis con respecto a personas sanas. Ninguno de los 23 pacientes estudiados con IRC en diálisis y edad menor de 20 años evidenciaron calcificaciones, mientras que 14 de 16 pacientes de entre 20 y 30 años presentaban calcificaciones con diferentes grados de gravedad. Comparados con el grupo de pacientes sin calcificaciones, los que tenían depósitos de calcio en las coronarias tenían mayor edad, tiempo de permanencia en diálisis, fosfatemia, producto fosfocálcico e ingesta diaria de calcio. Diez pacientes que fueron seguidos durante una media de 20 ± 3 meses mostraron una progresión de las calcificaciones llegando prácticamente a duplicarse.7 Por el contrario, solamente 3 de 60 sujetos con función renal normal tenían calcificaciones, lo que demuestra que el depósito de calcio en las coronarias es común y progresivo en personas jóvenes con IRC en tratamiento dialítico.7 Otros autores demostraron que la afección coronaria es precoz en la IRC y comienza antes de la llegada a diálisis. Según datos del Medicare, un 60% de los pacientes con IRC pre-terminal son derivados para diagnóstico de enfermedad cardiovascular y un 70% para enfermedad cardíaca aterosclerótica. De tal manera que al momento de comenzar la diálisis una sustancial mayoría de los pacientes, sino todos, tienen ya sus coronarias enfermas.13
Los pacientes con IRC y enfermedad coronaria tienen un mal pronóstico, tal como lo demostraron Wright y col., sobre 3 106 pacientes con infarto agudo de miocardio, la mortalidad fue del 2% en pacientes con función renal normal, del 6% cuando existía disfunción renal leve, del 14% si era moderada, del 21% en la grave y del 30% en la IRC terminal.14
Calcificaciones valvulares
Tanto la válvula aórtica como la mitral pueden calcificarse en la IRC; su frecuencia es 8 veces superior con respecto a la población de la misma edad con función renal normal.15 La calcificación valvular de pacientes en diálisis se caracteriza por su rápida progresión hacia la disfunción valvular, su correlación con las calcificaciones coronarias y miocárdicas y el incremento de complicaciones como la insuficiencia cardíaca, isquemia coronaria, arritmias, estenosis valvular, endocarditis y tromboembolismo.
Hiperfosfatemia
La hiperfosfatemia es un trastorno con elevada prevalencia en pacientes con IRC tratados con diálisis.16 A pesar del esfuerzo de pacientes, nutricionistas y nefrólogos para obtener niveles de fosfatemia adecuados, entre el 40% y el 60% de los pacientes en diálisis presentan niveles de fósforo sérico superiores a 5.5 mg/dl.17 Las causas más comúnmente relacionadas con este trastorno son la elevada ingesta de alimentos que contienien fosfato, una prescripción inadecuada de diálisis, de captores orales del fósforo y vitamina D y el tipo de remodelado óseo (tabla 2).18 Los niveles elevados de fósforo tienen una gran responsabilidad en la aparición del hiperparatiroidismo secundario.19 Desde los estadios tempranos de la IRC, cuando el filtrado glomerular disminuiyó a 30-59 ml/min (estadio 3), se producen cambios adaptativos en el eje paratiroides-riñón que permiten mantener el incremento de la fosfatemia casi imperceptible en base a una mayor secreción de hormona paratiroidea. En esta etapa, el fósforo sérico causa precipitación del calcio en los tejidos blandos, disminución de la salida de calcio del hueso por una mayor resistencia ósea a la acción de la PTH e inhibición de la enzima 1alfa-hidroxilasa renal, llevando a una disminución de los niveles de calcitriol, todo esto contribuye a la aparición de hipocalcemia.19 Recientes datos sugieren un efecto directo del fósforo sobre la producción de PTH independientemente de los niveles de calcio y vitamina D.20 El hiperparatiroidismo resultante disminuye la reabsorción tubular proximal de fosfato e incrementa la fosfaturia, permitiendo mantener la fosfatemia en niveles normales.

Este equilibrio se rompe cuando la tasa de filtrado glomerular continúa descendiendo y la capacidad renal de excretar el exceso de fosfato se ve sobrepasada, haciéndose manifiesta la hiperfosfatemia. Si bien los otros factores como la deficiencia o la insuficiencia de vitamina D, la hipocalcemia y la resistencia ósea a la acción de la PTH contribuyen a la aparición del hiperparatiroidismo, ninguno de ellos parece tener la relevancia de la hiperfosfatemia.
Para Ganesh y col.,21 el fósforo sérico se comporta como una cardiotoxina, de tal manera que niveles de fosfatemia superiores a 6.5 mg/dl y del producto fosfocálcico mayores de 72 mg2/dl2 predisponen a calcificaciones cardiovasculares.
Papel de la dieta y de la diálisis en la hiperfosfatemia
La restricción de la ingesta de fosfato en perros con IRC lleva a una disminución de los niveles de hormona paratiroidea y previene la aparición de hiperparatiroidismo secundario sin modificaciones en los niveles de calcio y de calcitriol.22 Similares resultados se vieron en estudios clínicos en pacientes con IRC en los que la restricción del fosfato dietario disminuyó los niveles de hormona paratiroidea de manera independiente del calcio y del calcitriol.23 Es evidente que la ingesta de fosfato desempeña un papel fundamental en la aparición del hiperparatiroidismo secundario desde los estadios tempranos de la IRC. Otro efecto adicional de la restricción del fosfato dietario es el retraso de la progresión de la IRC y prevención del daño renal. Si bien no se conocen los mecanismos por los cuales el fosfato interviene en la función renal, se especula que los menores niveles de fósforo séricos previenen la aparición de calcificación del parénquima renal y las alteraciones hemodinámicas.24
Sin embargo, la restricción de la ingesta de fosfato con los alimentos tiene una eficacia limitada para controlar la hiperfosfatemia, ya que una disminución en el contenido dietario de fosfato puede comprometer el estado nutricional, particularmente en lo referente a la ingesta proteica.
La eliminación del fosfato con diálisis es también limitada debido a que la mayor parte del fosfato inorgánico es intracelular. La cantidad de fosfato removido en una sesión de hemodiálisis es cercana a los 800 mg, es decir de 2 400 mg en las tres diálisis de la semana, mientras que cada cambio de líquido en diálisis peritoneal remueve alrededor de 300 a 400 mg (2 100-2 800 mg a la semana). Si la ingesta diaria de fosfato con los alimentos ronda los 1 000 a 1 200 mg y de éstos el 60% se absorbe a nivel intestinal, significa que semanalmente ingresarán al organismo con los alimentos entre 4 200 y 5 000 mg de fosfato, lo que implica que la diálisis solo removerá entre 40% y 50% del fosfato absorbido.25 Una “dosis inadecuada” de diálisis en cuanto a la duración de la sesión, tipo de membrana y calidad del acceso vascular, entre otros factores, puede limitar aun más la eliminación del fosfato. Uno de los limitantes más importantes para la eliminación del fosfato durante la diálisis es que solamente el 0.02% del fosfato corporal total se encuentra a nivel plasmático, por lo que la mayor parte del fosfato eliminado en una sesión de diálisis se realiza en la primera hora del tratamiento. Muczi y col.26 compararon la eliminación de fosfato utilizando durante 6 meses hemodiálisis convencional de 12 horas semanales vs. un tratamiento intensivo de 6 sesiones semanales de 8 horas con menor flujo sanguíneo, de agua y superficie de las membranas. Cuando los pacientes fueron tratados en forma intensiva presentaron menores niveles de fosfatemia a pesar de haber suprimido prácticamente la utilización de calcio como captores orales y duplicado la ingesta de fósforo con los alimentos.27
Quelantes orales del fosfato
Las limitaciones de la dieta y de la diálisis obligan a buscar alternativas para controlar la hiperfosfatemia. Durante las dos primeras décadas de tratamiento con diálisis, el uso de captores orales del fosfato conteniendo aluminio fue una solución para este problema debido a la eficacia del aluminio para unirse con el fosfato de los alimentos a nivel intestinal y evitar su absorción.28 Las sales de aluminio son probablemente los más potentes captores intestinales de fosfato, bien toleradas y solubles a cualquier pH, a diferencia de las de calcio cuya solubilidad aumenta a pH mayor de 5. Desafortunadamente, en los finales de la década del ’70 se confirmó que la utilización de aluminio en altas dosis y por tiempo prolongado producía su acumulación en los tejidos óseo, nervioso, hematopoyético y paratiroideo produciendo trastornos clínicos graves como anemia microcítica, osteomalacia, hipoparatiroidismo y trastornos neurológicos conocidos como demencia dialítica, responsable de numerosas muertes de pacientes en diálisis, razón por la cual prácticamente se dejó de utilizar.29-32 Su absorción intestinal se ve facilitada cuando el aluminio se ingiere junto con sales de citrato, lo que puede agravar la intoxicación. Otro de los mecanismos responsables de la intoxicación con aluminio es la contaminación de los líquidos de diálisis que producirá el ingreso del aluminio al plasma, de manera proporcional a su concentración en el baño de diálisis.29 De esta manera, las principales formas de prevenir la intoxicación por aluminio de los pacientes de diálisis es limitar la cantidad ingerida y controlar los niveles del agua utilizada para diálisis.29-31
Debido a esto, una buena alternativa para el tratamiento de la hiperfosfatemia es la utilización de los captores orales de fosfato en base al calcio. Tanto el carbonato como el acetato de calcio son eficaces para tal fin. En un estudio prospectivo y abierto mostramos que el acetato de calcio presenta similar eficacia como captor del fosfato usando aproximadamente la mitad de dosis de calcio elemental.33 Independientemente del tipo de compuesto de calcio utilizado, la cantidad necesaria de calcio para controlar la hiperfosfatemia es sustancialmente elevada. Si se utiliza carbonato de calcio la dosis puede estar entre 4 y 10 g/día, lo que equivale a 2 a 5 g de calcio elemental. Como la absorción intestinal es proporcional a la dosis utilizada, altas dosis de calcio producirán un balance corporal positivo (tabla 3). Según las normas K/DOQI (kidney disease outcomes quality initiative) provistas por la National Kidney Foundation, como una guías prácticas para el manejo de los trastornos del metabolismo mineral en la IRC, la ingesta diaria de calcio no debe superar los 1 500 mg diarios como medicamento y los 2 000 mg sumado a lo ingerido con los alimentos.27 De esta manera se limitaría la posibilidad de aparición de hipercalcemia y el depósito de calcio en los tejidos, aunque acotaría la eficacia del calcio oral para prevenir o tratar la hiperfosfatemia. Una alternativa interesante es la utilización del sevelamer, un captor oral del fosfato libre de aluminio y calcio que demostró ser eficaz para disminuir los niveles de fosfato sérico en la población con IRC en hemodiálisis.34 Un beneficio adicional del sevelamer es la demostración de la disminución de los niveles de colesterol total y colestrol LDL, con lo cual además bajaría el riesgo de enfermedad vascular aterosclerótica.34 Otras sales como las de magnesio, hierro o lantano se encuentran en diferentes fases de estudio como captores orales del fosfato.

El papel del nefrólogo en el control de la hiperfosfatemia
Winkelmayer y col. mostraron que el cuidado de los pacientes con IRC por parte de los nefrólogos, antes del ingreso a diálisis, se asocia con un mayor uso de métodos de diagnóstico y tratamiento de los trastornos del metabolismo fosfocálcico y con una disminución del 35% en el riesgo de muerte.35 Sin embargo, ¿cuánto podemos hacer los nefrólogos para mejorar el perfil del metabolismo fosfocálcico de nuestros pacientes? Es una pregunta aún difícil de responder.
El estudio multicéntrico, observacional, Dialisis Outcomes and Practice Patterns Study (DOPPS),36,37 realizado sobre 17 236 pacientes de diálisis pertenecientes 307 centros de 7 países entre 1996 y 2001, describió el estado del metabolismo mineral y permitió conocer en qué medida los valores estaban dentro de los niveles recomendados por las normas K/DOQI27 y EBPG (European Best Practice Guidelines for Haemodialysis)38 (tabla 4). Para una fosfatemia recomendada de 3.5 a 5.5 mg/dl, el 8% de los pacientes estaban por debajo, y el 52% por encima, del rango recomendado. Para una calcemia de 8.4 a 9.5 mg/dl el 50% superaba este valor. El 44% presentaba el producto fosfocálcico por encima de 55 mg2/dl2, mientras que para un nivel sugerido de PTH entre 150 y 300 pg/ml, el 51% se encontraba por debajo de esta cifra y el 27%, por encima.36,37
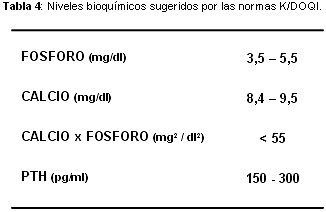
Sin embargo, lo más llamativo del estudio DOPPS fue que demostró que la mayoría de los valores del metabolismo mineral estaban por fuera del rango recomendado, ya que sólo el 4.6 % de los pacientes cumplía con los 4 valores simultáneamente, mientras que el 20.7% de no cumplía ninguno de los criterios sugeridos.36 El estudio DOPPS demuestra claramente la dificultad que existe para mantener a los pacientes en diálisis dentro de los valores recomendados por las normas sobre manejo de los trastornos del metabolismo mineral, siendo necesario un esfuerzo mayúsculo por parte de los profesionales y los pacientes para alcanzar los objetivos del metabolismo mineral.
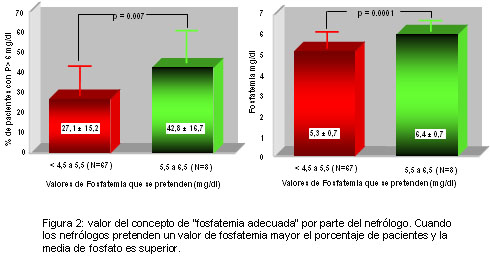
Recientemente realizamos una encuesta sobre diferentes aspectos de los trastornos del metabolismo mineral, en 80 centros de diálisis de Argentina, donde recibían tratamiento dialítico 4 512 pacientes, lo cual representa cerca del 24% de los centros y del 34% de los pacientes de Argentina, hacia 1999. Un dato más que llamativo fue que ante la pregunta acerca de cuál es el nivel de fosfato sérico que pretenden alcanzar los nefrólogos en sus pacientes, en aquellos centros donde los nefrólogos pretendían que sus pacientes tuviesen una fosfatemia entre 5.5 y 6.5 mg/dl (10.1% de los casos) presentaban un mayor porcentaje de pacientes con niveles de fósforo sérico por encima de 6 mg/dl y el valor medio de fosfatemia encontrado entre ellos era significativamente superior con respecto a aquellos centros donde el nivel de fosfatemia pretendido estaba por debajo de 5.5 mg/dl (figura 2). De esta manera, existiría una relación directa entre lo que considera el nefrólogo como “fosfatemia adecuada” y la fosfatemia obtenida en sus pacientes.39
Hiperfosfatemia y calcificaciones cardiovasculares
Aunque las calcificaciones cardiovasculares pueden aparecer en pacientes con función renal normal, su prevalencia aumenta drásticamente en presencia de insuficiencia renal e incide no sólo en la morbilidad de esta población, sino que afecta notablemente su mortalidad.
Block y col., utilizando datos de los principales registros de pacientes en diálisis de los Estados Unidos (US Renal Data System), demostraron que la hiperfosfatemia y el producto fosfocálcico representan un factor de riesgo independiente de muerte para pacientes en hemodiálisis.17 Cuando la fosfatemia es mayor de 7.9 mg/dl, el riesgo relativo de muerte es un 39% superior respecto de niveles de fósforo entre 2.5 y 6.5 mg/dl. De la misma manera, cuando el producto fosfocálcico es mayor de 72 mg2/dl2, el riesgo de muerte es un 34% superior en comparación con un producto fosfocálcico entre 42 y 52 mg2/dl2.17 A pesar de la clara asociación entre hiperfosfatemia y mortalidad de la población en diálisis, el mecanismo fisiopatogénico aún no está aclarado.
Resultados similares fueron descritos en el estudio DOPPS, en el que niveles elevados de calcio, fósforo, producto fosfocálcico y PTH se asociaron en forma independiente con muerte por causa cardiovascular de pacientes en diálisis.37 Estos pacientes tienen un incremento del riesgo de recibir una paratiroidectomía 4 veces superior que aquellos pacientes con PTH dentro del rango esperado. El estudio DOPPS permitió conocer el uso inapropiado de vitamina D, ya que demostró que era subutilizada en 34% de los pacientes que presentaban PTH elevada, mientras que la recibía 46% de los pacientes con hipoparatiroidismo, en quienes la vitamina D está contraindicada. Tal vez lo que más llamó la atención es el uso erróneo de los captores de fosfato en base a calcio, los que fueron administrados a un 77% de pacientes con niveles bajos de fosfato y no eran utilizados por un 18% de pacientes con hiperfosfatemia.37 La utilización inadecuada de vitamina D y sales de calcio está descrita como uno de las factores de riesgo más importantes para las calcificaciones vasculares.
Numerosos estudios relacionan la hiperfosfatemia y el elevado producto fosfocálcico con las calcificaciones cardiovasculares y de tejidos blandos.18,40 Esta hipótesis está sustentada en el conocimiento de que la normalización de los niveles de fósforo sérico previene o revierte la aparición de la mayor parte de los depósitos extraóseos de calcio. La disminución de la fosfatemia por medio de captores orales de fósforo y un agresivo tratamiento dialítico resulta en la movilización de los depósitos tumorales, conjuntivales o periarticulares de fosfato de calcio en la forma de hidroxiapatita.41 Una evolución similar se observa luego de un trasplante renal exitoso.42
Recientes estudios experimentales en ratas urémicas mostraron que el descenso de los niveles de fosfato, producto fosfocálcico y PTH con el uso de sevelamer previene la calcificación de la capa media de la aorta y de tejidos blandos como riñones y estómago.43 Similares resultados se demostraron en humanos, en los cuales el sevelamer disminuyó la progresión de las calcificaciones aórticas y coronarias en relación con una caída de la fosfatemia, del producto fosfocálcico y del colesterol LDL.44 Comparados con pacientes tratados con sevelamer, aquellos que utilizaron captores orales del fosfato en base a calcio sufrieron un incremento progresivo de las calcificaciones cardiovasculares, medido mediante tomografía computarizada de haz de electrones.34
Mecanismo de las calcificaciones vasculares en presencia de fosfato
Recientes estudios demostraron el efecto del fosfato sobre el mecanismo de la calcificación vascular, lo que provee una luz a efectos de entender las causas de las calcificaciones metastásicas. Una hipótesis atractiva para esta asociación es demostrada mediante estudios in vitro, con cultivos de células de músculo liso vascular, las que en presencia de un medio rico en fosfato (2.0 mmol/l) forman depósitos de bioapatita, pero no cuando este medio es pobre en fosfato (1.4 mmol/l).45 Dicha formación de bioapatita es inhibida si se bloquea la actividad del cotransportador Na-Pi Pit-1. Esto demuestra que la precipitación del calcio en la pared vascular es un proceso celular activo en lugar de un efecto “metastásico” pasivo donde el fosfato tiene un papel fundamental.45
El incremento de la concentración de fosfato intracelular contribuye a la aparición de cambios en la expresión de genes reguladores de la actividad de las células del músculo liso y a la aparición de cambios fenotípicos símil osteoblastos como son la expresión del factor cbfa-1 (factor de transcripción central), de fosfatasa alcalina, osteocalcina, osteopontina y la formación de vesículas de matriz ósea.45,46 El factor cbfa-1 regula la expresión de osteocalcina, uno de los genes específicos de osteoblastos. Chen y col. mostraron que el b-glicerofosfato y el suero urémico inducen calcificación de las células de músculo liso vascular bovino a través de la expresión de osteopontina por un mecanismo mediado por fosfatasa alcalina y la actividad del cotransportador Na-Pi Pit-1.47 Más recientemente, se demostró que deficiencias en los niveles circulantes de inhibidores de la calcificación vascular, como la fetuina-A (glucoproteína alfa-2 de Heremans-Smith) y la proteína Gla de la matriz ósea, incrementarían la presencia de calcificaciones vasculares en pacientes urémicos.48 La fetuina-A es un potente inhibidor de la formación de hidroxiapatita, presenta actividad antiinflamatoria e incrementa la fagocitosis de cuerpos apoptóticos; estos mecanismos serían importantes para prevenir los depósitos vasculares de calcio. Modelos de ratones knock-out para fetuina-A presentan graves calcificaciones de los tejidos blandos.48
Conclusiones
La mortalidad de la población en diálisis disminuyó en los últimos años, pero este avance no ha sido proporcional al de los conocimientos científicos y al desarrollo tecnológico de las terapias de reemplazo de la función renal. La muerte por causas cardiovasculares son las más frecuentes en esta población y su asociación con las calcificaciones extraóseas se encuentran entre sus principales casuas. Diversos estudios demuestran claramente que los niveles elevados de fosfato, calcio, producto fosfocálcico y PTH tienen un papel fundamental en el desarrollo de las calcificaciones cardiovasculares y tienen una relación directa con la mortalidad de la población en diálisis. La National Kidney Foundation y la European Renal Association, a través de las normas K/DOQI y EBPG, respectivamente, establecieron las pautas para un manejo correcto de estos trastornos, sin embargo, estudios a gran escala como el DOPPS demostraron que existen marcadas dificultades para cumplir estas metas. Mediante una encuesta multicéntrica mostramos que el nefrólogo tiene un papel fundamental en la lucha para el control de la hiperfosfatemia con el fin de disminuir el riesgo de muerte de los pacientes en diálisis.
BIBLIOGRAFÍA
1. US Renal Data System: USDRS 2003 Annual Data Report: Atlas of End-Stage Renal Disease in the United State, Bathesda; MD, National Institute of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2003.
2. Szcech L, Lazar I. Projecting the United State ESRD population: Issues regarding treatment of patients with ESRD. Kidney Int 66 (Suppl 90): S3-S7, 2004.
3. Foley R, Parfrey P, Sarnak M. Clinical epidemiology of cardiovascular disease in chronic renal disease. Am J Kidney Dis 32 (Suppl 3):112-119, 1998.
4. Ounibi W, Nolan D, Ayus J. Cardiovascular calcification in patients with end-stage renal disease: A century-old phenomenon. Kidney Int 62 (Suppl 82):S73-S80, 2002.
5. Rostand G, Tilman D. Parathyroid hormone, vitamin D, and cardiovascular disease in chronic renal failure. Kidney Int 56:383-392, 1999.
6. Wong N, Abrahamson D, et al. Detection of coronary artery calcium by ultrafast computed tomography and its relation to clinical evidence of coronary artery disease. Am J Cardiol 73:223-227, 1994.
7. Goodman W, Goldin J, Kuizon B, et al. Coronary-artery calcification in young adults with end-stage renal disease who are undergoing dialysis. N Engl J Med 342:1478-1483, 2000.
8. Sakata N, Noma A, Yamamoto Y, et al. Modifications of elastin by pentosidine is associated with the calcification of aortic media in patients with end-stage renal disease. Nephrol Dial Transplant 18:1601-1609, 2003.
9. Bostrom K, Watson K, Horn S, et al. Bone morphogenetic protein expression in human atherosclerotic lesions. J Clin Invest 91:1800-1809, 1993.
10. McCullough P, Soman S. Cardiovascular calcification in patients with chronic renal failure: Are we on target with this risk factor? Kidney Iny 66 (Suppl 90):S18-S24, 2004.
11. Goldsmith D, Ritz E, Covic A. Vascular calcification: A stiff challenge for the nephrologist. Does preventing bone disease cause arterial disease? Kidney Int 66:1315-1333, 2004.
12. Braun J, Oldendorf M, Moshage W, et al. Electronic beam computed tomography in the evaluation of cardiac calcification in chronic dialysis patients. Am J Kidney Dis 27:394-401, 1996.
13. Joki N, Hase H, Nakamura R, Yamaguchi T. Onset of coronary artery disease prior to initiation of hemodialysis in patients with end-stage renal disease. Nephrol Dial Transplant 12:718-723, 1997.
14. Wright R, Reeder G, Herzog C, et al. Acute myocardial infarction and renal dysfunction: A high risk combination. Ann Intern Med 137:563-570, 2002.
15. London G, Panner B, Marchais S, Guerin A. Calcification of the aortic valve in dialyzed patients. J Am Soc Nephrol 11:778-783, 2000.
16. Delmez J, Slatopolsky E: Hyperphosphatemia: Its consequences and treatment in patients with chronic renal disease. Am J Kidney Dis 19:303-317, 1992.
17. Block G, Hulbert-Shearon T, Levin N, Port F: Association of serum phosphorous and calcium x phosphorous product with mortality risk in chronic hemodialysis patients: A national study. Am J Kidney Dis 31:607-17, 1998.
18. Block G, Port F: Re-evaluation of risks associated with hyperphosphatemia and hyperparathyroidism in dialysis patients: Recommendations for a change in management. Am J Kidney Dis 35:1226-1237, 2000.
19. Slatopolsky E, Brown A, Dusso A. Role of phosphorous in the pathogenesis of secondary hyperparathyroidism. Am J Kidney Dis 37 (Suppl 2):54-57, 2001.
20. Dusso A, Pavlopoulos T, Naumovich L, et al. p21 (WAF1) and transforming growth factor-alpha mediate dietary phosphate regulation of parathyroid cell growth. Kidney Int 59:855-865, 2001.
21. Ganesh S, Stack A, Levin N, et al. Association of elevated serum PO4, Ca x PO4 product, and parathyroid hormone with cardiac mortality risk in chronic hemodialysis patients. J Am Soc Nephrol 12:2131-2138, 2001.
22. Lopez-Hilker D, Dusso A, Rapp N, et al. Phosphorus restriction reverses hyperparathyroidism in uremia independent of changes in calcium and calcitriol. Am J Physiol 259:432-437, 1990.
23. Slatopolsky E, Finch J, Denda M, et al. Phosphorus restriction prevents parathyroid glang growth. High phosphorus directly stimulates PTH secretion in vitro. J Clin Invest 97:2534-2540, 1996.
24. Barsotti G, Giannoni A, Morelli E, et al. The decline of renal function slowed by very-low phosphorus intake in chronic renal patients following a low nitrogen diet. Clin Nephrol 21:54-59, 1984.
25. Hsu C, Are we mismanaging calcium and phosphate metabolism in renal failure? Am J kidney Dis 29:641-649, 1997.
26. Muczi I, Hercz G, Uldall R, Ouwendyk M, Francoeur R, Pierratos A. Control of serum phosphate without any phosphate binders in patients treated with nocturnal hemodialysis. Kidney Int 53:1399-1404, 1998.
27. National Kidney Foundation: K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 42 (Suppl 3):S1-S201, 2003.
28. Emmett M. A comparison of clinically useful phosphorus binders for patients with chronic kidney failure. Kidney Int 66 (Suppl 90):S25-S32, 2004.
29. Douthat W, Acuña G, Fernández Martín JL, Serrano M, González Carcedo A, Canteros A, Menéndez Fraga P, Cannata J. Exposición al aluminio y calidad del baño de diálisis: repercusión sobre los niveles de aluminio sérico. Nefrología 14(6):695-700, 1994.
30. Cannata J, Douthat W, Acuña G, Fernández Martín JL. Aluminum toxicity: the role of prevention. Life Chemistry Reports 11:207-213; 1994.
31. Douthat W, de Arteaga J, Garay G, Canteros A, Cannata J, Massari P. Niveles de aluminio en el agua de centros de diálisis de la provincia de Córdoba, Argentina. Nefrología Latinoamericana 5:11-16, 1998.
32. Douthat W, Acuña Aguerre G, Fernández Martín JL, Mouzo R, Cannata Andía JB. Treatment of aluminium intoxication: a new scheme for desferrioxamine administration. Revista: Nephrol Dial Transplant Vol 9:1132-1135, 1994.
33. Douthat W, Giraudo L, Martinez Colombres C, Aguirre E, Capra R, de Arteaga J, Massari P: Eficacia y tolerancia del acetato vs carbonato de calcio como quelantes del fósforo en pacientes en diálisis. Nefrología Latinoamericana 4:274-279, 1997.
34. Chertow G, Raggi P, Chasan-Taber S, et al. Determinant of progressive vascular calcification in haemodialysis patients: Nephrol Dial Transplant 19:1489-1496, 2004.
35. Winkelmayer W, Levin R, Avorn J. The nephrologist`s role in the management of calcium-phosphorous metabolism in patients with chronic kidney disease. Kidney Int 63:1836-1842, 2003.
36. Young E, Akiba T, Albert J, et al. Magnitude and impact of abnormal mineral metabolism in hemodialysis patients in the dialysis outcomes and practice patterns study (DOPPS). Am J Kidney Dis 44 (Suppl 2):34-38, 2004.
37. Young E, Albert J, Satayathum S, et al. Predictors and consequences of altered mineral metabolism: The dialysis outcomes and practice patterns study. Kidney Int 67:1179-1187, 2005.
38. Kessler M, Canaud B, Pedrini L, et al. The EBPG expert group on haemodialysis. European best practice guidelines for haemodialysis. Nephrol Dial Transplant 17 (Suppl 17):1-111, 2002.
39. Douthat W, Alles A, Marinovich S, Tirado S, Peñalba A. Importancia del Concepto "Fosfatemia Adecuada" como Factor de Riesgo de Hiperfosfatemia. Nefrología 23 (Supl 2):95-99, 2003.
40. Llach F. Hyperphosphatemia in end-stage renal disease patients: Pathophysiological consequences: Kidney Int 56 (Suppl 73):S31-S37, 1999.
41. Kim S, Golstein M, Szabo T, Pierratos A. Resolution of massive uremic calcinosis with daily nocturnal home hemodialysis. Am J Kidney Dis 41:12, 2000.
42. Alfrey A. The role of abnormal phosphorous metabolism in the progression of chronic kidney disease and metastatic calcification. Kidney Int 66 (Suppl 90):S13-S17, 2004.
43. Kutsumata K, Kusano K, Hirata M, et al. Sevelamer hydrochloride prevents ectopic calcification and renal osteodystrophy in chronic renal failure rats. Kidney Int 64:441-450, 2003.
44. Chertow G, Burke S, Raggi P, et al. Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients. Kidney Int 62:245-252, 2002.
45. Giachelli C, Jono S, Shioi A, et al. Vascular calcification and inorganic phosphate. Am J Kidney Dis 38:34-37, 2001.
46. Floege J. When man turns to stone: Extraosseous calcification in uremic patients. Kidney Int 65:2447-2462, 2004.
47. Chen N, O`Neill K, Duan D, Moe S. Phosphorous and uremic serum up-regulate osteopontin expression in vascular smooth muscle cells. Kidney Int 62:1724-1731, 2002.
48. Schafer C, Heiss A, Schwarz A, et al. The serum protein alpha 2-Hereman-Schmid glycoprotein/fetuin-A is a systemically acting inhibitor of ectopic calcification. J Clin Invest 112:357-366, 2003.
|


![]()

