Introducción
En los niños y adolescentes, las arterias nutricias atraviesan las placas cartilaginosas epifisarias de las vértebras y se introducen en el anillo fibroso discal. En el adulto, por el contrario, finalizan su trayecto dentro de la plataforma epifisaria y los discos no están vascularizados.1,2 La columna vertebral es la principal localización de la osteomielitis en el adulto. La vía de acceso de los microorganismos suele ser hematógena y su foco inicial se sitúa predominantemente en las plataformas epifisarias, por lo que, durante su extensión, la infección involucra el disco adyacente. Cuando se hace el diagnóstico, lo habitual es que exista afección conjunta del cuerpo y del disco intervertebral (espondilodiscitis).3-6 Los mecanismos patogénicos de las espondilodiscitis infecciosas incluyen la diseminación de microorganismos desde focos contiguos y la inoculación directa en procedimientos diagnósticos o tratamientos quirúrgicos. La etiología y las características clínicas de estas formas yatrogénicas son diferentes7-10 y su frecuencia aumentó en las dos últimas décadas de forma paralela al mayor uso de técnicas intervencionistas sobre la columna vertebral. Frente a Mycobacterium tuberculosis, principal etiología de las espondilodiscitis infecciosas durante la primera mitad del siglo XX, Staphylococcus aureus, Streptococcus spp. y las bacterias gramnegativas son actualmente los microorganismos más prevalentes.4-6,8,11-16
Las espondilodiscitis infecciosas suponen del 2% al 5% de las osteomielitis en adultos y la incidencia de sus formas no yatrogénicas oscila de 0.5 a 2 casos por cada 100 000 habitantes y año.5,17,18 Debido a las dificultades para acumular experiencia en su manejo, analizamos los casos diagnosticados en nuestro centro a lo largo de los últimos 28 años y realizamos una revisión de la literatura.
Material y métodos
El hospital POVISA proporciona atención sanitaria a una población que, durante el período de estudio, ha aumentado de forma irregular de 75 000 a unos 127 000 habitantes. A partir de 1993 esta población se sitúa de forma estable alrededor de los 127 000 habitantes.
Realizamos una revisión retrospectiva y protocolizada de las historias de todos los pacientes diagnosticados de espondilodiscitis, tanto tuberculosa (EIT) como de otra etiología (EINT), entre el 1 de enero de 1978 y el 31 de diciembre de 2005. Se incluyeron los pacientes con semiología clínica y radiológica compatible en quienes se había aislado el microorganismo en el material obtenido del foco de EI, en dos o más hemocultivos o en ambos tipos de muestra. Se consideró confirmado el diagnóstico de EIT si se recuperaba Mycobacterium tuberculosis en el cultivo (medio de Löwenstein-Jensen) del material obtenido por biopsia o punción aspirativa del foco de EI o de localizaciones extravertebrales concomitantes. También se admitieron aquellos casos en los que se identificaron bacilos ácido-alcohol resistentes mediante Ziehl-Neelsen o granulomas caseificantes o ambos hallazgos en dichas muestras, junto con una buena respuesta al tratamiento tuberculostático.
Los parámetros evaluados en cada paciente fueron: edad, sexo, antecedentes médicos, posible puerta de entrada, sintomatología y signos clínicos, período entre el comienzo de los síntomas y el diagnóstico, pruebas de laboratorio y de diagnóstico por imágenes, procedimientos empleados en la obtención de muestras para diagnóstico microbiológico, tratamiento médico y quirúrgico, así como complicaciones sufridas durante la evolución.
El análisis estadístico de la asociación entre variables continuas se realizó mediante la prueba de la t de Student. Para las variables cualitativas se empleó la prueba de chi cuadrado o, cuando las condiciones así lo exigieron, la prueba exacta de Fisher. Se consideraron significativos los valores de p < 0.05.
Se revisó la literatura médica a través de Medline Embase-Plus desde 1975 hasta noviembre de 2005. Las palabras clave consultadas fueron espondilodiscitis bacteriana, espondilodiscitis infecciosa, discitis infecciosa, osteomielitis vertebral y espondilitis infecciosa.
Resultados
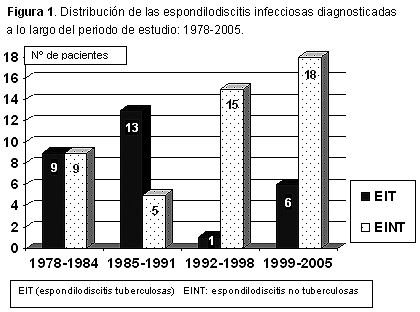
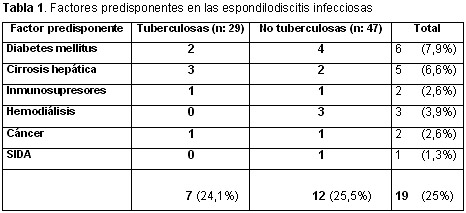
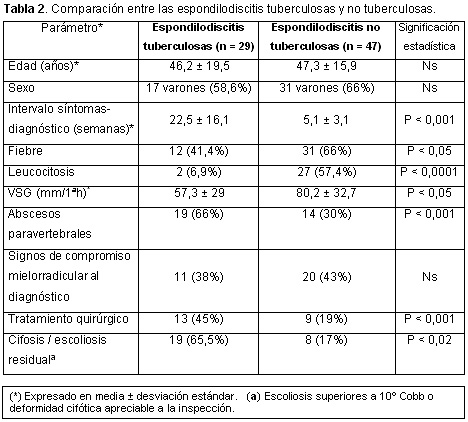
Se revisaron 90 historias de pacientes diagnosticados de espondilodiscitis infecciosa, de las que 76 fueron incluidas por cumplir los requisitos anteriormente citados y correspondieron a 29 EIT y 47 EINT. No se identificó ningún caso de espondilodiscitis fúngica. La figura 1 expone la distribución de las espondilodiscitis infecciosas durante el período 1978-2005. Hubo predominio de varones en ambos grupos, sobre todo en las EINT: 31/47 (66%) vs. 17/29 (58.6%) pero la diferencia no fue significativa. Todos los pacientes eran caucásicos y su edad osciló entre 16 y 83 años, con una media ± desviación estándar de 46.1 ± 19.5 años en las EIT y de 47.3 ± 15.9 años en las EINT. El dolor de ritmo inflamatorio en el segmento raquídeo involucrado fue común a todos los enfermos. La fiebre (temperatura axilar > 37.7º C) fue más frecuente en las EINT (64% vs. 41.4%; p < 0.05). En el momento del diagnóstico, existían síntomas y signos debidos a compromiso mielorradicular en 11 EIT (38%) y 20 EINT (43%). El período sintomático previo al diagnóstico fue superior en las EIT (22.5 ± 16 vs. 5.1 ± 3.1 semanas, p < 0.001). La velocidad de sedimentación globular (mm/1ª hora) estuvo elevada en 71 pacientes (93%) y su valor fue superior en las EINT: 80.2 ± 32.7 vs. 57.3 ± 29; p < 0.05. Los pacientes de este grupo también presentaron más leucocitosis (recuento leucocitario > 10 800/mm3): 57.4% vs. 6.9%; p < 0.0001. En 14 (48%) EIT se detectaron otros focos tuberculosos: pulmonares (7), pleurales (5), meníngeos (1) e intestinales (1). Había factores predisponentes sistémicos en 7 (24.1%) de las EIT y en 12 (25.5%) de las EINT, que se desglosan en la tabla 1.
Se identificó la potencial puerta de entrada en 28 EINT (59.6%), destacándose la cirugía previa de la columna vertebral (11 casos, 23.4%). Otros focos fueron infecciones cutáneas (5), catéteres endovenosos (3), adicción a drogas por vía parenteral (3), cirugía ginecológica (2), infecciones urinarias (2), neumonía (1) y piorrea (1).
La mayoría de las EINT fueron debidas a Staphylococcus aureus (31/47, 66%). Hubo tres casos producidos por estafilococos coagulasa negativos, dos por S. epidermidis y uno por S. hominis. El género Streptococcus fue causante de 6 casos (13%), S. pyogenes fue el más frecuente (4; 8.5%), seguido de S. agalactiae (2) y S. pneumoniae (1). Las siguientes bacterias se aislaron en un solo paciente: Klebsiella pneumoniae, Proteus mirabilis, Samonella typhi, Pseudomonas aeruginosa, Escherichia coli y Brucella abortus. En todos los casos se identificó un único microorganismo como agente etiológico.
El segmento L5-S1 estuvo involucrado en ocho EINT (17%) frente a ningún caso de etiología tuberculosa. El raquis lumbar se vio afectado en 23 (49%) de las EINT frente a 11 (37%) de las EIT; mientras que el segmento dorsal lo estuvo en 16 (34%) EINT y 11 EIT (38%). La charnela dorsolumbar (D12-L1) sólo se vio implicada en las EIT (7 pacientes, 24%). Se identificaron lesiones cervicales en 2 (7%) EIT y en 4 (8.5%) EINT. Dos pacientes en cada grupo presentaban focos no contiguos de espondilodiscitis en varios segmentos raquídeos (dorsales y lumbares). Se estableció la afección de más de dos vértebras consecutivas en un paciente con EINT y cuatro con EIT. Existía sacroilitis tuberculosa concomitante en un paciente con EIT y sacroilitis y artritis esternoclavicular en un paciente con espondilodiscitis estafilocócica.
Se realizaron radiografías simples sistemáticamente, que mostraron signos compatibles con el diagnóstico en las 29 (100%) EIT y en 41 (87%) EINT. En quienes se recurrió a la tomografía computarizada (40; 53%), a la resonancia magnética (18; 24%) o a las dos técnicas de imágenes (8; 11%) se identificaron lesiones características. Se observaron abscesos epidurales en 3 (10%) EIT y 5 (11%) EINT. En los 11 casos en que se realizaron gammagrafías con 99mTC o 67Ga se visualizó hipercaptación patológica de los trazadores en las vértebras implicadas.
En los pacientes con EIT fueron más frecuentes las secuelas neurológicas (7/29; 24% vs. 6/47; 13%; p < 0.005) y las deformidades residuales del raquis (19/29; 65% vs. 8/47; 17%; p < 0.002).
La terapia antibiótica intravenosa de las EINT se realizó según la susceptibilidad del microorganismo (antibiograma) y peculiaridades del paciente, su duración fue de 5.8 ± 1.2 semanas. Los controles periódicos ambulatorios se prolongaron entre 18 y 34 meses (23 ± 9 meses). Sólo se encontró una recidiva de una EIT a los tres años de finalizado el tratamiento. El único paciente que falleció presentaba una EINT estafilocócica en el contexto de una septicemia por este microorganismo.
La tabla 2 resume, de forma comparativa, los principales parámetros de ambos grupos de espondilodiscitis. Parte de esta serie había sido publicada anteriormente.5
Discusión
Durante el período de estudio (28 años) detectamos un cambio etiológico en las espondilodiscitis. En la primera mitad, hasta 1991, predominaba la etiología tuberculosa (61%), pero en la segunda mitad la mayoría de los casos fueron producidos por otros microorganismos (82.5%), sobre todo S. aureus. Aunque en algunas series Mycobacterium tuberculosis sigue dominando la etiología de las espondilodiscitis,4,13,19,20 S. aureus y las bacterias gramnegativas son en la actualidad los más aislados,5,6,8,11,12,15,21 incluso entre los pacientes infectados por el virus de la inmunodeficiencia humana.16 No identificamos ningún caso producido por micobacterias atípicas,22,23 bacterias anaerobias24 o por hongos, que son considerados todavía microorganismos raros, pero que se comunican cada vez con mayor frecuencia.6 Aunque en Galicia la incidencia de infección tuberculosa se sitúa en alrededor de 54 nuevos casos/105 habitantes/año, la asistencia sanitaria durante la última década mejoró y las formas contagiosas disminuyeron.25 Esta situación, junto con factores como el continuo incremento de las intervenciones quirúrgicas y de las maniobras intervencionistas sobre el raquis –como punciones lumbares, anestesia epidural, catéteres epidurales y discectomías percutáneas–, el envejecimiento de la población y el mayor número de personas con compromiso inmune, pueden haber contribuido a dicho cambio etiológico.6 Las EIT siguen siendo prevalentes en países subdesarrollados20 y entre los inmigrantes de origen africano en países desarrollados.26 Los varones predominan en la mayoría de las series5,11,13,14,26 y más de la mitad de los casos se producen entre los 40 y 70 años. Los pacientes con EIT tienden a ser más jóvenes5,20,26 y, en el momento del diagnóstico, del 10% al 38% presentan focos activos de tuberculosis extrarraquídea,26 sobre todo pulmonar y pleural, porcentaje que en nuestra serie alcanzó el 48%.
Entre las manifestaciones clínicas de las espondilodiscitis infecciosas destaca el dolor raquídeo local de ritmo inflamatorio, prácticamente constante, seguido de fiebre, que está presente en más de la mitad de los pacientes.4-6 En las EINT, el dolor y la impotencia funcional alcanzan mayor intensidad y la fiebre supera frecuentemente los 38ºC antes de iniciar el tratamiento.14 En alrededor de un tercio de los pacientes (20% al 50%)4,15,27,28,30 se aprecian signos de compromiso mielorradicular, pero entre las EIT esta proporción tiende a ser mayor.26 La leucocitosis es casi constante en las espondilodiscitis infantiles,29 pero sólo se demuestra en alrededor de la mitad de los adultos18,19 y en menos de la tercera parte de las formas tuberculosas. Su ausencia es más probable en mayores de 60 años30 y en quienes sufren un grave compromiso inmune.16 La VSG y los reactantes de fase, como la proteína C-reactiva, se elevan en prácticamente la totalidad de los pacientes y, como ocurrió en nuestra serie, sus valores tienen a ser superiores en las formas no tuberculosas. El período sintomático previo al diagnóstico en las EIT, por lo general, supera los 4 meses,4,13,26 y en algunos estudios alcanza el año,20 mientras que en las EINT no suele sobrepasar los dos meses.4,5,19,30
En EINT no yatrogénicas se incluyen como factores predisponentes: diabetes mellitus, tratamientos inmunosupresores, alcoholismo, enfermedades crónicas debilitantes y las neoplasias malignas,6,15,18,28,30,31 que se demuestran en un tercio de los casos (18% a 40%). Aunque el síndrome de inmunodeficiencia adquirida favorece los procesos infecciosos, excepto en adictos a drogas por vía parenteral, pocas veces se lo ha asociado con mayor prevalencia de espondilodiscitis infecciosas.16 Además, en estos enfermos, excepto por complicación con absceso epidural, la fiebre es una manifestación poco habitual (25%). La puerta de entrada de los microorganismos, según la serie, puede establecerse en el 25% al 80% de los pacientes4,5,14,18,28,30 y, por lo general, la diseminación de las bacterias tiene lugar por vía hematógena a partir de focos infecciosos situados a distancia, como infecciones urinarias, abscesos cutáneos y catéteres endovenosos. Los pacientes hemodializados,28,32,33 los adictos a drogas por vía parenteral11,16 y los diabéticos insulinodependientes28 tienen un riesgo especialmente elevado. Los traumatismos directos sobre el raquis y las lesiones previas (fracturas vertebrales, espondiloartrosis) pueden actuar como factor focalizador, al favorecer la decantación de patógenos.6,22 La inoculación directa es el mecanismo presumible en las espondilodiscitis posquirúrgicas, que representan el 15% al 30% de los casos.5,8,34 La invasión del raquis por contigüidad a partir de focos infecciosos es excepcional.
El 95% de las EINT son monomicrobianas y Staphylococcus aureus sensible la meticilina, como en nuestra serie (66%), es el principal agente etiológico.8,12,13,18,28 Pseudomonas aeruginosa, incluso en combinación con otras bacterias, se describió con mayor frecuencia en adictos a drogas por vía parenteral, sobre todo heroinómanos,11 pero en España, S. aureus también es la bacteria más aislada en este grupo de enfermos.36 Entre las personas mayores de 60 años con infecciones o instrumentación de las vías urinarias se incrementaron las EINT por gramnegativos.6,14,30 La obligatoria pasteurización de los productos lácteos redujo la incidencia de las EINT por Brucella spp., pero dista de ser una etiología excepcional en nuestro medio.13,35,37 El único paciente encontrado en nuestra serie era ganadero, profesión de riesgo para esta zoonosis. Los estafilococos coagulasa negativos se aíslan predominantemente en las EINT posquirúrgicas. Alrededor del 4% de las EINT, sobre todo las producidas por estreptococos del grupo viridans, se asocian a endocarditis bacteriana.6
La rentabilidad de los hemocultivos oscila entre el 35% y el 70%.4,5,11,27,30,31 La recuperación del microorganismo en dos hemocultivos junto con hallazgos sugestivos en las técnicas de diagnóstico por imágenes en un contexto clínico compatible permite establecer el diagnóstico en cerca del 25% de las EINT.5,30 Sin embargo, en la mayoría de los casos se requiere el estudio de muestras obtenidas por punción aspirativa, biopsia percutánea o biopsia abierta del foco de espondilodiscitis,4,5,12,14,26,28,30,38 cuya rentabilidad se sitúa en torno del 70% al 80%. En las EIT, debido al escaso número de bacilos, los métodos microbiológicos (tinción de Ziehl-Neelsen y cultivo de Löwenstein-Jensen) tienen un notable porcentaje (30% a 40%) de falsos negativos, parcialmente compensado con la histología (hallazgo de granulomas caseificantes típicos).4,20,26 La discectomía transpedicular percutánea es útil como procedimiento diagnóstico en aquellos casos sin inestabilidad ni complicaciones neurológicas.39 El aislamiento de microorganismos en el cultivo del material de los abscesos paravertebrales, presentes en el 15% al 20% de las espondilodiscitis infecciosas, es de valor etiológico. Hay estudios que preconizan la realización de pruebas de amplificación del ácido desoxirribonucleico por su mayor sensibilidad, sobre todo en aquellos casos en los que se plantea el diagnóstico de EIT versus EINT.26,40
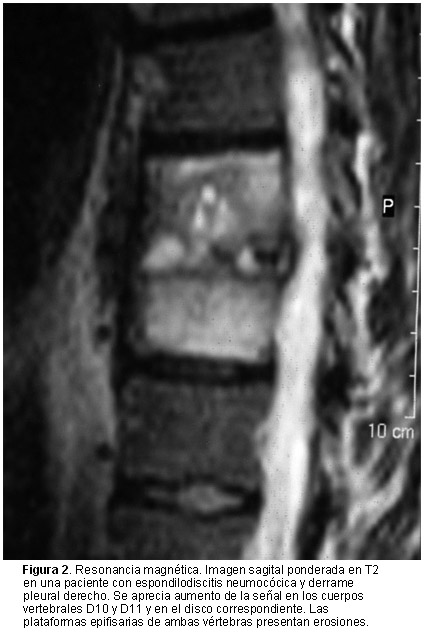
Como en nuestra serie, la técnica de imágenes de mayor rentabilidad diagnóstica es la resonancia magnética.12,20,34 Los cuerpos vertebrales afectados muestran hiperseñal en las secuencias ponderadas en T2 e hiposeñal en las secuencias ponderadas en T1, con realce tras la inyección de contraste (gadolinio). El realce es menos acusado y más heterogéneo en las EIT34 y puede reforzarse en el borde de la lesión.41 La aparición de erosiones en las plataformas epifisarias adyacentes al espacio discal involucrado es un hallazgo más tardío, aunque existen formas en las que no está afectado el espacio discal. La resonancia también permite evaluar las partes blandas paravertebrales e identificar los abscesos epidurales y paravertebrales.34 La tomografía computarizada es de elección para guiar la biopsia con trocar o la punción aspirativa, pero identifica lesiones con menos precocidad. Las gammagrafías óseas, tanto con 99mTc como con 67Ga son muy sensibles (> 95%) pero inespecíficas,5,14 aunque pueden estar indicadas en aquellos pacientes en que se sospeche una espondilodiscitis infecciosa multifocal (4% a 10% de los casos)4,14,30 o que presenten otros focos esqueléticos o viscerales. En las radiografías simples son hallazgos típicos la disminución del espacio discal, la borrosidad o las erosiones de las plataformas epifisarias y la destrucción del cuerpo vertebral, pero su presencia requiere, al menos, 3 semanas de evolución, lo que se prolonga en el caso de microorganismos poco virulentos o micobacterias.
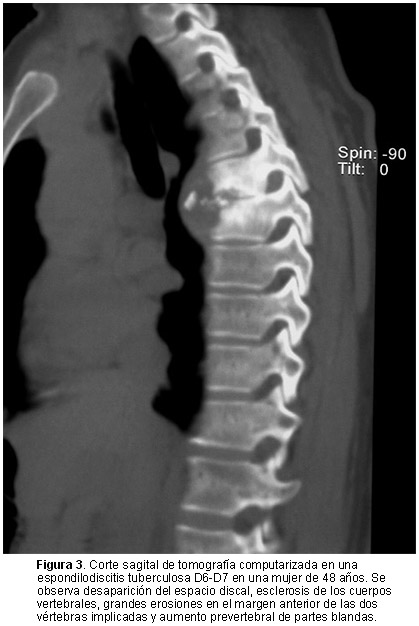
Las espondilodiscitis infecciosas afectan predominantemente las regiones dorsal y lumbar, la localización cervical es rara (menos del 10% de los pacientes).4,5,14 Por lo común, las EIT asientan en vértebras dorsales y las primeras lumbares, resultado excepcional en L5-S1.15,21 Casi todas las EINT posquirúrgicas (5% a 41% del total)5,34,42 involucran las dos últimas vértebras lumbares y la primera sacra. En nuestro hospital, la cirugía de la columna vertebral tiene una baja tasa de complicaciones infecciosas (0.47%)5 frente a lo indicado en otras series (1% a 4%).42-44 La profilaxis antibiótica44 o incluso la irrigación con una solución de tintura de yodo durante el cierre de la herida quirúrgica reducen sustancialmente la tasa de EINT posquirúrgicas.45
El diagnóstico diferencial de las espondilodiscitis infecciosas se plantea con entidades que pueden provocar dolor y alteraciones radiográficas parecidas en la columna vertebral, como ocurre con las neoplasias,46 la osteonecrosis vertebral y algunas enfermedades por depósito.47 El diagnóstico entre EIT y EINT debe hacerse mediante métodos microbiológicos. La combinación de datos radiológicos, de laboratorio y clínicos sólo es orientativa.48 Así, las EIT suelen cursar de modo más insidioso, con menor elevación de la velocidad de sedimentación globular y de la proteína C-reactiva, ausencia de leucocitosis y con más abscesos paravertebrales. En nuestra revisión excluimos 14 de los 90 casos (16%), por haber sido diagnosticados y tratados empíricamente, eventualidad que se justifica en determinadas situaciones, como enfermos críticos o inestables que no toleren maniobras intervencionistas. Los casos tratados empíricamente suponen un porcentaje variable, que llega a superar el 35% en alguna serie.20
El tratamiento es básicamente médico, debe instaurarse de forma temprana y selectiva e incluye reposo, órtesis de descarga del segmento raquídeo afectado y antibioticoterapia.5,11,15 En las EIT, salvo resistencias o hipersensibilidad, suele utilizarse la combinación de isoniazida, rifampicina y etambutol durante tres meses, seguida de isoniazida y rifampicina durante otros seis meses, aunque algunos aconsejan pautas más largas.4,26,49 En las EINT se recomienda antibioticoterapia endovenosa durante 6 ± 2 semanas,5,11,29,50 seguida de formulaciones orales hasta completar 24-36 semanas. Las formas posquirúrgicas, sobre todo si hay material de osteosíntesis, requieren habitualmente tratamientos más prolongados.8 La cirugía está indicada en cuatro circunstancias: obtención de muestras para diagnóstico etiológico cuando la punción aspirativa o la biopsia percutánea han sido infructuosas, existencia de un absceso paravertebral de gran tamaño que no puede drenarse mediante un catéter, lesión mielorradicular grave que requiere descompresión4,26 y si existe una marcada inestabilidad vertebral o deformidad cifoescoliótica.5,14,15,50 La mayoría de las EIT4,26,51 pueden manejarse de forma conservadora, las localizaciones dorsales y cervicales son más propensas a complicaciones neurológicas graves susceptibles de cirugía, sobre todo si afectan a pacientes inmunodeprimidos y a mayores de 70 años.
La mortalidad es inferior al 5%,5,13,34,51 con escasas excepciones.16,30 Las recidivas oscilan entre el 3% y el 20%.11,14,27,42 Las secuelas neurológicas varían según la etiología y el retraso diagnóstico (8% a 41%).4,5,14,27,30 La evolución natural es hacia la fusión espontánea de los cuerpos vertebrales involucrados, lo que sucede en más de la mitad de los pacientes en un plazo inferior a dos años.
BIBLIOGRAFÍA
1. Wiley AM, Trueta J. The vascular anatomy of the spine and its relationship to pyogenic vertebral osteomielitis. J Bone Joint Surg 1959; 41 B:796-809.
2. Rudert M, Tillmann B. Lymph and blood suply of the human intervertebral disc. Cadáver study of correlations to discitis. Acta Orthop Scand 1993; 64:37-40.
3. Sapico FL, Montgomerie JZ. Vertebral osteomyelitis. Infect Dis Clin North Am 1990; 4:539-550.
4. Perronne C, Saba J, Behloul Z, Salmon-Ceron D, Leport C, Vildé J L, Kahn MF. Pyogenic and tuberculous spondylodiskitis (vertebral osteomyelitis) in 80 adult patients. Clin Infect Dis 1994; 19:746-750.
5. Gómez N, Penelas-Cortés Y, Ibáñez J, González M, Sánchez ML. Espondilodiscitis infecciosas en un área sanitaria gallega, 1983-2003. An Med Interna (Madrid) 2004; 21:533-539.
6. Fiter J, Gómez C, Miquel J. Espondilodiscitis infecciosa. Perspectiva actual de un viejo problema. Rev Esp Reumatol 1999; 26:91-99.
7. Jiménez-Mejías ME, Colmenero JD, Sánchez-Lora FJ, Palomino-Nicás J, Reguera JM, García de las Heras J et al. Postoperative spondylodiskitis: etiology, clinical findings, prognosis and comparison with nonoperative pyogenic spondylodiskitis. Clin Infect Dis 1999; 29:339-345.
8. Carrega G, Arena S, Bartolacci V, Gavino D, Mecca D, Sandrone C et al. Spondilodisciti non tubercolari: valutazione prospettica di 45 pazienti seguiti presso un unico. Infez Med 2003; 11:183-188.
9. Tasdemiroglu E, Sengöz A, Bagatur E. Iatrogenic spondylodiscitis. Case report and review of literature. Neurosurg Focus 2004; 16:1-5.
10. Dufour V, Feydy A, Rillardon L, Redondo A, Le Page L, Bert F et al. Comparative study of postoperative and spontaneous pyogenic spondylodiscitis. Sem Arhtritis Rheum 2005; 24:766-771.
11. Patzakis M, Rao S, Wilkins J, Moore TM, Harvey P. Analysis of 61 cases of vertebral osteomyelitis. Clin Orthop 1991; 264:178-183.
12. Stefanovski N, Van Voris LP. Pyogenic vertebral osteomyelitis: report of a series of 23 patients. Contemp Orthop 1995; 31:159-164.
13. Belzunegui J, Del Val N, Intxausti JJ, De Dios JR, Queiro R, González C. Vertebral osteomyelitis in northen Spain. Report of 62 cases. Clin Exp Rheumatol 1999; 17:447-452.
14. Nolla JM, Ariza J, Gómez-Vaquero C, Fiter J, Bermejo J, Valverde J et al. Spontaneous pyogenic vertebral osteomyelitis in nondrug users. Sem Arthritis Rheum 2002; 31:271-278.
15. Gasbarrini A, Bertoldi E, Mazzetti M, Fini L, Terzi S, Gonella F et al. Clinical features, diagnostic and therapeutic approaches to hematogenous vertebral osteomyelitis. Eur Rev Med Pharmacol Sci 2005; 53-66.
16. Weinstein MA, Eismont FJ. Infections of the spine in patients with human inmunodeficiency virus. J Bone Joint Surg 2005; 87(A):604-609.
17. Krogsgaard MR, Wagn P, Bengtsson J. Epidemiology of acute vertebral osteomyelitis in Denmark: 137 cases in Denmark 1978-1982 compared to cases reported to the National Patient Register 1991-1993. Act Orthop Scand 1998; 69:513-517.
18. Hopkinson N, Stevenson J, Benjamin S. A case ascertainment study of septic discitis: clinical, microbiological and radiological features. Q J Med 2001; 94:465-470.
19. Alvarez E, Torres R, Gutiérrez A, Serrano M, Mao L, Lozano MA. ¿Cómo se presenta la espondilitis infecciosa? An Med Interna (Madrid) 2005; 22:355-356.
20. Ben-Taarit C, Turki S, Ben-Maiz H. Spondylodiscites infectieuses. Etude d'une serie de 151 cas. Act Orthop Belg 2002; 68:381-387.
21. Morillo G, Alcaraz MA, Díaz P, Sáenz L, Artime C, Labarta C. Características clínicas de la lesión medular de causa infecciosa. Rev Neurol 2005; 41:205-208.
22. Chan ED, Kong PM, Fennelly K, Dwyer AD, Iseman MD. Vertebral osteomyelitis due to infection with nontuberculous Mycobacterium species after blunt trauma to the back: 3 examples of the principle of locus minoris resistentiae. Clin Infect Dis 2001; 32:1506-1510.
23. Petitjean G, Fluckiger U, Scharen S, Laifer G. Vertebral osteomyelitis caused by non-tuberculous mycobacteria. Clin Microbiol Infect 2004; 951-953.
24. Saeed M, Mariani P, Martin C, Smego RA, Potti A, Tight R, Thiege D. Anaerobic spondylodiscitis: case series and systematic review. South Med J 2005; 98:144-148.
25. Salgueiro M, González J, Zamarrón C, Pombo M, Ricoy J, Presedo MB et al. Tuberculosis en el área de Santiago de Compostela durante los años 1999, 2000, 2001 y 2002. Un estudio epidemiológico. An Med Interna (Madrid) 2004; 21:215-222.
26. Pertuiset E, Beaudreuil J, Lioté F, Horusitzky A, Kemiche F, Richette P et al. Spinal tuberculosis in adults. A study of 103 cases in a developed country, 1980-1994. Medicine (Balt) 1999; 78:309-320.
27. Colmenero JD, Jiménez-Mejías ME, Sánchez-Lora FJ, Reguera JM, Palomino-Nicás J, Martos F et al. Pyogenic, tuberculous and brucellar vertebral ostemyelitis. A descriptive and comparative study of 219 cases. Ann Rheum Dis 1997; 56:709-715.
28. Priest DH, Peacock JE. Hematogenous vertebral osteomyelitis due to Staphylococcus aureus in the adult: clinical features and therapeutic outcomes. Shouth Med J 2005; 98:854-862.
29. Rubio B, Calvo C, García-Consuegra J, Ciria L, Navarro ML, Ramos JT. Espondilodiscitis en la comunidad autónoma de Madrid. An Pediat 2005; 62:147-152.
30. Carragee EJ. Pyogenic vertebral osteomyelitis. J Bone Joint Surg 1997; 79A:874-880.
31. García-Vadillo JA, López-Robledillo JC, Díaz-González F, Verdejo J, Umbría A, García-Vicuña R. Espondilodiscitis infecciosa. Estudio de 30 casos. Rev Esp Reumatol 1991; 18:123-126.
32. Valero R, Castañeda O, De Francisco ALM, Piñera C, Rodrigo E, Arias M. Sospecha clínica de osteomielitis vertebral: dolor de espalda en los pacientes con infección asociada a catéter de hemodiálisis. Nefrología 2004; 24:583-588.
33. Tsuchiya K, Yamaoka K, Tanaka K, Sasaki T. Bacterial spondylodiscitis in the patients with hemodiálysis. Spine 2004; 29:2533-2537.
34. Maiuri F, Laconetta G, Gallicchio B, Manto A, Briganti F. Spondylodiscitis. Clinical and magnetic resonance diagnosis. Spine 1997; 22:1741-1746.
35. Solera J, Lozano E, Martínez-Alfaro E, Espinosa A, Castillejos ML, Abad L. Brucellar spondylitis: review of 25 cases and literature survey. Clin Infect Dis 1999; 29:1440-1449.
36. Grupo de Trabajo para el Estudio de la Infección en Drogadictos. Estudio multicéntrico de las complicaciones infecciosas en adictos a drogas por vía parenteral en España: análisis final de 17592 casos (1977-1991). Enferm Infecc Microbiol Clin 1995; 13:532-539.
37. Gómez-Puerta JA, Pomes J, Sanmartí R. Brucelosis humana. Características clínicas con énfasis en las manifestaciones osteoarticulares. Semin Fund Esp Reumatol 2005; 6:93-102.
38. Fouquet B, Goupille P, Gobert F, Cotty P, Roulot B, Valat JP. Spondilodiscites infectieuses: apport diagnostique des examens biologiques et de la ponction-biopsie disco-vertébrale. Rev Rhum Mal Osteoartic 1996; 63:26-31.
39. Hadjipavlou AG, Katonis PK, Gaitanis IN, Muffoletto AJ, Tzermiadianos MN, Crow W. Eur Spine J 2004; 13:707-713.
40. Lecouvet F, Irenge L, Vandercam B, Nzeusseu A, Hamels S, Gala JL. The etiologic diagnosis of infectious discitis is improved by amplification-based DNA analysis. Arthritis Rheum 2004; 50:2985-2994.
41. Driffith JF, Kumta SM, Leung PCh, Cheng JCY, Chow LTC, Metreweli C. Imaging of musculoskeletal tuberculosis: A new look at an old disease. Clin Orthop 2002; 398:32-39.
42. Ozuna RM, Delamarter RB. Pyogenic vertebral osteomyelitis and postsurgical disc space infections. Orthop Clin North Am 1996; 27:87-94.
43. Schulitz KP, Assheuer J. Discitis after procedures on the intervertebral disc. Spine 1994; 19:1172-1177.
44. Rohde V, Meyer B, Schaller C, Hassler WE. Spondylodiscitis after lumbar discectomy: incidence an a proposal for prophylaxis. Spine 1998; 23:615-620.
45. Ming-Te C, Ming-Chau C, Shih-Tien W, Wing-Kwang Y, Chien-Lin L, Tain-Hsiung C. Efficacy of dilute Betadine solution irrigation in the prevention of postoperative infection of spinal surgery. Spine 2005; 30:1689-1693.
46. Jutte P, Van Altena R, Pras E, Thijn CJP. Causes of misdiagnosis and mistreatment of spinal tuberculosis with radiotherapy in nonendemic areas: a pitfall in diagnosis and treatment. Hazards of radiotherapy on the tuberculous lesion. Spine 2005; 30:E-300-E304.
47. Yen PS, Lin JF, Chen SY, Lin SZ. Tophaceous gout of the lumbar spine mimicking infectious spondylodiscitis and epidural abscess: MR imaging findings. J Clin Neur 2005; 12:44-46.
48. Wang D. Diagnosis of tuberculous vertebral osteomyelitis (TVO) in a developed country and literature review. Spinal Cord 2005; 43:531-542.
49. Comican L, Hammal R, Messenger J, Milburn HJ. Current difficulties in the diagnosis and management of spinal tuberculosis. Postgrad Med J 2006; 82:46-51.
50. Norden C, Gillespie WJ, Nade S. Vertebral osteomyelitis and disk space infection. En: Infections in bones and joints. Blackwell Scientific Publications, Cambridge. 1994; pp:231-248.
51. Nene A, Bhojraj S. Results of nonsurgical treatment ot thoracic spinal tuberculosis in adults. Spine 2005; 5:79-84.
|


![]()


