Introducción
A pesar de que su comercialización comenzó en 1899, el ácido acetil salicílico (AAS) o aspirina es una de las medicaciones más utilizadas, aunque apenas se lo utiliza como antiinflamatorio es –solo o en asociación con otros fármacos– una de las medicaciones más utilizadas como analgésico sin prescripción o de venta libre.
Asimismo, la eficacia de las dosis bajas (< 300 mg) en el tratamiento y prevención de la cardiopatía isquémica y la enfermedad cerebrovascular ha supuesto un gran incremento de las ventas de dicha dosis durante la última década. Irónicamente, en los años ’20 la aspirina era comercializada resaltando que no presentaba efectos a nivel cardíaco, al contrario de lo que sucedía con otros fármacos comercializados en aquella época.
La aspirina, al igual que otros fármacos con acción antiplaquetaria, ejerce una acción protectora en la mayor parte de los pacientes con alto riesgo de padecer fenómenos oclusivos vasculares a nivel cardíaco, cerebral y periférico.1 Sin embargo, no se conoce si la adición de otros fármacos antiplaquetarios podría aportar beneficios adicionales en alguna situación clínica.
A pesar de la clara evidencia del beneficio de la aspirina en la prevención de eventos tromboembólicos y de que tiene un perfil riesgo-beneficio favorable, su uso sigue siendo todavía subóptimo en los pacientes de alto riesgo, probablemente debido al riesgo de efectos adversos gastrointestinales.2,3 A diferencia de lo que sucede con otros antiinflamatorios no esteroides (AINE), la información disponible en cuanto a la toxicidad gastrointestinal asociada con el empleo de aspirina en dosis baja es más escasa. Si bien en términos relativos la magnitud del problema es inferior a la observada con otros AINE, todavía es sustancial en términos absolutos.
La búsqueda de nuevas indicaciones de la aspirina en dosis bajas es un campo de intensa investigación. Estudios epidemiológicos recientes sugieren que la aspirina puede ser efectiva en otras patologías como el cáncer gastrointestinal.4- 6 También se la asocia con menor incidencia de enfermedad de Alzheimer.7 Dos estudios aleatorizados a doble ciego publicados recientemente demostraron que la aspirina reduce de manera significativa la incidencia de adenomas colorrectales en pacientes de alto riesgo.8,9 Sin embargo, estos resultados positivos difieren de los obtenidos en otro estudio reciente que comparó la incidencia de cáncer en 29 470 individuos que tomaban aspirina en dosis bajas. En dicho estudio no se observó efecto protector de la aspirina durante un período de 9 años.10
Estos efectos terapéuticos recientemente descritos implican que el abanico de enfermedades en las que la aspirina puede resultar beneficiosa se amplía progresivamente. A pesar de ello, no hay que olvidar que no existe evidencia científica a favor o en contra de la utilización de aspirina para disminuir la mortalidad en pacientes de bajo riesgo.11
Lesiones originadas por bajas dosis de aspirina
La asociación entre la ingesta de AINE y aspirina y la aparición de lesiones en la mucosa gastroduodenal y complicaciones gastrointestinales es ampliamente conocida. Existen diferentes factores de riesgo de gastropatía por AINE entre los que se incluyen el tipo de AINE y la dosis. Las dosis de aspirina utilizadas en la prevención de enfermedades cardiovasculares oscilan entre 75 y 300 mg diarios, es decir, dosis relativamente bajas que pueden crear una “falsa” impresión de que son seguras. Sin embargo, diferentes estudios demostraron que la aspirina –incluso administrada a bajas dosis– induce lesiones gastrointestinales, de forma similar a lo observado con otros AINE, si bien la magnitud de dichas lesiones parece ser diferente.
Los estudios en los que se ha realizado un control endoscópico demuestran que la ingesta de 300 mg/día de ácido acetilsalicílico durante 14 días induce la formación de petequias, erosiones (< 3 mm de diámetro) o úlceras endoscópicas (≥ 3 mm de diámetro),12,13 que pueden estar presentes hasta en 60% de los pacientes al cabo de un mes de tratamiento.14 Valores similares se obtuvieron con 150 mg de aspirina.15 Otros estudios mostraron que la ingesta de 75 mg/día de aspirina induce hemorragia subclínica en la mucosa gástrica, sin que se desarrollen fenómenos de adaptación mucosa (descenso de la lesión con el tiempo) al observar que las tasas de hemorragia subclínica, medidas como concentración de hemoglobina en los lavados gástricos, se mantenían elevadas aun transcurridos 30 días del inicio de la terapia.16,17
Observaciones indirectas, obtenidas de estudios prospectivos, a doble ciego y controlados con placebo, demostraron que el uso a largo plazo de aspirina en bajas dosis se asocia con mayor incidencia de úlceras gastroduodenales (10% frente a 2%).18 Cryer y Feldman19 hallaron que 10% de los pacientes que toman aspirina en bajas dosis (desde 10 a 300 mg/día) durante 12 semanas presentan úlceras gástricas demostradas endoscópicamente.
Sin embargo, las lesiones agudas tienen una relevancia clínica dudosa, cuando menos, ya que en la mayor parte de los casos no se asocian con síntomas y tampoco con lesiones más graves. Más importante desde el punto de vista clínico es la aparición de complicaciones como la hemorragia gastrointestinal, que puede poner en peligro la vida de los pacientes. Todos los estudios que evaluaron los beneficios de la administración de aspirina a bajas dosis en enfermedades vasculares oclusivas, demostraron un incremento significativo de la incidencia de hemorragia gastrointestinal. En cifras absolutas, el tratamiento con 100 mg/día de aspirina provocó hemorragia gastrointestinal evidente en 3% de los pacientes ≥ 70 años frente a 0% en el grupo tratado con placebo.20 De forma similar, un estudio de casos y controles que combinó los resultados de 9 estudios con aspirina en dosis entre 75 y 325 mg/día, demostró que la incidencia de hemorragia gastrointestinal era 1.5 veces mayor en el grupo de tratamiento con aspirina frente al grupo placebo,21 con una probabilidad mensual de hemorragia por 1 000 pacientes de 0-2.1.
En un estudio de cohortes llevado a cabo en nuestro medio, la incidencia de hemorragia digestiva tras el alta hospitalaria de pacientes con enfermedad cardiovascular fue de 1.2 casos por 100 pacientes/año a lo largo del seguimiento (que en este estudio fue de 45 ± 22 meses); lo que sitúa a la aspirina en un nivel inferior al visto con AINE clásicos, pero superior todavía al estimado con los nuevos inhibidores de la COX-2.22 En términos de riesgo relativo, la utilización de aspirina en las dosis más comúnmente prescritas en España hasta hace poco (200 mg/día) multiplicaba el riesgo de hemorragia digestiva alta por 2.4, riesgo 3 veces inferior al observado con AINE convencionales.23
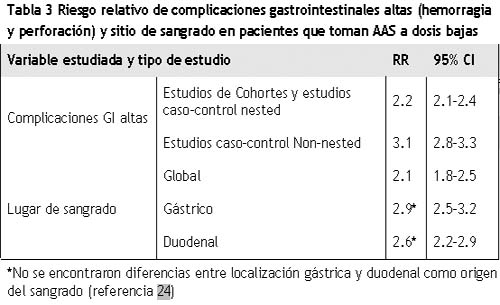
En un reciente metaanálisis que incluyó datos de 17 estudios epidemiológicos publicados entre 1990 y 2001 se confirmó que la aspirina aumenta el riesgo de complicaciones gastrointestinales. Dada la heterogeneidad existente entre los estudios analizados, los autores calcularon por separado el RR en estudios de cohortes, éste fue de 2.2 (95% IC: 2.1-2.4), y para los de casos y controles, en los que resultó de 3.1 (95% IC: 2.8-3.3).24
Factores de riesgo
Durante la última década se publicaron numerosos estudios que han contribuido a esclarecer cuáles son los factores de riesgo que influyen en la aparición de gastropatía por AINE, y que son la edad > 60 años, historia previa de úlcera o complicación, uso concomitante de dos AINE (incluyendo aspirina en dosis bajas), uso concomitante de corticoides o anticoagulantes, presencia de enfermedades concomitantes graves, etc. Paradójicamente, las evidencias disponibles acerca de qué factores son importantes en la aparición de complicaciones gastrointestinales en pacientes que consumen aspirina en dosis bajas son más limitadas.
Con los datos disponibles el principal factor de riesgo para la aparición de hemorragia digestiva alta (HDA) en pacientes en tratamiento con aspirina en dosis bajas es la historia de úlcera péptica o de HDA previa. Otro factor importante es el empleo concomitante de otro AINE. También se han propuesto otros factores como el consumo de alcohol, el empleo de antagonistas del canal del calcio, la edad o la presencia de enfermedades vasculares oclusivas, aunque se precisan más estudios que clarifiquen qué papel desempeñan.23,25,26 La infección por Helicobacter pylori es otro factor de riesgo importante, pero la magnitud de dicho riesgo todavía debe ser definida.23,26 La propia condición de padecer una enfermedad cardiovascular parece ser un factor de riesgo independiente para presentar hemorragia.27
Como se mencionó, uno de los principales factores de riesgo de aparición de lesiones en el tracto GI en estos pacientes es el uso concomitante de otros AINE.
En un estudio epidemiológico se demostró que si se añade aspirina en dosis bajas en pacientes que toman AINE el riesgo basal aumenta por un factor adicional de 3.1.26 También se debe tener en cuenta que no todas las asociaciones entre AINE y aspirina son beneficiosas desde el punto de vista terapéutico. De hecho, se demostró in vitro que entre ibuprofeno y aspirina existe una interacción en la función plaquetaria, la cual no se observa con rofecoxib, diclofenac o paracetamol. En esta línea, un estudio reciente demostró que entre los pacientes que tomaban ibuprofeno junto con aspirina en dosis profilácticas (en este estudio, < 325 mg/día) la mortalidad por causas cardiovasculares fue significativamente mayor que en el grupo que sólo tomaba aspirina.28
Un aspecto de interés fue conocer si todas las dosis se asocian con el mismo riesgo de hemorragia. Los datos obtenidos de estudios recientes señalan que no existe una escala de riesgo dependiente de la dosis, siendo el riesgo similar para todas las dosis utilizadas en la profilaxis cardiovascular,29 sin que exista evidencia científica que apoye la reducción de las dosis de aspirina.30 Estos datos difieren de los obtenidos en estudios más clásicos que sugerían que todas las dosis utilizadas en enfermedades cardiovasculares se asociaban a un incremento del riesgo de hemorragia digestiva, aunque éste aumenta conforme se incrementa la dosis (OR: 75 mg = 2.3; 150 mg = 3.2; 300 mg = 3.9).31
Igualmente interesante es la constatación de que las formulaciones de aspirina tamponadas o con cubierta entérica, que poseen similar actividad antiplaquetaria,32 se asocian con una disminución de lesiones agudas de la mucosa gástrica, pero no con una reducción del riesgo de lesiones mucosas duodenales ni de hemorragia gastrointestinal,33 que es el punto de mayor relevancia clínica. En un metaanálisis reciente se evaluó si existían diferencias en cuanto al riesgo según el tipo de presentación. Para la presentación normal de aspirina el RR de complicaciones gastrointestinales fue de 2.6 (95% IC: 2.3-2.9); de 5.3 (95% IC: 3.0-9.2) para aspirina tamponada (con acidez neutralizada), y de 2.4 (95% IC: 1.9-2.9) para aspirina con cubierta entérica.15 De forma similar, en un estudio de casos y controles se comprobó que el RR de complicaciones GI fue similar en pacientes que utilizaron aspirina con cubierta entérica (RR = 2.3; 95% IC: 1.6-3.2) que en los pacientes que utilizaron la presentación tradicional (RR = 1.9; 95% IC: 1.6- 2.3).29 Asimismo, un metaanálisis analizó el efecto de presentaciones de liberación retardada (4 298 pacientes de 5 estudios diferentes con dosis entre 75 y 1 500 mg diarios) y halló que las diferencias en presentaciones no se traducen en una disminución significativa el riesgo de HDA (OR: 1.93; 95% IC: 1.15-3.23).30
El papel que la infección por H. pylori ejerce en la aparición de complicaciones es todavía controvertido, aunque evidencias recientes sugieren que la infección por H. pylori aumenta el riesgo de daño de la mucosa gastroduodenal en pacientes que toman aspirina en dosis bajas (Tablas 1 y 2).14,19,26,34-39 Un estudio epidemiológico reciente específicamente diseñado para evaluar el papel que tiene la infección por H.
pylori en estos pacientes determinó que esta infección es un factor de riesgo independiente de hemorragia gastrointestinal (OR: 4.7; 95% IC: 2.0- 10.9).26 En la misma línea, un reciente estudio de casos y controles que analizó la relación entre la infección por H. pylori y AI
NE (incluyendo aspirina en dosis bajas) en la aparición de complicaciones ulcerosas, comprobó que los efectos de H. pylori (en dicho estudio únicamente se incluyeron cepas CagA +) y aspirina en dosis < 300 mg eran compatibles con un efecto aditivo de ambos factores.34

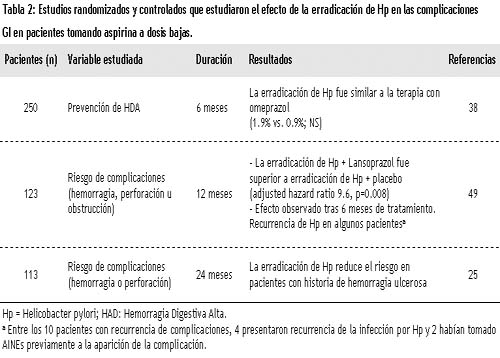
Estudios aleatorizados también confirmaron que la erradicación de H. pylori se asociaba con una reducción en la aparición de complicaciones gastrointestinales (Tabla 2).35,40,41
Evidencias disponibles en la prevención de la toxicidad gastrointestinal inducida por aspirina a bajas dosis
La aspirina a dosis bajas es ampliamente utilizada en pacientes con enfermedades cardiovasculares y en aquellos de edad avanzada, que constituyen, a priori, poblaciones bien definidas de mayor riesgo para sufrir complicaciones gastrointestinales con el uso de AINE convencionales. En consecuencia, y siguiendo los estándares habituales, esta población debería recibir gastroprotección. Sin embargo, por paradójico que parezca, los estudios disponibles que hacen referencia a la definición de los factores de riesgo y a las terapias para reducir las lesiones o las complicaciones son abundantes para los AINE clásicos, pero muy limitados para el uso de aspirina en bajas dosis.
Con las evidencias disponibles, se considera que el paciente que tenga uno o varios de los factores de riesgo mencionados debería recibir profilaxis. De igual manera, la existencia de enfermedad grave concomitante puede ser motivo suficiente para añadir profilaxis gastroduodenal, pues una hemorragia, por leve que ésta fuera, podría poner en peligro la vida del enfermo.
La siguiente cuestión es definir cuál es la mejor estrategia para evitar complicaciones en los pacientes que toman aspirina en dosis bajas como profilaxis cardiovascular. Desafortunadamente no existen estudios que hayan respondido esta cuestión de manera adecuada. Basados en los datos disponibles para AINE convencionales, los inhibidores de la bomba de protones y el misoprostol deberían ser terapias adecuadas para este cometido. Sin embargo, otros antisecretores y la eliminación de la infección por Helicobacter pylori podrían desempeñar también algún papel42-44 (Tabla 3).
Prevención del daño mucoso agudo
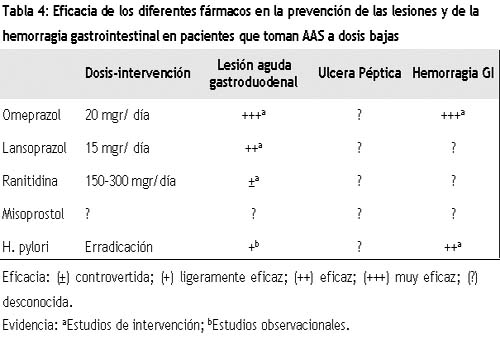
En un estudio reciente se demostró que la administración de 100 μg/día de misoprostol reduce la aparición de erosiones originada por 300 mg diarios de AAS en voluntarios sanos (OR: 0.18, 95% IC: 0.07-0.48) sin apenas efectos adversos.45 Sin embargo, no hay datos del efecto profiláctico del misoprostol en pacientes de alto riesgo.
Los inhibidores de la bomba de protones pueden darse de forma concomitante a la aspirina, de hecho, en voluntarios sanos el omeprazol no interfiere con la actividad biológica de la aspirina a dosis de 125 mg.46 En un estudio endoscópico se comprobó que el omeprazol en dosis de 20 mg/día reduce de manera casi completa el daño de la mucosa gastroduodenal originado por la toma de 300 mg/día de aspirina durante 14 días.12 En un estudio diseñado de manera muy similar, el lansoprazol a dosis de 15 mg/día ofrece una protección significativa en los pacientes que toman aspirina en dosis de 300 mg/día, hecho que no se lograba con ranitidina a 300 mg/día47 (Tabla 4).
Los resultados obtenidos con anti-H2 son al menos contradictorios, ya que en diferentes estudios no endoscópicos y en los que el daño de la mucosa gástrica se evaluó mediante la presencia de sangre en lavados gástricos, la administración de ranitidina a dosis de 150 mg/día redujo el daño mucoso inducido por aspirina.48,49
Otra posibilidad de reducir las lesiones asociadas al consumo de AAS a dosis bajas es la de utilizar moléculas o presentaciones menos lesivas. Ya hemos comentado con anterioridad que tanto la preparación tamponada como la aspirina con cubierta entérica presentan el mismo riesgo de complicaciones gastrointestinales que la presentación clásica. El NCX-4016 es un compuesto derivado de la aspirina que además libera óxido nítrico. Por ello, no sólo inhibe (in vivo e in vitro) las ciclooxigenasas 1 y 2 y, secundariamente la síntesis de prostanoides derivados de dicha actividad enzimática, sino que además ejerce otras acciones derivadas del óxido nítrico (NO). En esta línea, el beneficio que la liberación del óxido nítrico tiene en la reducción del riesgo de hemorragia digestiva en pacientes que consumen AINE (incluido AAS) ha sido previamente demostrado.23 Asimismo, la liberación de NO tras la administración de este compuesto tiene importantes efectos antiescleróticos y antioxidantes en la pared arterial en un modelo experimental de hipercolesterolemia.50
En un estudio reciente51 de grupos paralelos, aleatorizado y a doble ciego se evaluó la capacidad lesiva de la molécula NCX-4016 frente a la aspirina. En dicho estudio se evaluó la actividad antiplaquetaria de la molécula y las lesiones endoscópicas que originaba. Los resultados son francamente esperanzadores, ya que por un lado dicho fármaco mantiene las propiedades antiplaquetarias de la aspirina, dado que no se hallaron diferencias significativas entre ambos fármacos en la agregación plaquetaria ni los niveles de tromboxano B2 sérico pretratamiento y postratamiento. En segundo lugar, el daño mucoso endoscópico a los 7 días de tratamiento era significativamente mayor en el grupo de voluntarios tratados con AAS (dosis de 200 mg/12 h y 400 mg/12 h) que en los tratados con NCX-4016 (dosis de 400 mg/12 h y 800 mg/12 h), siendo en este último grupo similar al observado con placebo.
Son necesarios estudios que determinen si estos resultados se obtienen también en poblaciones de riesgo y cuál sería el costo del tratamiento, pero los resultados son alentadores.
Prevención de complicaciones
Desde el punto de vista clínico son mucho más importantes las evidencias disponibles que hacen relación a la eficacia de estos fármacos en la prevención de complicaciones.
En un reciente estudio epidemiológico se comprobó que el omeprazol reducía en un 80% el riesgo de hemorragia digestiva asociada a la toma de aspirina. El grado de reducción obtenido con anti-H2 era menor y similar al observado con la toma concomitante de nitritos23 (Tabla 4). Un estudio español prospectivo, abierto, en pacientes de riesgo con historia reciente de hemorragia digestiva, mostró una frecuencia muy baja de recidiva de la hemorragia en pacientes que tomaban omeprazol en dosis de 20 mg/día y aspirina en dosis de 200 mg/día durante un año de tratamiento.40

En un estudio de mayor impacto se pudo comprobar que, tras 6 meses de tratamiento con aspirina a dosis de 80 mg/día, la frecuencia de recidiva de hemorragia en pacientes de riesgo que habían padecido hemorragia ulcerosa previa fue similar entre aquellos que habían tomado 20 mg/día de omeprazol como tratamiento de mantenimiento (probabilidad de hemorragia de 0.9%) y los que habían recibido sólo terapia de erradicación de la infección por H. pylori durante una semana (probabilidad de hemorragia de 0.9% y 1.9% respectivamente, 95% IC para la diferencia: –1.9 a 3.9%; NS).35 Los datos sugieren que la erradicación puede ser suficiente en el paciente de riesgo que toma aspirina en esas dosis.
Esta conclusión ha sido recientemente puesta en tela de juicio en otro estudio a más largo plazo (12 meses). En ese estudio se pretendía establecer si en los pacientes que consumían aspirina a bajas dosis la erradicación era suficiente para prevenir las complicaciones gastrointestinales o era preciso continuar tratamiento con inhibidores de la bomba de protones tras la erradicación.36 Para ello, se incluyeron 64 pacientes infectados por H. pylori con historia de complicaciones gastrointestinales asociadas al consumo de aspirina a bajas dosis y, tras la erradicación, fueron aleatorizados en 2 grupos, uno con tratamiento de mantenimiento con lansoprazol (30 mg/día) y otro con placebo. En los resultados obtenidos se observa una tendencia a la disminución de las complicaciones en el grupo tratado con lansoprazol respecto del grupo control (0 frente a 13.8%, respectivamente; p < 0.05). No obstante, el análisis detallado de los datos señala que de entre los pacientes que tienen recidiva de hemorragia, la mayoría había tenido una recurrencia de la infeción o había tomado AINE en forma concomitante.
De esta forma, parece que ambos estudios no son contradictorios, pero señalan que en el paciente de alto riesgo la erradicación y la toma de un IBP puede ser la forma más adecuada de prevención.
Conclusiones
La utilización de aspirina se asocia con un incremento significativo de hemorragia gastrointestinal. Dicho riesgo parece ser dependiente de la dosis y, aunque es menor que el observado para AINE clásicos, no parece existir una dosis libre de riesgo. Los factores de riesgo no están totalmente definidos, aunque la historia previa de úlcera o complicaciones y la infección por H. pylori parecen ser los más importantes. Si bien la información al respecto continúa siendo escasa debería ofrecerse profilaxis a aquellos pacientes con uno o más factores de riesgo o a aquellos pacientes que presentando mala salud requieran aspirina. Aunque la terapia profiláctica ideal está todavía por definir, la mejor opción para la profilaxis parece ser los inhibidores de la bomba de protones, especialmente beneficiosa en los pacientes de alto riesgo. La erradicación de la infección por H. pylori podría ser otra alternativa en la profilaxis, aunque son necesarios más estudios que aclaren su papel exacto y en qué población debe aplicarse.
Los autores no manifiestan “conflictos de interés”.
BIBLIOGRAFÍA
-
Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of
randomised trials of antiplatelet therapy for prevention of death, myocardial
infarction, and stroke in high-risk patients. BMJ 2002; 324:71-86.
-
Stafford RS. Aspirin use is low among United States outpatients with coronary
artery disease. Circulation 2000; 101:1097-1101.
-
Weisman SM, Graham DY. Evaluation of the benefits and risks of low-dose
aspirin in the secondary prevention of cardiovascular and cerebrovascular events.
Arch Intern Med 2002; 162:2197-202.
-
Giovannucci E, Rimm EB, Stampfer MJ, Colditz GA, Ascherio A, Willett
WC:Aspirin use and the risk for colorectal cancer and adenoma in male health
professionals. Ann Intern Med 1994; 121:241-246.
-
Langman MJ, Cheng KK, Gilman EA, Lancashire RJ. Effect of anti-inflammatory
drugs on overall risk of common cancer: case-control study in general practice
research database. BMJ 2000; 320:1642-1646.
-
Thun MJ. Aspirin and gastrointestinal cancer Adv Exp Med Biol
1997; 400A:395-402.
-
Beard CM, Waring SC, O'Brien PC, Kurland LT, Kokmen E. Nonsteroidal anti-
inflammatory drug use and Alzheimer's disease: a case-control study in Rochester,
Minnesota, 1980 through 1984. Mayo Clin Proc 1998; 73:951-5.
-
Baron JA, Cole BF, Sandler RS, Haile RW, Ahnen D, Bresalier R, McKeown-
Eyssen G, Summers RW, Rothstein R, Burke CA, Snover DC, Church TR, Allen JI,
Beach M, Beck GJ, Bond JH, Byers T, Greenberg ER, Mandel JS, Marcon N, Mott LA,
Pearson L, Saibil F, van Stolk RU. A randomized trial of aspirin to prevent colorectal
adenomas. N Engl J Med 2003; 348:891-9.
-
Sandler RS, Halabi S, Baron JA, Budinger S, Paskett E, Keresztes R, Petrelli N,
Pipas JM, Karp DD, Loprinzi CL, Steinbach G, Schilsky R. A randomized trial of
aspirin to prevent colorectal adenomas in patients with previous colorectal cancer.
N Engl J Med 2003; 348:883-90.
-
Friis S, Sorensen HT, McLaughlin JK, Johnsen SP, Blot WJ, Olsen JH. A
population-based cohort study of the risk of colorectal and other cancers among
users of low-dose aspirin. Br J Cancer 2003; 88:684-8
-
Boltri JM, Akerson MR, Vogel RL. Aspirin prophylaxis in patients at low risk for
cardiovascular disease: a systematic review of all-cause mortality. J Fam Pract
2002; 51:700-4.
-
Simon B, Elsner H, Muller P. Protective effect of omeprazole against low-dose
acetylsalicylic acid. Endoscopic controlled double-blind study in healthy subjects.
Arzneimittelforschung 1995; 45:701-703.
-
Muller P, Fuchs W, Simon B. Studies on the protective effect of lansoprazole on
human gastric mucosa against low-dose acetylsalicylic acid. An endoscopic
controlled double-blind study. Arzneimittelforschung 1997; 47:758-760.
-
Kordecki H, Kurowski M, Kosik M, Pilecka D. Is Helicobacter pylori
infection a risk or protective factor for mucosal lesions development in patients
chronically treated with acetylsalicylic acid? J Physiol Pharmacol 1997; 48:85-91.
-
Chowdhury A, Ganguly G, Chowdhury D, Santra A, Gupta JD, Roy T. Gastro-
duodenal mucosal changes associated with low-dose aspirin therapy: a prospective,
endoscopic study. Indian J Gastroenterol 2001; 20:227-9.
-
Prichard PJ, Kitchingman GK, Walt RP, Daneshmend TK, Hawkey CJ. Human
gastric mucosal bleeding induced by low dose aspirin, but not warfarin. Br Med J
1989; 298:493-496.
-
Kitchingman GK, Prichard PJ, Daneshmend TK, Walt RP, Hawkey CJ. Enhanced
gastric mucosal bleeding with doses of aspirin used for prophylaxis and its reduction
by ranitidine. Br J Clin Pharmacol 1989; 28:581-585.
-
Goldstein JL, Agrawal NM, Silverstein FE, Verburg KM, Burr AM, Hubbard RC et
al. Influence of H. pylori (HP) infection and/or low dose aspirin (ASA) on
gastroduodenal ulceration in patients treated with placebo, celecoxib or NSAIDs.
Gastroenterology 1999; 116:A174.
-
Cryer B, Feldman M. Effects of very low dose daily, long-term aspirin therapy
on gastric, duodenal, and rectal prostaglandin levels and on mucosal injury in
healthy humans. Gastroenterology 1999; 117:17-25.
-
Slattery J, Warlow CP, Shorrock CJ, Langman MJ. Risks of gastrointestinal
bleeding during secondary prevention of vascular events with aspirin-analysis of
gastrointestinal bleeding during the UK-TIA trial. Gut 1995; 37:509-511.
-
Weil J, Colin-Jones D, Langman MJS, Lawson D, Logan R, Murphy M, Rawlins M,
Vessey M, Wainwright P. Prophylactic aspirin and risk of peptic ulcer bleeding. BMJ
1995; 310:827-830.
-
Serrano P, Lanas A, Arroyo M, Casanovas JA, Ferreira I. Risk stratification of
upper gastrointestinal bleeding in cardiovascular patients on low dose aspirin: a
cohort study. Gastroenterology 2000; 118:A194.
-
Lanas A, Bajador E, Serrano P, Fuentes J, Carreño S, Guardia J, Sainz R.
Nitrovasodilators, low-dose aspirin, nonsteroidal anti-inflammatory drugs, and the
risk of upper gastrointestinal bleeding. N Engl J Med 2000; 343:834-839.
-
García Rodríguez LA, Hernández-Díaz S, de Abajo FJ. Association between
aspirin and upper gastrointestinal complications: systematic review of epidemiologic
studies. Br J Clin Pharmacol 2001; 52:563-71.
-
Serrano P, Lanas A, Arroyo MT, Ferreira IJ. Risk of upper gastrointestinal
bleeding in patients taking low-dose aspirin for the prevention of cardiovascular
diseases. Aliment Pharmacol Ther 2002; 16 (11):1945-53.
-
Lanas A, Fuentes J, Benito R, Serrano P, Bajador E, Sainz R. Helicobacter pylori
increases the risk of upper gastrointestinal bleeding in patients taking low-dose
aspirin. Aliment Pharmacol Ther 2002; 16:779-86.
-
Silverstein FE, Graham DY, Senior JR, Davies HW, Struthers BJ, Bittman RM,
Geis GS. Misoprostol reduces serious gastrointestinal complications in patients with
rheumatoid arthritis receiving nonsteroidal anti-inflammatory drugs. A randomized,
doubleblind, placebo-controlled trial. Ann Intern Med 1995; 123:241- 249.
-
MacDonald TM, Wei L. Effect of ibuprofen on cardioprotective effect of aspirin.
Lancet 2003; 361 (9357):573-4.
-
De Abajo FJ, García Rodríguez LA. Risk of upper gastrointestinal bleeding and
perforation associated with low-dose aspirin as plain and enteric-coated
formulations. BMC Clin Pharmacol 2001; 1:1.
-
Derry S, Loke YK. Risk of gastrointestinal haemorrhage with long term use of
aspirin: meta-analysis. BMJ 2000; 321 (7270):1183-7.
-
Silagy CA, McNeil JJ, Donnan GA, Tonkin AM, Worsam B, Campion K. Adverse
effects of low dose aspirin in healthy elderly population. Clin Pharmacol Ther 1993;
54:84-89.
-
Van Hecken A, Juliano ML, Depre M, De Lepeleire I, Arnout J, Dynder A,
Wildonger L, Petty KJ, Gottesdiener K, De Hoon JN. Effects of enteric-coated, low-
dose aspirin on parameters of platelet function. Aliment Pharmacol Ther 2002;
16:1683-8.
-
Kelly JP, Kaufman DW, Jurgelon JM, Sheehan J, Koff RS, Shapiro S. Risk of
aspirin-associated major upper-gastrointestinal bleeding with enteric-coated or
buffered product. Lancet 1996; 34:1413-1416.
-
Stack WA, Atherton JC, Hawkey GM, Logan RF, Hawkey CJ. Interactions
between Helicobacter pylori and other risk factors for peptic ulcer bleeding. Aliment
Pharmacol Ther 2002; 16:497-506.
-
Chan FKL, Chung SCS, Suen BY, Lee YT, Leung WK, Leung VKS, Wu JC, Lau JY,
Hui Y, Lai MS, Chan HL, Sung JJ. Preventing recurrent upper gastrointestinal
bleeding in patients with Helicobacter pylori infection who are taking low-
dose aspirin or naproxen. N Engl J Med 2001; 344:967-973.
-
Lai KM, Lam SK, Chu KM, Wong BCY, Hui WM, Hu WHC, Lau GKK, Wong WM,
Yuen MF, Chan AOO, Lai CL, Wong J. Lansoprazole for the Prevention of
Recurrences of Ulcer Complications from Long-Term Low-Dose Aspirin Use. N Engl J
Med 2002; 346:2033-2038.
-
Bianchi Porro G, Parente F, Imbesi V, Montrone F, Caruso I. Role of
Helicobacter pylori in ulcer healing and recurrence of gastric and duodenal ulcers in
longterm NSAID users. Response to omeprazole dual therapy. Gut 1996; 39:22-6.
-
Aalykke C, Lauritsen JM, Hallas J, Reinholdt S, Krogfelt K, Lauritsen K.
Helicobacter pylori and risk of ulcer bleeding among users of nonsteroidal anti-
inflammatory drugs: a case-control study. Gastroenterology 1999; 116:1305-9.
-
Santolaria S, Lanas A, Benito R, Perez-Aisa M, Montoro M, Sainz R. Helicobacter
pylori infection is a protective factor for bleeding gastric ulcers but not for bleeding
duodenal ulcers in NSAID users. Aliment Pharmacol Ther 1999; 13:1511-8.
-
Lanas A, on behalf of the EMPHASIS study group. Low frequency of upper
gastrointestinal complications in the high risk patient taking low-dose aspirin and
omeprazole. Gastroenterology 2001; 120:A596.
-
Chan FKL, Wu JCY, Suen BY, et al. Eradication of H. pylori to prevent recurrent
ulcer complications associated with low-dose aspirin: a long-term cohort study. San
Francisco DDW 2002:A696.
-
Yeomans N, Tulassay Z, Juhasz L, Racz I, Howard JM, Van Rensburg CJ
Swannell AJ, Hawkey CJ, for the Acid Suppression Trial: Ranitidine versus
Omeprazole for NSAID-Associated ulcer treatment (ASTRONAUT). A comparison of
omeprazole with ranitidine for ulcers associated with nonsteroidal antiinflammatory
drugs. N Engl J Med 1998; 338:719-726.
-
Hawkey CJ, Karrasch JA, Szczepanski L, Walker DG, Barkun A, Swwannell AJ,
Yeomans ND, for the Omeprazole versus Misoprostol for NSAID-Induced Ulcer
Management (OMNIUM) Study Group. Omeprazole compared with misoprostol for
ulcers associated with nonsteroidal antiinflammatory drugs. N Engl J Med 1998;
338:727-734.
-
Hawkey CJ, Lanas A, on behalf of the Sardinia NSAID meeting participants.
Doubt and certainty about NSAIDs in the year 2000: a multidisciplinary expert
statement. Am J Med 2001; 110:79S- 100S.
-
Donelly MT, Goddard AF, Filipowicz B, Morant SV, Shield MJ, Hawkey CHJ. Low-
dose misoprostol for the prevention of low-dose aspirin-induced gastroduodenal
injury. Aliment Pharmacol Ther 2000; 14 (5):529-34.
-
Iñarrea P, Esteva F, Cornudella R, Lanas A. Omeprazole does not interfere with
the antiplatelet effect of low-dose aspirin in man. Scand J Gastroenterol 2000;
35:242-246.
-
Muller P, Fuchs W, Simon B. Studies on the protective effect of lansoprazole on
human gastric mucosa against low-dose acetylsalicylic acid. An endoscopic
controlled double-blind study. Arzneimittelforschung 1997; 47:758-760.
-
Kitchingman GK, Prichard PJ, Daneshmend TK, Walt RP, Hawkey J. Enhanced
gastric mucosal bleeding with doses of aspirin used for prophylaxis and its reduction
by ranitidine. Br J Clin Pharmacol 1989; 28:581-585.
-
Hawkey CJ, Somerville KW, Marshall S. Prophylaxis of aspirin induced gastric
mucosal bleeding with ranitidine. Aliment Pharmacol Ther 1988; 2:245-252.
-
Napoli C, Ackah E, De Nigris F, Del Soldato P, D'Armiento FP, Crimi E,
Condorelli M, Sessa WC. Chronic treatment with nitric oxide-releasing aspirin
reduces plasma low-density lipoprotein oxidation and oxidative stress, arterial
oxidation-specific epitopes, and atherogenesis in hypercholesterolemic mice. Proc
Natl Acad Sci USA 2002; 99:12467-70.
-
Fiorucci S, Santucci L, Gresele P, Faccino RM, Del Soldato P, Morelli A.
Gastrointestinal safety of NO-aspirin (NCX-4016) in healthy human volunteers: a
proof of concept endoscopic study. Gastroenterology 2003; 124: 600-7.
|


![]()
![]()

