Introducción
A pesar de la trascendental modificación de la evolución natural de la enfermedad por VIH y sida que ha caracterizado los últimos 10 años –relacionada con la incorporación de la terapia antirretroviral de gran actividad (TARGA)–, en el tercer milenio los pacientes con infección por VIH están aún expuestos a múltiples factores de riesgo de alteración pancreática subclínica o clínica, entre los que se encuentran: la administración de fármacos con toxicidad directa o indirecta para el páncreas (a saber, análogos de nucleósidos, pentamidina, cotrimoxazol, inhibidores de la proteasa, inhibidores no nucleósidos de la transcriptasa inversa, compuestos antituberculosos/antimicobacterianos, quimioterapia citotóxica y muchos otros),1-9 el alcoholismo o el consumo de drogas, la hiperlipidemia relacionada con la terapia antirretroviral, las afecciones hepáticas o de las vías biliares concomitantes (incluidas la colangitis esclerosante y las neoplasias regionales),10-12 una amplia variedad de enfermedades oportunistas y la infección misma por VIH, así como el incremento progresivo de la edad promedio de los pacientes y su comorbilidad asociada;13 sin embargo, tanto la frecuencia como el papel de cada uno de estos factores predisponentes se investigaron escasamente hasta la fecha,5,6,14-21 en especial luego de la introducción de la TARGA, debido al rápido descenso de las múltiples enfermedades oportunistas asociadas con el sida. Todos los fármacos con toxicidad directa, la didanosina, la zalcitabina, la stavudina, la hidroxiurea, la pentamidina intravenosa o inhalable, las sulfonamidas y sustancias relacionadas, los fármacos citotóxicos, la isoniacida y otros agentes antituberculosos, la furosemida y las tiacidas, se vinculan estrechamente con aumento del riesgo de inducir alteraciones bioquímicas o clínicas del páncreas en el curso de la enfermedad por VIH; no obstante, los casos de pancreatitis aguda se notificaron predominantemente luego de la administración de pentamidina o didanosina.1-4,7,17-19,22 Sin embargo, la frecuencia y la gravedad de los signos y síntomas relacionados (dolor abdominal con irradiación fundamentalmente dorsal, diarrea, náuseas y vómitos), se informan con poca frecuencia en este contexto5,7,18 y el diagnóstico mediante imágenes (ecografía, tomografía computarizada con refuerzo por contraste [TC]) puede verse dificultado por la coexistencia de otras patologías y el habitual meteorismo, en el caso de la ecografía.23 Por consiguiente, aunque previamente se estimó que la frecuencia global de alteración pancreática era 35 a 800 veces mayor que en la población general,14,16 la pancreatitis aguda, en su expresión típica, se ha mantenido durante años (antes y después de la disponibilidad de la TARGA) como un hallazgo clínico poco habitual en los pacientes infectados por VIH,5,7,18,19 y la enfermedad grave o mortal se notificó en muy pocos casos, especialmente en situaciones de episodios agudos inducidos por fármacos.3,5,7 Como consecuencia, la mayor parte de las lesiones pancreáticas asociadas con el VIH no se detectaron o se subestimaron en vida, y fueron descubiertas solamente luego de fallecido el enfermo, especialmente en la época previa a la TARGA.18,24 En efecto, un estudio extenso basado en necropsias, publicado con anterioridad a la TARGA (1994), que además citó y discutió toda la bibliografía acerca de trabajos basados en los hallazgos de necropsias realizadas desde 1987, reveló el compromiso pancreático en 254 de 749 necropsias (es decir, en el 33.9% de los casos examinados).18 En dicho estudio, la mayoría de los diagnósticos confirmados incluyeron infecciones oportunistas (121 casos; predominantemente debidas a citomegalovirus, Mycobacterium avium-intracellulare, Cryptococcus neoformans, Mycobacterium tuberculosis y Toxoplasma gondii), seguidas de citoesteatonecrosis pancreática (25 sujetos) y diferentes neoplasias primarias o metastásicas vinculadas al VIH (22 casos). Otro estudio de necropsias publicado recientemente,24 el cual informó acerca de pacientes fallecidos en 1995 (también antes de la introducción de la TARGA), mostró muy elevada frecuencia (90%) de afección pancreática, habitualmente asintomática y no detectada en vida, y amplia variedad de alteraciones morfológicas, algunas posiblemente relacionadas con el VIH mismo.24 Un pequeño número de estudios se centró en la pancreatitis aguda sintomática en pacientes con VIH, pero ninguno de ellos evaluó fármacos antirretrovirales diferentes de los análogos de nucleósidos.5,6,19,21,22 En verdad, las alteraciones pancreáticas halladas durante la etapa previa a la TARGA resultaron generalmente de la exposición prolongada a múltiples medicamentos y los trastornos concurrentes vinculados al VIH, los cuales pudieron actuar como factores de riesgo recíprocos pero, a la vez, de confusión. Entre los 321 pacientes que recibieron seguimiento durante 1993-1994, una cantidad de hasta 45 individuos (14%) presentaron pancreatitis aguda sintomática confirmada mediante exámenes de laboratorio o complementarios; se encontró correlación significativa con el recuento disminuido de linfocitos CD4+, la presencia de cálculos en la vía biliar, la adicción a drogas de uso intravenoso, la administración de pentamidina y algunas infecciones oportunistas asociadas al VIH.21 En un estudio publicado recientemente, Moore y col.6 investigaron la función de los análogos de nucleósidos y de la hidroxiurea combinada, y hallaron riesgo significativamente mayor de alteraciones pancreáticas con la asociación didanosina-hidroxiurea (6.25 casos cada 100 000 años-persona: incremento de 4 veces en comparación con la didanosina sola), en tanto que la asociación didanosina-stavudina no aumentó dicho riesgo. Resultó sorprendente que no se consideraran fármacos distintos de los análogos de nucleósidos y la hidroxiurea y que el sexo femenino pareciera más afectado, al tiempo que se confirmó el papel de los recuentos reducidos de linfocitos CD4+.6 En general, en el período previo a la TARGA, la notoria inmunodeficiencia asociada al VIH demostró ser un factor de predicción importante e independiente de la presentación de pancreatitis, su pronóstico y sus resultados, a pesar de que la gama de manifestaciones clínicas observadas era, en general, comparable con aquella encontrada en la población general.5,6,19,21,22 Entre las distintas series de casos examinadas, las cuales no siempre fueron comparables, la frecuencia global del cuadro completo de pancreatitis fue usualmente inferior a la informada por Dutta y col.,21 es decir entre el 1.3%15 y el 5%,19 y la incidencia máxima (14.2%) fue expresada por Dowell y col.22 En este último estudio se señaló con particular firmeza una clara relación con los estadios de la enfermedad por VIH de los Centers for Diseases Control and Prevention (CDC) de los EE.UU., con la enfermedad de la vía biliar, la elevación de los niveles séricos de triglicéridos, la criptosporidiosis y el tratamiento con pentamidina o isoniacida.22
Por otra parte, la incidencia de las alteraciones pancreáticas aisladas de laboratorio mostró gran variabilidad (entre el 7.8% y el 63% de los casos examinados), siempre durante los años que precedieron la introducción de la TARGA, en 1996; sin embargo, tales estudios no fueron comparables en cuanto a la selección de los pacientes, la duración del seguimiento y la rutina de laboratorio.14,15,17,20,25,26 Un trabajo relacionó la hiperamilasemia con el sexo masculino, el consumo de drogas, la enfermedad por VIH avanzada (sida) y el recuento reducido de células CD4+, pero no con el antecedente de enfermedad hepática o de la vía biliar ni con la utilización de análogos de nucleósidos.20 La relación entre la frecuencia de las alteraciones séricas de las enzimas pancreáticas y los estadios avanzados de la enfermedad por VIH fue confirmada por Dutta y col.21
Además, respecto de la población infantil infectada por VIH se observó elevación completamente asintomática de las enzimas pancreáticas en 10 de 47 niños examinados (aunque la isoamilasa y la lipasa pancreáticas mostraron valores anormales en sólo 6 y 7 casos, respectivamente). En dicha población no se demostró correlación con el estadio de la enfermedad, los fármacos administrados, las afecciones subyacentes u otros factores de riesgo presuntos.27 Por otra parte, recientemente se observaron alteraciones de la función endocrina del páncreas en niños infectados por VIH que recibían TARGA, con consecuencias sobre la sensibilidad a la insulina y la velocidad de crecimiento.28,29
En un estudio más actual se detectó elevación asintomática leve a moderada de los niveles séricos de amilasa o lipasa hasta en el 60% de los 86 pacientes examinados, aunque esta frecuencia descendió a sólo el 14% cuando se consideró el incremento de al menos el doble en las enzimas; los autores destacaron su asociación con la hepatitis por virus B o C, la terapia antirretroviral y el uso de cotrimoxazol por vía intravenosa.26 Dado que la sola medición de la amilasemia es mucho menos específica que la determinación sérica de la isoamilasa o la lipasa pancreáticas.25,30 y que se informó macroamilasemia en pacientes con infección por VIH25,30,31 (no detectada en nuestra cohorte), se seleccionó la combinación de hiperamilasemia y elevación de la amilasemia o la lipasemia pancreáticas para evaluar los cambios bioquímicos en nuestra serie de casos, de modo de obtener una mejor estimación de esa manifestación. Ya en la etapa anterior a la TARGA se observaron tanto alteraciones endocrinas (con la consiguiente reducción de la tolerancia a la glucosa y, posiblemente, diabetes mellitus) como disfunción exocrina del páncreas (potencialmente responsable de la malabsorción de nutrientes y, especialmente, de grasas) en adultos y niños.16,18,32,33 En particular, una investigación realizada en Italia en 1992 demostró valores elevados de tripsina y de elastasa-I en el 56.3% y en el 25% de los individuos examinados, respectivamente, en ausencia de signos y síntomas de pancreatitis; también se halló una relación inversa con la gravedad de la inmunodeficiencia asociada a la infección por VIH.16 Todas estas alteraciones son actualmente mucho más difíciles de monitorizar y de atribuir al posible compromiso pancreático debido a que la introducción de la TARGA generó una amplia gama de modificaciones del metabolismo, que incluyen la regulación de la glucosa, la insulina, la resistencia a la insulina, los triglicéridos y el colesterol, y otras múltiples vías metabólicas y endocrinas; pueden citarse el denominado síndrome de lipodistrofia y el de redistribución de la grasa8,9,34,35 y diversos trastornos, como la diabetes mellitus inducida por fármacos, la esteatosis hepática, la acidosis láctica, el sindrome metabólico y la osteopenia, la mayoría vinculados con anomalías mitocondriales firmemente sospechadas de ser inducidas por la administración prolongada de TARGA.12,36 Por ejemplo, se demostró reducción de la actividad lipolítica pancreática en pacientes con hipertrigliceridemia asociada a la TARGA,37 pero una cantidad creciente de estudios tienen como objetivo identificar y discutir acerca de las posibles vías patogénicas de la toxicidad de los agentes antirretrovirales, con atención especial sobre las anomalías mitocondriales12,36 y los factores relacionados con la comorbilidad y la administración simultánea de fármacos.13 Más recientemente, Guo y col. estimaron el riesgo de presentar pancreatitis aguda en pacientes tratados con TARGA:7 para los individuos que recibían tratamiento inicial, la tasa bruta de incidencia fue 1.95 cada 100 000 años-persona, y el índice de riesgo se incrementó con la edad, el estadio de la enfermedad por VIH, la duración del tratamiento antirretroviral, el antecedente de lesión hepática y la enfermedad cardiovascular.7 Es interesante el hecho de que los pacientes de raza blanca tuvieron un riesgo significativamente mayor que los de otras razas.
En el presente estudio prospectivo evaluamos la frecuencia, los factores predisponentes potenciales, la gravedad y las características clínicas, la eficacia del tratamiento específico final y la consecuencia de las alteraciones pancreáticas; el trabajo fue de tipo observacional, de casos y controles, se realizó durante 2005 (entre el 1 de enero y el 31 de diciembre) e incluyó una cohorte de 1 081 pacientes infectados por VIH, quienes recibieron estrecho seguimiento durante al menos 12 meses consecutivos en nuestro centro.
Pacientes y métodos
Luego de excluir de la evaluación a 121 pacientes con infección por VIH cuyo nivel de cumplimiento con los controles o con la medicación prescrita era inferior al 90% (de acuerdo con los controles clínicos mensuales, la prescripción directa y el recuento de los fármacos y la declaración espontánea de los pacientes), los restantes 1 081 individuos recibieron seguimiento durante al menos 12 meses en nuestro centro de referencia para atención de alta complejidad en Bolonia (Italia), durante el transcurso de 2005. Dichos participantes recibieron, al menos trimestralmente, una evaluación completa de laboratorio que incluyó los niveles séricos de amilasa, isoamilasa y lipasa pancreáticas, medidos con un equipo de prueba comercial y un analizador automático (límite superior de los valores normales: 220, 120 y 270 mg/dl, respectivamente). Los casos de macroamilasemia se detectaron mediante electroforesis en acetato de celulosa en los sujetos con elevación aislada y persistente de los niveles de amilasemia total, para excluir esta situación de evaluaciones posteriores. Del total de pacientes incluidos, 898 de ellos (83.1%) recibieron terapia antirretroviral combinada durante 12 meses o más, y fueron evaluados para detectar alteraciones bioquímicas o clínicas pancreáticas en este estudio observacional de casos y controles, que incluyó el período de seguimiento completo de cada paciente individual (mínimo de 12 meses y máximo de 204 meses). El objetivo de este trabajo fue identificar cualquier factor predisponente potencial y definir las características clínicas de la afección pancreática en el contexto de la enfermedad por VIH. La duración de la infección por VIH, el tratamiento antirretroviral en conjunto y los regímenes basados en IP se consideraron en forma integral al momento de la primera alteración de las enzimas pancreáticas en el suero. Además, luego de obtener su consentimiento informado, aquellos pacientes con valores de laboratorio elevados (definidos como el incremento de al menos 3 veces los niveles séricos de isoamilasa o lipasa pancreáticas)38 fueron examinados adicionalmente desde los puntos de vista epidemiológico, clínico, de la metodología complementaria, terapéutico y de los resultados, para intentar definir el perfil de enfermedad pancreática antes y durante la etapa de la TARGA.
El análisis estadístico fue realizado con un programa informático comercial (SPSS, versión 2002) y se utilizaron la prueba t de Student para las variables continuas y las pruebas de chi cuadrado de Mantel-Haenszel o exacta de Fisher para las variables categóricas, con niveles de significación planteados como p < 0.05.
Resultados
En nuestra cohorte completa de 1 081 sujetos evaluables, 435 (40.2%) presentaron al menos una alteración verificable de por lo menos 2 enzimas pancreáticas en el suero (amilasa sérica más isoamilasa o lipasa pancreáticas) durante todo el período de seguimiento (promedio de 33.6 ± 15.8 meses, intervalo de 12 a 204 meses consecutivos). Las características demográficas, epidemiológicas, clínicas, bioquímicas y terapéuticas de esos pacientes se compararon con las de los restantes 646 individuos de nuestra cohorte de un solo centro, los cuales nunca presentaron modificación de las enzimas pancreáticas, lo que resultó en una proporción de aproximadamente 1:1.5 en este estudio prospectivo de casos y controles. Al comparar los 435 pacientes con cambios en los valores de laboratorio citados, con los 646 controles sin modificaciones, las únicas variables que mostraron relación significativa con la presentación de alteraciones pancreáticas ocasionales fueron la duración global de la serología positiva conocida para VIH (p < 0.001), el diagnóstico previo o simultáneo de sida manifiesto (p < 0.001) (pero no la combinación con neoplasias asociadas al VIH, cuando se extrapolaron todas las afecciones que definen el sida; datos no presentados), la inmunodeficiencia más grave (expresada como mayor frecuencia de recuento de linfocitos CD4+ inferior a 200 cél/μl) (p < 0.003), la duración de la TARGA basada en IP (p < 0.0001), la enfermedad crónica vía biliar o hepática concomitante (de etiología alcohólica o, especialmente, viral) (p < 0.0001) y la hipertrigliceridemia subyacente (niveles séricos de triglicéridos superiores a 172 mg/dl) en al menos una ocasión (p < 0.001); por el contrario, no hubo correlación significativa con ninguno de los parámetros demográficos y epidemiológicos considerados (incluidos el sexo, la edad y el tipo de riesgo para adquirir la infección por VIH), el porcentaje de pacientes tratados con antirretrovirales y la duración total de la administración de análogos de nucleósidos (tabla 1). No se detectó ningún caso de macroamilasemia entre los 435 individuos con niveles séricos elevados de amilasa.
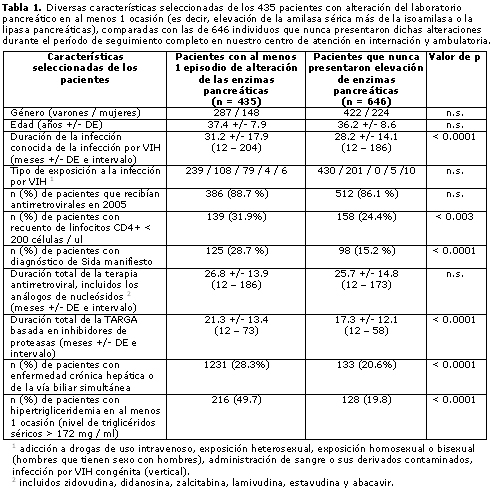
Ciento sesenta y seis de los 435 pacientes mencionados (15.3% de la cohorte completa y 38.2% de los sujetos con al menos 1 episodio de alteración confirmada de la función pancreática por laboratorio) presentaron elevación por lo menos al triple de las enzimas pancreáticas en suero, persistente durante 6 meses o más (situación con incremento del riesgo de presentar pancreatitis aguda);38 esta anomalía se asoció con signos clínicos y ecográficos o por TC, indicativos de compromiso pancreático, en sólo 46 de ellos (4.2% de la cohorte total en comparación con 10.6% de los pacientes con valores de laboratorio persistentemente elevados). Comparados con los restantes 269 sujetos con alteraciones de laboratorio aisladas y de menor magnitud, dichos 166 individuos con cambios bioquímicos importantes y prolongados (asociados o no con signos y síntomas de afección orgánica) mostraron correlación significativa con el uso concomitante durante al menos 6 meses de didanosina, stavudina, lamivudina, pentamidina, cotrimoxazol, tratamiento antituberculoso, quimioterapia citotóxica o la combinación de estos agentes (p < 0.05 a p < 0.0001); también hubo relación con el consumo de drogas o el alcoholismo durante 6 meses como mínimo (p < 0.04), las infecciones oportunistas con posibilidad de afectar el páncreas (infección por citomegalovirus, criptosporidiosis, micobacteriosis o tuberculosis diseminada) (p < 0.03), enfermedad crónica hepática o biliar (p < 0.01), el uso simultáneo de TARGA basada en IP (p < 0.05), la hipertrigliceridemia presente al menos durante 6 meses (p < 0.02) o la combinación de 2 o más de estos factores predisponentes (p < 0.003). En cambio, el tiempo transcurrido desde el conocimiento de la serología positiva y la duración total del tratamiento antirretroviral no mostraron diferencias notables entre ambos grupos de estudio (datos no presentados).
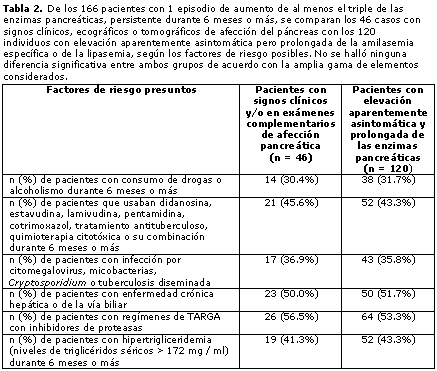
Sin embargo, no se detectó ninguna diferencia en la gama de factores de riesgo entre los 46 pacientes con signos clínicos, ecográficos o tomográficos de alteración pancreática (edema del páncreas, heterogeneidad ecográfica o aumento de tamaño del órgano) y los restantes 120 casos con elevación prolongada de las enzimas pancreáticas –en apariencia, asintomática–, cuando se consideraron las variables mencionadas más arriba (tabla 2).
De los 435 pacientes con infección por VIH con alteración pancreática detectada, 303 de ellos (69.6%) presentaron entre 2 y 22 recidivas de las anomalías de laboratorio durante el período de seguimiento completo en nuestro centro, pero sólo 131 sujetos (30.1%) requirieron la modificación de la terapia antirretroviral o antibacteriana subyacente, incluidos los análogos de nucleósidos, pentamidina, cotrimoxazol, fármacos antituberculosos o antimicobacterianos, o de los regímenes basados en IP (debido a hipertrigliceridemia persistente o progresiva, en este último caso). Todos estos enfermos pudieron continuar con tratamiento antirretroviral adecuado, sin consecuencias de importancia en los exámenes de laboratorio. Además, solamente 31 pacientes en total refirieron síntomas gastrointestinales y dolor abdominal leves a moderados, y 9 presentaron pancreatitis aguda típica, según la evaluación clínica y los métodos complementarios, aunque ningún episodio requirió tratamiento quirúrgico ni presentó evolución complicada o mortal. En particular, todas las personas a quienes fue necesario cambiar el tratamiento farmacológico simultáneo o que sufrieron signos y síntomas de pancreatitis formaron parte del grupo de 166 pacientes con elevación prolongada de los valores de laboratorio (p < 0.001, en comparación con todos los demás sujetos con alteraciones aisladas y de poca magnitud de la función pancreática).
En un grupo de 79 individuos (47.6% de los 166 pacientes con anomalías de laboratorio importantes y prolongadas, con o sin alteraciones clínicas o en los exámenes complementarios), 39 de ellos recibieron tratamiento específico con mesilato de gabexato por vía intravenosa (en dosis de 100 a 400 mg/día), 16 personas utilizaron octreotide subcutáneo (0.3 a 0.9 mg/día) y a los restantes 24 pacientes se les administró una combinación de estos dos fármacos; además, todos recibieron tratamiento de sostén, que incluyó el manejo del equlibrio de líquidos y nutricional, y terapia sintomática y para el dolor, según fuera clínicamente adecuado. Un total de 65 pacientes entre los mencionados 79 individuos (82.3%), lograron mejoría significativa de las enzimas pancreáticas en el suero (definida como el descenso en al menos 50% de los niveles séricos de amilasa, amilasa pancreática y lipasa), junto con la resolución completa de todos los signos y síntomas iniciales y la mejora significativa o la desaparición de los hallazgos patológicos en los exámenes complementarios (cuando estaban presentes), luego de 2.4 ± 0.9 semanas (intervalo de 2 a 4 semanas) de tratamiento farmacológico específico. La administración combinada de mesilato de gabexato y octreotide pareció lograr una tasa de éxito significativamente mayor (21 de 24 enfermos: 87.5%) comparada con aquella de los regímenes de tratamiento único con octreotide o mesilato de gabexato solos (p < 0.05).
Si bien 16 de los 79 pacientes tratados con dichos agentes solos o combinados (20.2%) presentaron aumento de las náuseas (probablemente debido a efectos secundarios farmacológicos más que a las alteraciones pancreáticas subyacentes), nunca fue necesario suspender el tratamiento debido a estos posibles eventos adversos y no se observó aumento de la toxicidad en ninguno de estos últimos casos. Comparados con los pacientes no tratados, aquellos que recibieron mesilato de gabexato, octreotide o ambos mostraron mejor tolerabilidad a la terapia antirretroviral posterior (modificada o no en caso de anomalías pancreáticas) (p < 0.02). Lamentablemente, se encontró una elevada tasa de recaídas incluso entre los casos que recibieron tratamiento específico, ya que 27 de los 79 enfermos (34.2%) presentaron al menos un nuevo episodio de compromiso pancreático según el laboratorio, la clínica o los exámenes complementarios en los siguientes 3 a 14 meses, independientemente de la eficacia de la terapia previa con mesilato de gabexato u octreotide. Sin embargo, se observó una clara tendencia hacia menor tasa de recaída en el grupo de los enfermos tratados en comparación con aquellos que no recibieron esos fármacos (34.2% y 46.9%, respectivamente) (p < 0.001), incluso luego de controlar todos los posibles factores de riesgo simultáneos. No obstante, hubo riesgo de sesgo importante en el grupo de pacientes tratados, quienes presentaron un cuadro de laboratorio y clínico inicial de mayor gravedad, posiblemente vinculado con la exacerbación subsiguiente, en cierto modo esperada, del mismo trastorno.
Discusión
Tanto las alteraciones pancreáticas bioquímicas como las clínicas constituyen problemas persistentes, pero aún subestimados, en el manejo de la enfermedad por VIH. Además, se anticipa el cambio significativo (aumento) de los factores de riesgo de toxicidad pancreática con el tiempo, especialmente luego de que se introdujera la TARGA, la cual modificó notablemente la historia natural y los resultados de la infección por VIH. Dicho tratamiento resulta en la conversión de la enfermedad por VIH en un trastorno predominantemente crónico, tratable, caracterizado por el pronunciado descenso de las complicaciones relacionadas con la inmunodeficiencia y el incremento simultáneo de la toxicidad a largo plazo asociada con los fármacos. En la etapa previa a la introducción de la TARGA se sospechó que las infecciones oportunistas, las neoplasias asociadas con el sida, el uso de análogos de nucleósidos, pentamidina u otros antimoniales, cotrimoxazol, dapsona, compuestos antituberculosos/antimicobacterianos, otros fármacos antiinfecciosos, la quimioterapia antineoplásica y los diuréticos producían lesión pancreática aguda o crónica.1-6,10,12-21,36
Por otra parte, al tiempo que la incorporación de la TARGA produjo una notable declinación de las afecciones vinculadas con el sida y redujo la necesidad de agentes antiinfecciosos y de quimioprofilaxis, persiste e incluso surgió una gran variedad de factores de riesgo para el metabolismo pancreático, tales como el uso prolongado de análogos de nucleósidos como parte de la TARGA, la administración de agentes antirretrovirales pertenecientes a las nuevas clases (es decir, IP e inhibidores no nucleósidos de la transcriptasa inversa), las frecuentes alteraciones del metabolismo de lípidos, glucosa y otros, esteatosis hepática, síndrome de acidosis láctica y la toxicidad por fármacos a largo plazo inducida por la TARGA; durante la última década, estos factores sumaron su papel patogénico a los elementos mencionados más arriba.5,8,9,24,34,36
Además, tal como se presumiera desde la pandemia inicial de infección por el VIH, a partir de los hallazgos histopatológicos y el debate generado,5,18 el virus mismo podría tener efecto tóxico directo para el páncreas. Ello ha sido confirmado por el hallazgo de macrófagos con el receptor específico CCR-5 en el infiltrado celular de la pancreatitis crónica.39
Finalmente, debe considerarse una cantidad de factores no necesariamente vinculados con la infección por VIH pero posiblemente concomitantes: la enfermedad crónica hepática o biliar, el alcoholismo, la dislipidemia familiar, la hipercalcemia y la isquemia regional pueden ser más frecuentes en la población de personas infectadas por dicho virus.5,11,18,20
De acuerdo con nuestro conocimiento, hasta la fecha no se han publicado hallazgos relacionados con la epidemiología, los factores de riesgo y las opciones terapéuticas para las alteraciones pancreáticas asociadas con el VIH, en especial luego de que la TARGA constituyera la atención estándar para esta enfermedad. En nuestra opinión, tanto las anormalidades pancreáticas clínicas como subclínicas (es decir, de laboratorio) merecen reevaluación epidemiológica y clínica cuidadosas en la etapa posterior a la TARGA, para identificar la frecuencia actual de los factores de riesgo conocidos y nuevos, sopesar proporcionalmente su participación y significación clínica (en cuanto a la aparición de pancreatitis aguda o contraindicaciones para el uso de una amplia gama de fármacos potencialmente tóxicos para el páncreas) y poder proporcionar tratamiento y prevención eficaces, en caso de ser necesario y de demostrarse eficacia.
Nuestra experiencia confirma la tasa aparentemente elevada de alteraciones, por lo menos ocasionales, de los niveles de isoamilasa o lipasa pancreáticas, que afectaron al 40.2% de los 1 081 pacientes evaluados en nuestro centro durante un período mínimo de 12 meses, extendido hasta 204 meses, y que abarcó ambos períodos, el previo y el posterior a la TARGA, según fuera pertinente.
En consecuencia, según el diseño del estudio, la alteración aislada de la amilasa sérica resultó excluida de esta serie; además, los casos de macroamilasemia se excluyeron cuidadosamente de nuestra evaluación.
Al comparar esos pacientes con todos los demás sujetos infectados por VIH que actuaron como controles no se demostró asociación alguna con el sexo, la edad promedio, el tipo de exposición al virus, las neoplasias vinculadas al VIH, el tratamiento antirretroviral en conjunto o el tiempo de administración de análogos de nucleósidos; en cambio, la duración conocida de la infección por VIH, el diagnóstico de sida manifiesto, la inmunodeficiencia grave, la enfermedad concomitante hepática o de la vía biliar, el tiempo de administración de IP en los regímenes de TARGA y la hipertrigliceridemia habitualmente relacionada con dichos inhibidores8,9 mostraron relación significativa con la elevación –al menos ocasional– de las enzimas pancreáticas en el suero.
Cuando se evaluaron los pacientes con riesgo elevado de presentar pancreatitis aguda,38,40 166 enfermos (15.4%) mostraron un aumento de las enzimas pancreáticas de 3 o más veces del valor normal, que persistió durante al menos 6 meses, aunque la mayoría de ellos (81.3%) se encontraban prácticamente asintomáticos y sólo se detectaron signos clínicos y en exámenes complementarios en 31 casos.
La administración de didanosina, stavudina, lamivudina, pentamidina, cotrimoxazol, fármacos antimicobacterianos o antituberculosos, o la combinación de ellos durante al menos 6 meses, el alcoholismo o el consumo de drogas crónicos, las infecciones oportunistas con posibilidad de afectar el páncreas, los trastornos hepáticos o biliares crónicos, la TARGA basada en IP, la hipetrigliceridemia prolongada, la quimioterapia citotóxica o varios de estos factores de riesgo concomitantes, fueron significativamente más frecuentes en los 166 pacientes con alteraciones importantes y continuas en el laboratorio (sintomáticas o no), que en los restantes 269 sujetos con elevación ocasional y de poca magnitud de las enzimas pancreáticas. En comparación con los estudios hallados en la literatura acerca del aumento de las enzimas pancreáticas en ausencia de signos y síntomas14-17,20,25,26 no encontramos relación con el sexo masculino ni con la adicción a drogas,20 en tanto que confirmamos el papel notable de la inmunodeficiencia asociada al VIH y el sida.16,20,21 De la literatura surge, además, que los análogos de nucleósidos, el uso de otros fármacos y la enfermedad hepática o biliar subyacente constituían con frecuencia,26 aunque no siempre,20,27 factores predisponentes. Al igual que en el estudio de Carroccio y col.,27 entre nuestros 15 pacientes pediátricos sólo se observaron 5 casos de aumento ocasional y asintomático de la isoamilasa y la lipasa séricas.
Sin embargo, en nuestra serie de casos ni la duración de la serología positiva ni la de la terapia antirretroviral parecieron desempeñar algún papel en la inducción de trastornos pancreáticos importantes y prolongados. Es sorprendente que la distribución de los mismos factores de riesgo presuntos no difirió significativamente entre los 31 pacientes con afección pancreática según sus signos clínicos y los exámenes complementarios y los 135 que presentaron alteración asintomática notable y prolongada de las enzimas. A pesar de que la recurrencia de las anomalías enzimáticas del páncreas afectó aproximadamente al 70% de los pacientes en el transcurso del prolongado período de seguimiento de nuestro estudio, sólo se consideró necesario cambiar la terapia antirretroviral o antibacteriana potencialmente tóxicas en cerca del 30% de los casos con elevación importante y prolongada de los valores de laboratorio; incluso, la persistencia o reaparición de las alteraciones pancreáticas no obstaculizaron la administración de terapia antirretroviral efectiva (modificada o no). La enfermedad claramente sintomática y la pancreatitis aguda típica aparecieron como eventos infrecuentes (en 31 y en 9 pacientes, respectivamente), pero sin influir sobre la evolución de la enfermedad por VIH, es decir, sobre las secuelas o la mortalidad. Tan escaso número de casos no permitió la comparación con estudios previos centrados en la pancreatitis aguda.5,6,7,19,21,22 Sin embargo, la menor incidencia de inmunodeficiencia y de afecciones oportunistas asociadas al sida pudieron haber desempeñado un papel en la etapa de la TARGA considerada en nuestro estudio, al tiempo que se anticipa que la administración continuada de análogos de nucleósidos (excepto la hidroxiurea, en nuestra serie de pacientes),6 el alcoholismo o el consumo de drogas, la enfermedad hepática o de la vía biliar y la incipiente influencia de la dislipidemia (notificada ya por Dowell y col.)22 constituirán factores de riesgo fundamentales en los próximos años, sobre la base de la administración continuada de los regímenes de TARGA frecuentemente basados en IP y la evidencia creciente de toxicidad mitocondrial inducida por la TARGA.8,9,12,36
Dado que los pacientes con infección por VIH presentan elevación sérica asintomática (más que sintomática) de las enzimas pancreáticas, la cual puede persistir o reaparecer durante mucho tiempo,5,18,25,26 con frecuencia independientemente de la evolución de la terapia antirretroviral (desde el período de análogos de nucleósidos hasta la TARGA), la significación clínica y las consecuencias prácticas de dichas alteraciones durante la pandemia de infección por VIH, así como los efectos sobre la salud de los enfermos, la terapia antirretroviral y otros tratamientos simultáneos, son aún en gran medida desconocidos, a pesar de que la trascendencia clínica de este hecho es muy intrigante incluso desde el punto de vista práctico. Los problemas se relacionan principalmente con el riesgo de que los pacientes con alteración notable y prolongada de los valores de laboratorio y uno o más factores de riesgo simultáneos presenten enfermedad sintomática grave o aguda,40 así como con la selección de los enfermos que podrían beneficiarse con algún tratamiento farmacológico específico (p. ej.: mesilato de gabexato o análogos de la somatostatina).
Un tema final de debate es la estrategia de manejo a largo plazo de la enfermedad pancreática asintomática, oligosintomática o incluso levemente sintomática. Si bien se carece, lamentablemente, de recomendaciones específicas o de pautas elaboradas por expertos para tratar los pacientes con infección por VIH, debería intentarse sustituir los fármacos con mayor toxicidad pancreática (si alguno lo fuera) toda vez que sea posible, y debería implementarse la monitorización meticulosa mediante laboratorio y exámenes complementarios, a pesar de que hasta la fecha no hay estrategias definidas para la simple observación o monitorización a largo plazo, el tratamiento de sostén, los cambios de la terapia de base o los criterios para administrar algún tratamiento específico.
Aunque se demostró que tanto los compuestos antisecretorios (como la somatostatina y sus derivados, p. ej.: octreotide) como los fármacos antiproteasa (como el mesilato de gabexato, en dosis de 900 mg/d para la pancreatitis aguda grave)41 son eficaces para reducir la mortalidad y las complicaciones, respectivamente, de la pancreatitis aguda en la población general, y que su administración constituye actualmente el estándar de atención para los pacientes con enfermedad de presentación aguda y grave,41,42 sólo se dispone de información muy limitada y anecdótica respecto de su posible eficacia y seguridad en situaciones clínicas particulares,40,43 como la enfermedad aguda y, especialmente, la elevación prolongada importante de las enzimas pancreáticas en los pacientes con infección por VIH.
En particular, si bien el octreotide demostró utilidad para la pancreatitis asociada al VIH42 y para algunas otras afecciones relacionadas, como la diarrea refractaria,44,45 el mismo fármaco pareció también estar implicado en la aparición de pancreatitis aguda en sujetos con sida.46 De acuerdo con nuestra propia experiencia terapéutica, se administró tratamiento con dosis bajas de gabexato, octreotide o ambos cuando la elevación notable y prolongada de las enzimas o la enfermedad pancreática sintomática fueron preocupantes, a pesar de la falta de información bibliográfica acerca de su eficacia y seguridad en pacientes con infección por VIH tratados simultáneamente con antirretrovirales. De este modo, el 82.3% de los 79 enfermos tratados integralmente lograron respuesta satisfactoria y sostenida de acuerdo con los análisis de laboratorio, la clínica y los exámenes complementarios, luego de 2 a 4 semanas, sin presentar eventos adversos relevantes; la combinación de gabexato y octreotide mostró actividad significativamente superior que la administración de dichos agentes individuales. Además, a pesar de la situación clínica y de laboratorio inicial más graves, se observó la tendencia a menor tasa de recurrencia entre los pacientes tratados en comparación con los que no recibieron tratamiento, y también mejor tolerabilidad al régimen antirretroviral continuado o modificado, lo que tiene importantes consecuencias para el manejo diario de los pacientes infectados por VIH en la práctica clínica.
En conclusión, existe la importante necesidad de estudios epidemiológicos y patogénicos extensos que evalúen la frecuencia y la significación clínica de las alteraciones de laboratorio o clínicas del páncreas, en especial desde la introducción de la TARGA, ya que la puede agregar múltiples factores de riesgo de esta complicación, ya de por sí escasamente investigada. La posibilidad de que estas alteraciones progresen hacia una enfermedad grave y potencialmente mortal, así como sus consecuencias sobre la continuidad de la administración de terapia antirretroviral o antibacteriana debe considerarse cuidadosamente en vista del cambio significativo en la historia natural de la enfermedad por VIH. La indicación de mesilato de gabexato o análogos de somatostatina en las distintas situaciones clínicas y de laboratorio, y la recomendación del uso simultáneo de una cantidad de agentes potencialmente tóxicos para el páncreas (incluida la TARGA misma) en personas con elevación notable o persistente de las enzimas pancreáticas, a pesar de encontrarse asintomáticas u oligosintomáticas, constituyen verdaderos desafíos que justifican investigación adicional mediante estudios observacionales amplios y ensayos clínicos terapéuticos especialmente diseñados.
BIBLIOGRAFÍA
1. Valentine C, Deenmamode J, Sherwood R. Didanosine and amylase monitoring. Lancet 1992; 339:999.
2. Foisy MM, Slayter KL, Hewitt RG, Morse GD. Pancreatitis during intravenous pentamidine therapy in an AIDS patient with prior exposure to didanosine. Ann Pharmacother 1994; 28:1025-1028.
3. Murphy RL, Noskin GA, Ehrenpreis ED. Acute pancreatitis associated with pentamidine with aerosol. Am J Med 1990; 88:53-55.
4. Lankisch PG, Dröge M, Gottesleben F. Drug induced acute pancreatitis: incidence and severity. Gut 1995; 37:565-567.
5. Dassopoulos T, Ehrenpreis ED. Acute pancreatitis in human immunodeficiency virus-infected patients: a review. Am J Med 1999; 107:78-84.
6. Moore RD, Keruly JC, Chaisson RE. Incidence of pancreatitis in HIV-infected patients receiving nucleoside reverse transcriptase inhibitor drugs. AIDS 2001; 15:617-620.
7. Guo JJ, Jang R, Louder A, Cluxton RJ. Acute pancreatitis associated with different combination therapies in patients infected with human immunodeficiency virus. Pharmacotherapy 2005; 25:1044-1054.
8. Haugaard SB, Andersen O, Dela F, et al. Defective glucose and lipid metabolism in human immunodeficiency virus-infected patients with lipodystrophy involve liver, muscle tissue and pancreatic beta-cells. Eur J Endocrinol 2005; 152:103-112.
9. Calza L, Manfredi R, Farneti B, Chiodo F. Incidence of hyperlipidaemia in a cohort of 212 HIV-infected patients receiving a protease inhibitor-based antiretroviral therapy. Int J Antimicrob Agents 2003; 22:54-59.
10. Menges M, Pees HW. Kaposi's sarcoma of the pancreas mimicking pancreatic cancer in an HIV-infected patient. Clinical diagnosis by detection of HHV 8 in bile and complete remission following antiviral and cytostatic therapy with paclitaxel. Int J Pancreatol 1999; 26:193-199.
11. Barthet M, Chauveau E, Bonnet E, et al. Pancreatic ductal changes in HIV-infected patients. Gastrointest Endosc 1997; 45:59-63.
12. Laguno M, Milinkovic A, De Lazzari E, et al. Incidence and risk factors for mitochondrial toxicity in treated HIV/HCV-coinfected patients. Antivir Ther 2005; 10:423-429.
13. Manfredi R. HIV infection and advanced age: emerging epidemiological, clinical, and management issues. Ageing Res Rev 2004; 3:31-54.
14. Zazzo JF, Pichon F, Regnier B. HIV and the pancreas. Lancet 1987; ii:1212-1213.
15. Lambertus MW, Anderson RE. Hyperamilasemia in patients with human immunodeficiency virus infection. N Engl J Med 1990; 323:1708-1709.
16. Pezzilli R, Gullo L, Ricchi E, et al. Serum pancreatic enzymes in HIV-seropositive patients. Dig Dis Sci 1992; 37:286-288.
17. Maxson CJ, Greenfield SM, Turner JL. Acute pancreatitis as a common complication of 2',3'-dideoxyinosine therapy in the acquired immunodeficiency syndrome. Am J Gastroenterol 1992; 87:708-713.
18. Brivet FG, Naveau SH, Lemaigre GF, Dormont J. Pancreatic lesions in HIV-infected patients. Ball Clin Endrocrinol Metab 1994; 8:859-877.
19. Cappell MS, Marks M. Acute pancreatitis in HIV-seropositive patients: a case-control study of 44 patients. Am J Med 1995; 98:243-248.
20. Boix V, Portilla J, Merino E, Pérez-Mateo M. Origin of hyperamilasemia in HIV-infected patients. AIDS 1996; 10:553-555.
21. Dutta SK, Ting CD, Lai LL. Study of prevalence, severity, and etiological factors associated with acute pancreatitis in patients infected with human immunodeficiency virus. Am J Gastroenterol 1997; 92:2044-2048.
22. Dowell SF, Holt EA, Murphy FK. Pancreatitis associated with human immunodeficiency virus infection: a matched case-control study. Tex Med 1996; 92:44-49.
23. Miller FH, Gore RM, Nemcek AA Jr, Fitzgerald SW. Pancreaticobiliary manifestations of AIDS. Am J Roentgenol 1996; 166:1269-1274.
24. Chehter EZ, Longo MA, Laudanna AA, Duarte ML. Involvemement of the pancreas in AIDS: a prospective study of 109 post-mortems. AIDS 2000; 14:1879-1886.
25. Foo Y, Konecny P. Hyperamylasemia in asymptomatic HIV patients. Ann Clin Biochem 1997; 34:259-262.
26. Argiris A, Mathur-Wagh U, Wilets I, Mildvan D. Abnormalities of serum amylase and lipase in HIV-positive patients. Am J Gastroenterol 1999; 94:1248-1252.
27. Carroccio A, Fontana M, Spagnolo MI, et al. Serum pancreatic enzymes in human immunodeficiency virus-infected children. Scand J Gastroenterol 1998; 33:998-1001.
28. Rondanelli M, Caselli D, Trotti R, et al. Endocrine pancreatic dysfunction in HIV-infected children: association with growth alterations. J Infect Dis 2004; 190:908-912.
29. Bitnun A, Sochett E, Dick PT, et al. Insulin sensitivity and beta-cell function in protease inhibitor-treated and -naive human immunodeficiency virus-infected children. J Clin Endocrinol Metab 2005; 90:168-174.
30. Hancock MR, Smith NA, Hawkins DA, Gazzard B, Ball SG. Biochemical assessment of pancreatic disease in human immunodeficiency virus infected men. J Clin Pathol 1997; 50:674-676.
31. Eleccion CB, Hathaway AA. Macroamylasemia in HIV infection. Tex Med 1998; 94:77-79.
32. Carroccio A, Di Prima L, Di Grigoli C, et al. Exocrine pancreatic function and fat malabsorption in human immunodeficiency virus-infected patients. Scand J Gastroenterol 1999; 34:729-734.
33. Sentongo TA, Rutstein RM, Stettler N, Stallings VA, Rudy B, Mulberg AE. Association between steatorrhea, growth, and immunologic status in children with perinatally acquired HIV infection. Arch Pediatr Adolescent Med 2001; 155:149-153.
34. Manfredi R, Chiodo F. Disorders of lipid metabolism in patients with HIV disease treated with antiretroviral agents: frequency, relationship with administered drugs, and role of hypolipidaemic therapy with bezafibrate. J Infect 2001; 42:181-188.
35. Yarasheski KE, Tebas P, Sigmund C, et al. Insulin resistance in HIV protease inhibitor-associated diabetes. J Acquir Immune Defic Syndr 1999; 21:209-216.
36. Verucchi G, Calza L, Biagetti C, Attard L, Costigliola P, Manfredi R. Ultrastructural liver mitochondrial abnormalities in HIV/HCV-coinfected patients receiving antiretroviral therapy. J Acquir Immune Defic Syndr 2004; 35:326-328.
37. Baril L, Beucler I, Valantin MA, et al. Low lipolytic enzyme activity in patients with severe hypertriglyceridemia on highly active antiretroviral therapy. AIDS 2001; 16:415-417.
38. Banks PA. Practice guidelines in acute pancreatitis. Am J Gastroenterol 1997; 92:377-386.
39. Goecke H, Forssmann U, Uguccioni M, et al. Macrophages infiltrating the tissue in chronic pancreatitis express the chemokine receptor CCR 5. Surgery 2000; 128:806-814.
40. Kysia RF, Brown DF, Nadel ES. Abdominal pain in a patient with HIV. J Emerg Med 2004; 27:285-289.
41. Pezzilli R, Miglioli M. Multicentre comparative study of two schedules of gabexate mesilate in the treatment of acute pancreatitis. Dig Liver Dis 2001; 33:49-57.
42. Andriulli A, Leandro G, Clemente R, et al. Meta-analysis of somatostatin, octreotide and gabexate mesilate in the therapy of acute pancreatitis. Alimen Pharmacol Ther 1998; 12:237-245.
43. Bradley EL. Gabexate mesilate in acute pancreatitis: miracle or mirage? Dig Liver Dis 2001; 33:12-13.
44. Manfredi R, Vezzadini P, Costigliola P, Ricchi E, Fanti MP, Chiodo F. Elevated plasma levels of vasoactive intestinal peptide in AIDS patients with refractory idiopathic diarrhoea. Effects of treatment with octreotide. AIDS 1993; 7:223-226.
45. Manfredi R, Vezzadini P, Fanti MP, Chiodo F. Vasoactive intestinal polipeptide (VIP) secretion and refractory diarrea in patients with AIDS or AIDS-related complex (ARC). Scand J Infect Dis 1994; 26:55-57.
46. Vidal J, Sacanella E, Muñoz E, Miro JM, Navarro S. Acute pancreatitis related to octreotide in a patient with acquired immunodeficiency syndrome. Pancreas 1994; 9:395-397.
|


![]()
![]()

