Introducción
Actualmente existe consenso acerca de que Helicobacter pylori, bacteria gramnegativa que infecta el estómago humano, es el agente causal de la gastritis crónica activa y uno de los tantos factores contribuyentes a la aparición de úlcera péptica, adenocarcinoma gástrico y el linfoma tipo MALT de grado leve.1,2
Es una infección muy difundida en el mundo, cuya prevalencia se estima en 30% en los países desarrollados y en 90% en las naciones en vías de desarrollo.
Desde su descripción por Marshall y Warren en 1984, hasta la fecha, en los países industrializados se registra una disminución de la presencia de esta bacteria en pacientes con úlcera duodenal, úlcera gástrica y gastritis crónica activa; se observa además, paralelamente, que la frecuencia de úlcera gástrica, úlcera duodenal y adenocarcinoma gástrico, está igualmente en disminución.3,4 En el Perú, en el curso de los últimos 20 años, hemos observado igual variación.5
En el Grupo de Fisiología Gastrointestinal de la Universidad Peruana Cayetano Heredia y de la Universidad de Johns Hopkins, desde poco tiempo después de la descripción de Marshall y Warren hemos venido estudiando diversos aspectos de la infección del estómago por esta bacteria.6-11
Dentro de nuestro campo de estudio y observaciones están los aspectos epidemiológicos de la infección estomacal por Helicobacter pylori en el Perú, que creemos pertinente presentar en el presente artículo.
Métodos
Pacientes
Todos nuestros estudios se realizaron en pacientes con síntomas crónicos del tracto gastrointestinal superior que acudían a consulta y para quienes se programaba una endoscopia esofagogastroduodenal.
Endoscopia
Se realizó en ayunas y luego de administrar anestesia orofaríngea con xylocaína al 10%. Después de cada endoscopia el instrumento era enjuagado y lavado con solución de glutaraldehído y con agua estéril para evitar la contaminación del paciente o de las biopsias.
Prueba de la ureasa
Los especímenes fueron incubados a temperatura ambiente en un medio urea-R-Broth, a una concentración de 20 g/l de urea en PBS (pH = 7.1) y 1% de rojo fenol. Se consideró un resultado positivo cuando había un cambio rápido (menos de 1 minuto) del anaranjado al rosado.12
Cultivo
Las biopsias gástricas se colocaban en placas de agar sangre-Skirrow. Se procedía luego a la siembra del material, y posteriormente se colocaba en una campana de anaerobiosis para su transporte. Una vez en el laboratorio se siguió el procedimiento de gaseado, lectura a la hora, 6 horas y 24 horas luego de la incubación, procediéndose a las pruebas de coloración con tinción de Gram, campo oscuro y las pruebas bioquímicas de ureasa, catalasa, citocromo oxidasa y antibiograma.13
Serología
Las muestras de sangre se obtuvieron por venopunción en pacientes adultos y por punción de la yema del dedo en niños. Se utilizó un antígeno crudo preparado de una fuente de nueve cepas de Helicobacter pylori para el método ELISA. La prueba de ELISA fue estandarizada usando titulaciones del antígeno versus diluciones de suero de pacientes confirmados de ser positivos para Helicobacter pylori o negativos, por biopsias múltiples e historia clínica. El procedimiento final involucró una capa de antígeno preparada usando 2.5 μg/l de antígeno en buffer carbonato (pH 9.6) y diluciones de suero de 1:200 a 1:500. La prueba se llevó a cabo en platos de Inmulon usando peroxidasa de conejo anti-IgG humana marcada para completar el “sándwich” y ortofenilendiamina (Sigma Cp.) en buffer de citrato (2.95 de citrato de sodio 0.1 M y 2.05 M de ácido cítrico 0.01 M) como sustrato para la reacción colorimétrica. Una reacción seropositiva era definida en un suero dado con una OD mayor de 2 desviaciones estándar sobre una media de OD para control negativo del suero incluyendo el plato.
Prueba del aliento con 13C-urea
Se colectó una muestra de aliento basal, luego de lo cual se administraron 125 mg de 13C-urea (99% 13C Isotec Corporation, Miamisburg, EE.UU.) disueltos en un frasco con 120 ml de agua. En niños pequeños se administró el sustrato en 40 ml de agua. El sustrato fue ingerido en 3 a 5 minutos. Para colectar las muestras de aliento se usó un equipo pediátrico de reanimación con válvula de una a dos entradas unidas a una bolsa colectora. Las muestras fueron obtenidas colocando la máscara sobre la boca y nariz del niño. La respiración normal llenaba la bolsa. Se colectaron muestras a los 20, 30, 40 y 50 minutos. Luego las muestras fueron transferidas de la bolsa a un tubo evacuatorio para enviarlas a Houston. El 13C del CO2 respirado fue medido por espectrometría automática de masa de rango gas isótopo y comparado con el estándar de referencia. El enriquecimiento por encima del basal fue expresado con partes por mil, y una prueba de aliento con más de 6 partes por mil de enriquecimiento sobre un basal en el período de 50 minutos fue considerada positiva para Helicobacter pylori.
Pruebas histológicas
Las biopsias para estudios histológicos se fijaron en formol neutro. Luego de su inclusión en parafina se efectuaron cortes de 3 a 4 micras de espesor, se colorearon con hematoxilina-eosina en todos los casos y con coloración con plata, PAS y Waysson en ciertos grupos. La lectura histológica se hizo de manera ciega considerando: presencia de Helicobacter pylori en el epitelio y en el mucus o mucina, daño mucinoso o alteración de la vacuola mucinosa del epitelio de cubierta, pérdida de las glándulas propias o atrofia, displasia y metaplasia intestinal.
Prueba de PCR
Los fragmentos de ADN de H. pylori fueron amplificados mediante el uso de primers dirigidos al gen de la ureasa, en un volumen de reacción de 25 μl que contenía 2 mM de MgCl2, 0.25 mM de dNTPs, 0.4 μM de cada primer, 1X de buffer, 0.02 U/μl Taq polimerasa, y 5 μl del ADN extraído. Los siguientes oligonucleótidos, los cuales fueron usados como cebadores o primers, fueron derivados de la secuencia del gen de la ureasa (ureB) reportados por Jeong y col.: ureaseB-F (5’CGTCCGGCAATAGCTGCCATAGT) y ureaseB-R (GTAGGTCCTGCTACTGAAGCCTTA). Las temperaturas que se usaron fueron las siguientes: 1 min a 94°C, 1 min a 67 °C y 1 min a 72 °C. Se realizaron 35 ciclos de amplificación, luego una corrida electroforética en agarosa al 2% con bromuro de etidio en la muestra. Se observó bajo iluminación ultravioleta que puso de manifiesto la presencia de un fragmento de banda amplificado de un tamaño de 467 pares de bases.
Determinación del nivel socioeconómico
Para establecer el nivel socioeconómico de los pacientes se usó una ficha-cuestionario que contenía la siguiente información: lugar y zona de residencia en la ciudad, nivel educativo, ocupación, tipo y características de la vivienda, número de personas que la habitan, material de construcción de la vivienda, características del abastecimiento de agua y servicios de desagüe, número de comidas al día, nivel de ingresos, cobertura de las necesidades de alimentación, vestido, educación, atención de salud y capacidad de agua.
En cada uno de los grupos estudiados, especificamos los métodos que hemos empleado.
Resultados
Prevalencia de la infección por Helicobacter pylori
Hasta fines de la década del ’80 estudiamos 672 pacientes, 325 de nivel socioeconómico bajo y 347 de nivel socioeconómico alto. En todos se realizó endoscopia esofagogastroduodenal y biopsias que fueron coloreadas por el método de hematoxilina-eosina (nivel socioeconómico alto) y hematoxilina-eosina y coloración con plata por el método de Warthin Starryen en el estrato socioeconómico bajo. No encontramos diferencias en las prevalencias según el estrato social al que perteneció el paciente y en ambos grupos la prevalencia de la infección por Helicobacter pylori fue similar a la informada en los países industrializados: gastritis crónica activa 91.8%; úlcera gástrica activa 70.9% y úlcera duodenal activa 86%.14
En una evaluación de 1 815 endoscopias realizadas entre 1985 y 2002 en pacientes de estrato socioeconómico medio y alto, utilizando la coloración de las biopsias con hematoxilina-eosina, observamos que al comparar con los resultados arriba mencionados, se ha producido una significativa disminución de la prevalencia de la infección del estómago por Helicobacter pylori en pacientes con diagnóstico de gastritis crónica activa, úlcera gástrica y úlcera duodenal.15
Estudio de los factores de riesgo para la infección por Helicobacter pylori
Edad: Con el objetivo de determinar la persistencia longitudinal de la infección por Helicobacter pylori en niños peruanos, evaluamos 105 niños, a partir de los 6 meses de edad, a intervalos de 6 meses con la prueba de aliento con 13C-urea, logramos estudiar satisfactoriamente a 56 niños hasta los 30 meses de edad. Demostramos que los niños peruanos se infectan por Helicobacter pylori a temprana edad vida y que el número de infectados se incrementa con la edad.16
Luego determinamos una prevalencia de infección por Helicobacter pylori de 48% con la prueba del aliento con 13C-urea en 407 niños con edades comprendidas entre 2 meses y 12 años, de familias de nivel socioeconómico alto y bajo.17
Por otro lado, en la serie de pacientes estudiados durante el período de 1985 a 2002, en el estrato socioeconómico medio y alto encontramos, utilizando la coloración hematoxilina-eosina en biopsias gástricas, que la prevalencia de la infección por H. pylori se incrementa conforme aumenta la edad en los grupos de pacientes con gastritis crónica activa, úlcera gástrica y mucosa gástrica normal, hasta llegar a un pico de prevalencia entre los 41 y 50 años, para luego disminuir paulatinamente conforme la edad supera los 50 años.
Raza-etnia: Con el fin de observar si en nuestro medio había una predisposición genética para contraer la infección, diseñamos un estudio para comparar la prevalencia de la infección por H. pylori entre la población de origen japonés residente en el Perú y la población peruana con síntomas del tracto digestivo superior, excluyendo pacientes con diagnóstico de úlcera péptica y adenocarcinoma.18 La población japonesa residente en el Perú estuvo compuesta por: inmigrantes japoneses con más de 10 años de residencia en el Perú, niseis peruanos (hijos de madre y padre japoneses) y japoneses con menos de un año de residencia en el Perú; la población peruana estaba conformada por peruanos nativos. Se realizó endoscopia, cultivo, estudio bacteriológico, histológico (coloración con hematoxicilina-eosina, PAS y plata) y serología.
La frecuencia de la infección por Helicobacter pylori fue elevada en los cuatro grupos estudiados (tabla 1), 69% en niseis, 59% en inmigrantes no recientes, 78% en inmigrantes recientes y 77% en peruanos nativos. Nuestros resultados no mostraron diferencias estadísticas significativas en la prevalencia de la infección por Helicobacter pylori asociada a gastritis entre los grupos analizados.

A la fecha, hemos realizado otro estudio que incluyó un mayor número de casos: 168 pacientes japoneses (cuyos ascendentes eran japoneses, por lo menos las tres últimas generaciones, por línea materna y paterna) y 161 pacientes peruanos, ambos grupos del mismo estrato socioeconómico.19
La prevalencia observada en los pacientes japoneses utilizando la prueba de la ureasa fue de 47%, y en los peruanos, de 48%; en tanto que al emplear la prueba de PCR fue de 50% en peruanos y 43% en japoneses (tabla 2), sin tampoco encontrar diferencias significativas.

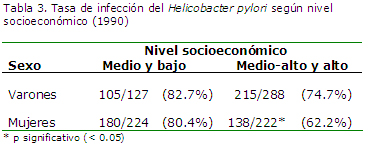
Nivel socioeconómico: En el estudio realizado en 1990,20 que incluyó la evaluación endoscópica de 861 pacientes de diferentes edades con síntomas del tracto gastrointestinal superior, establecimos a través de la coloración hematoxilina-eosina y la de plata en biopsias gástricas, que la tasa de infección por Helicobacter pylori era igual en los diversos niveles socioeconómicos de Lima, con excepción de las mujeres de nivel socioeconómico alto, en las que la prevalencia era menor, con significación estadística.
Recientemente, como ya hemos mencionado, en 1 815 endoscopias realizadas en pacientes con síntomas del tracto gastrointestinal superior de niveles socioeconómicos medio y alto de Lima, entre 1985 y 2002, demostramos una disminución significativa de la prevalencia de infección por H. pylori en este estrato social15 (tabla 3).
Ecología de la infección por H. pylori
Con la finalidad de determinar la ecología de la infección por H. pylori estudiamos a 356 pacientes de la costa (principalmente de Lima), 64 pacientes de la sierra (La Oroya, a 3 600 metros sobre el nivel del mar [msnm]) y 96 pacientes de la ciudad de Pucallpa, localizada en la selva peruana; estos grupos eran de nivel socioeconómico bajo. Además del examen endoscópico, a todos los pacientes se les realizaron estudios bacteriológicos, tinción de Gram del cepillado y estudios histológicos con hematoxilina-eosina.16
La frecuencia de infección por H. pylori fue de 80%, 85% y 70% en mujeres de la selva, la sierra y la costa, respectivamente, y de 90%, 93% y 78% en hombres de la selva, la sierra y la costa, respectivamente.
Estudio de la infección por H. pylori en la altura
Recientemente, con el objetivo de comparar la patología gástrica asociada a la infección por H. pylori en pacientes residentes en la altura con la de pacientes a residentes nivel del mar, diseñamos un estudio que incluyó la evaluación endoscópica y estudios histológicos con hematoxilina-eosina, PAS y coloración de plata de 38 pacientes del Hospital de La Oroya (3 600 msnm) y 40 controles de Lima (a nivel del mar) con infección por H. pylori. Un mayor compromiso de la mucosa gástrica fue más común en los pacientes residentes en la altura al compararlos con los residentes al nivel del mar.21
Transmisión de la infección
En un estudio realizado en Lima se recolectaron 48 muestras de agua bebible de diferentes localidades en pueblos jóvenes cerca de Lima: 30 muestras del sistema de agua municipal en el Valle Sharon, 14 de la comunidad de Pampas de San Juan y 4 de casas a las cuales se administraba el agua de camiones cisterna. Mediante la técnica del PCR se halló material genético de H. pylori en 24 muestras, 20 de ellas procedían de la planta tratamiento de agua de la Atarjea. Además, en ese mismo estudio se demostró un aumento del riesgo de infección por Helicobacter pylori en aquellos que bebían agua de la red municipal (Atarjea), en comparación con los que bebían el agua de pozos particulares. Esta asociación fue independiente del nivel socioeconómico y de la presencia de una instalación de agua adecuada en el interior del hogar.22
Prevalencia de enfermedades gastrointestinales asociadas a la infección
Al evaluar 31 446 endoscopias digestivas altas realizadas entre 1985 y 2002 en personas de nivel socioeconómico medio y alto de Lima, encontramos una reducción significativa y sostenida de la prevalencia de úlcera gástrica, úlcera duodenal y adenocarcinoma gástrico (figura 1).

Discusión
Al comparar nuestras observaciones en el curso de 23 años sobre la infección del estómago por Helicobacter pylori en el Perú, encontramos variaciones que ameritan la presente comunicación.
Inicialmente informamos igual prevalencia de la infección por esta bacteria en pacientes con síntomas crónicos del tracto gastrointestinal superior, tanto de nivel socioeconómico alto como bajo, en la ciudad de Lima,23 así como en las tres regiones del país, en pacientes de nivel socioeconómico bajo.24
A la fecha, no hemos realizado un nuevo estudio de la prevalencia de esta infección en las tres regiones del país (costa, sierra y selva), pero sí a nivel de la zona metropolitana de Lima, y es interesante señalar que en pacientes de nivel socioeconómico bajo, la prevalencia de la infección se mantiene elevada, en tanto que en los niveles socioeconómicos medio y alto, al igual de lo que se informa en los países industrializados, observamos una disminución significativa, así como de las enfermedades vinculadas a esta infección (úlcera péptica y adenocarcinoma gástrico).14,25,26
La persistencia de una prevalencia alta de la infección del estómago por H. pylori en el nivel socioeconómico bajo puede explicarse por el hecho de que las condiciones de vida de este sector poblacional no han variado sustancialmente y porque una mayoría de ellos no consumen agua potable sino agua proveniente de ríos que es expendida a ellos por camiones cisterna, sin que el líquido elemento haya sido potabilizado.
La explicación de la disminución de la prevalencia de la infección en los niveles socioeconómicos medio y alto se debería, por una parte, a que a partir de 1991, luego de la epidemia de cólera que sobrevino en el Perú, la potabilización del agua mejoró mucho y es conocido que el agua con niveles adecuados de cloro se asocia a inhibición del crecimiento de esta bacteria.27
La población de nivel socioeconómico medio y alto tiene acceso al agua potable, a diferencia de la de nivel socioeconómico bajo, que adquiere el agua principalmente de pozos, acequias o ríos.
Otra explicación adicional para este cambio de prevalencia de la infección por Helicobacter pylori entre los niveles socioeconómicos bajo y alto, es el hecho de que en este último estrato, para el tratamiento de diversas infecciones se emplean antibióticos que en cierto modo actuarían sobre la bacteria.
En nuestras investigaciones demostramos una mayor proporción, aunque pequeña, de varones infectados por H. pylori; hallazgo similar a lo descrito anteriormente en la literatura internacional; existe además un metanálisis que concluye que el riesgo de infección es ligeramente mayor para el sexo masculino.28 Sin embargo, se debe que considerar que existe un trabajo que comunica que en México la infección es más común en las mujeres.29
En relación con la edad, encontramos que en nuestro país la infección por H. pylori se adquiere en edades muy tempranas de la vida, a diferencia de los países industrializados. Estos hallazgos también han sido informados por otros autores, quienes confirmaron que en los países en vías de desarrollo, la población infantil se infecta tempranamente. Además, se acepta ahora que la infección en la infancia es la que determina la elevada prevalencia de la infección en adultos y es la infección infantil la que hay que prevenir para evitar los efectos deletéreos de la infección en adultos.30
Respecto de la posible predisposición racial para contraer la infección, comprobamos que al menos respecto de los pacientes japoneses, no hay diferencias significativas en las tasas de infección por Helicobacter pylori en comparación con la población peruana; observamos además que en la población japonesa, al igual que en la población peruana, las tasas de infección disminuyeron a cifras significativamente inferiores a las observadas a inicios de la década del ’90.17,31
La altura (por ancima de los 3 600 msnm) favorecería la mayor gravedad de la gastritis asociada a la infección por H. pylori. Nuestros resultados muestran que las alteraciones histológicas de gastritis crónica y metaplasia intestinal son más prevalentes en nativos de la altura en comparación con quienes residen a nivel del mar.32,33 Estos cambios probablemente están asociados con una respuesta exagerada del estómago a la infección por H. pylori en la altura, lo que es consistente con la elevada prevalencia de folículos linfoides y centros germinales activos observados en este grupo poblacional. Los folículos linfoides se acepta que están ausentes en el estómago normal,34 su presencia está significativamente asociada con el grado y actividad de la gastritis y la densidad de la colonización por H. pylori.34-36
La aparente susceptibilidad incrementada de la mucosa gástrica a los efectos patogénicos de H. pylori en la altura está relacionada probablemente a factores fisiológicos, nutricionales y del medio ambiente. Entre los priemros se han descrito cambios vasculares y variaciones autonómicas.37,38 La hipoxemia crónica lleva a policitemia, que incrementa la viscosidad sanguínea, que resulta en una perfusión vascular disminuida, incremento de la estasis, aumento de la trombosis e isquemia. Por otra parte, los nativos de altura presentan alteraciones autonómicas que pueden inducir a espasmos vasculares y musculares que también resultan en isquemia.39,40 Entre los factores nutricionales, la presencia de nitritos puede desempeñar un papel en la alta prevalencia de gastritis crónica observada en la altura. Una baja secreción ácida se ha asociado con un incremento en la presencia de nitritos,41,42 y ha sido previamente descrita en pacientes residentes en la altura.43,44 La dieta de los residentes en las zonas andinas del Perú es baja en proteínas y vitaminas y antioxidantes. Estas deficiencias dietarias pueden aumentar el nivel de radicales libres. Estos radicales libres se asocian con el daño tisular en la altura y están implicados en la patogenia del mal de altura.45,46
En el Perú, probablemente, la propagación de la bacteria a través del agua desempeñe el papel más importante para la transmisión de la infección por esta bacteria. Esta hipótesis se apoya por el hallazgo de la bacteria en el agua procedente de la Atarjea y el mayor riesgo de presentar la infección en la población usuaria de ésta en comparación con la población que bebe agua procedente de pozos.
Asociada al descenso de la prevalencia de H. pylori en los países desarrollados, hubo una marcada disminución de incidencia de las enfermedades vinculadas con esta infección como la úlcera gástrica, la úlcera duodenal, la gastritis crónica activa y el adenocarcinoma de estómago. En Lima, en el estrato socioeconómico medio y alto, también está sucediendo un fenómeno similar.47
BIBLIOGRAFÍA
1. Taylor DN, Blazer MJ. The epidemiology of Helicobacter pylori infection. Epidemiol Rev 1991; 13:42-58.
2. Eurogast Study Group. An international association between Helicobacter pylori infection and gastric cancer. Lancet 1993; 341:1359-1362.
3. Blaser MJ. Hipótesis: The changing relationships of Helicobacter pylori and humans: implications for health and disease. JID 1999; 179:1523-30.
4. Marshall BJ. Epidemiology of H. Pylori in Western countries. In: Hunt RH, Tytgat NJ eds. Helicobacter pylori basic mechanism to clinical cure. London: Kluwer Academic 1994:75-84.
5. Ramírez Ramos A. Observaciones personales próximas a ser publicadas.
6. León Barúa R. El Campylobacter pilórico y la patología gastroduodenal. Editorial Acta Gastroenter Latin Americ 1985 17:35-42.
7. Gilman RH, León Barúa R, Cok J et al. Rapid identification of Campylobacter pylori in Peruvians with gastritis. Dis Dis Sci 1986; 31:1089-94.
8. Ramírez Ramos A. Campylobacter pylori y patología gastroduodenal. 1ra Edición, Edit. Santa Ana. 1988; 101:140-141.
9. León Barúa R, Ramírez Ramos A, Gilman RH, et al. Colonización diferencial del estómago por el Campylobacter pilórico. 10º Congreso Peruano Endoscopia Digestiva. Nov 1996. Libro Resúmenes No 4.
10. Ramírez Ramos A, Recavarren S, León Barúa R, et al. Campylobacter pilórico, gastritis crónica, duodenitis crónica, úlcera gástrica y úlcera duodenal. Arq Gastroenterol São Paulo. 1987; 24(1):10-15.
11. Gilman RH, León Barúa R, Ramírez Ramos A, et al. Campylobacter pylori fails to colonize site of adenocarcinoma but non-cancerous tissue in patients with gastric cancer. Gastroenterology 1987; 92:1409.
12. Brown KE, Peura DA. Diagnosis of Helicobacter pylori infection. Gastroenterology Clinics of North America 1993; 22(1):105-115.
13. Ramírez Ramos A. Campylobacter pylori y patología gastroduodenal. 1ra. Edición, Edit. Santa Ana. 1988; 101:140-141.
14. Ramírez Ramos A, Hurtado Muñoz O, Rodríguez Ulloa C, et al. Campylobacter pilórico y nivel socioeconómico. Acta Gastroent Lat Amer 1987; 17:35-42.
15. Ramírez Ramos A, Chinga Alayo E, Mendoza Requena D, Leey Casella J, Segovia M, et al. Variación de la prevalencia del H. pylori en el Perú. Período 1985-2002 - Nivel socioeconómico medio y alto. Rev Gastroenterol Perú 2003; 23:92-98.
16. Ramírez Ramos A, Gilman R, Recavarren S, et al. Algunas características de la infección por Helicobacter pylori en el Perú. Acta Gastroenterol Latin 1991; 21:211-219.
17. Hulten K, Han SW, Enroth H, et al. Helicobacter pylori in the drinking water in Peru. Gastroenterology 1996, 110:1031-1035.
18. Ramírez Ramos A, Gilman R, Watanabe J, et al. Helicobacter pylori infection in long-term and short-term Japanese visitors to Peru. Lancet 1994; 344:1017.
19. Ramírez Ramos A, Gilman HR, Watanabe Yamamoto J, Takano Moron J, Arias Stella J. et al. Comparación de la prevalencia de la infección del estómago por el Helicobacter pylori en el Perú en población japonesa y peruana. Acta Gastroenterol Latinoam 2005; 35:219-224.
20. Gastrointestinal Physiology Working Group. Helicobacter pylori and gastritis in Peruvian patients: Relationship to socioeconomic level, age and sex. Am J Gastroenterol 1990; 85(7):819-823.
21. Recavarren Arce S, Ramírez Ramos A, Gilman R H, Chinga Alayo E, Watanabe Yamamoto J, Rodríguez Ulloa C, Miyagui J, Passaro DJ, Eza D. Severe gastritis in the peruvian andes. Histopathology 2005, 46:374-379.
22. Klein D. Gastrointestinal Physiology Working Group. Water source as risk factor for Helicobacter pylori infection in Peruvian children. Lancet 1991; 337:1503-1505.
23. Hulten K, Han SW, Enroth H, et al. Helicobacter pylori in the drinking water in Peru. Gastroenterology 1996, 110:1031-1035.
24. Brown KE, Peura DA. Diagnosis of Helicobacter pylori infection. Gastroenterology Clinics of North America 1993; 22(1):105-15.
25. Rufnow MFT, Shachter RD, Owens DK, Parsonnet J. A dynamic transmission model for predicting trends in Helicobacter pylori associated diseases in the United States. Emerg Infect Dis 2000; 6(3):228-237.
26. Soto G, Bautista C, Roth D, Gilman H, Velapatino B, et al. and Gastrointestinal Physiology Working Group in Peru. Helicobacter pylori reinfection is common in Peruvian adults following antibiotic eradication therapy (enviado para publicación).
27. Webb PM, Knight T, Greaves S, et al. Relation between infection with Helicobacter pylori and living conditions in childhood: evidence for person to person transmission in early life. British Medical Journal 1994; 308:750-753.
28. Replogle ML, Glaser SL, Hiatt RA, Parsonnet J. Biologic sex as risk factor for Helicobacter pylori infection in healthy young adults. Am J Epidemiol 1995; 142(8):856-863.
29. Torres J, Leal Herrera Y, Pérez Pérez G, Gómez A, Camorlinga Ponce M, et al. A community-based seroepidemiology study of Helicobacter pylori infection in Mexico. J Infect Dis 1998; 178:1089-94.
30. León Barúa R. Factores geográficos y socioeconómicos en la orientación de la patología gastroduodenal asociada a la infección por Helicobacter pylori. En: Robles C, ed., Cáncer Gástrico. Ecuador: Gráfica Ramírez, 2002: 43-53.
31. Ramírez Ramos A, Watanabe J, Arias Stella J, et al. Helicobacter pylori infection in Peruvian patients of Japanese descent residing in Peru. 2003. (en prensa).
32. Recavarren Arce S, León Barúa R, Cok J, Berendson R, Gilman RH, Ramírez Ramos A, Rodríguez C, Spira WM. Helicobacter pylori and progressive gastric pathology that predisposes to gastric cancer. Scand J Gastroenterol 1991; 26(S181):51-7.
33. Pajares García JM, Correa P, Pérez Pérez GI. Helicobacter pylori infection in gastroduodenal lesions, the second decade, 1st ed. Barcelona: Prous Science, 2000.
34. Genta RM, Hamner HW, Graham DY. Gastric lymphoid follicles in Helicobacter pylori infection: Frequency, distribution, and response to triple therapy. Human Pathology 1993; 24:577-583.
35. The Gastrointestinal Physiology Working Group. Rapid identification of pyloric Campylobacter in Peruvians with gastritis. Dig Dis Sci 31:1089-94, 1986.
36. Eidt S, Stolte M. Prevalence of lymphoid follicles and aggregates in Helicobacter pylori gastritis in antral and body mucosa. J Clin Pathol 1993; 46:832-835.
37. Monge M, Monge C. High altitude diseases. Springfield, Ill: Charles C. Thomas Publ, 1966.
38. Monge C, Arregui A, León Velarde F. Pathophysiology and epidemiology of chronic mountain sickness. Int J Sports Med 1992; 13(Suppl 1):S79-81.
39. Monge C, Pesce H. Sistema neurovegetativo del hombre de los Andes. An Fac Med Lima 1935; 17:42-5.
40. Cabieses F. Contribución al estudio del sistema nervioso vegetativo en relación con la vida en las grandes alturas. An Fac Med Lima 1946; 29:5-8.
41. León Barúa R, Recavarren Arce S, Gilman RH, Berendson R. Can eradication of Helicobacter pylori prevent gastric cancer? Drugs 1993; 46:341-6.
42. Correa P, Cuello C, Duque E, Burbano LC, García FT, Bolanos O, Brown C, Haenszel W. Gastric cancer in Columbia. III. Natural history of precursor lesions. J Natl Cancer Inst. 1976; 57:1027-35.
43. Garrido Klinge G, Horna J, Peña L. Estimulación de la secreción gástrica con Histalog en las grandes alturas de los Andes del Perú. Trib Méd Per 1964; 1:8.
44. Frisancho D, Frisancho O. Fisiología y Patología digestiva en la altura. Rev Gastroenterol Peru 1992; 12:155-8.
45. Bailey DM, Davies B, Young IS, Hullin DA, Seddon PS. A potential role for free radical-mediated skeletal muscle soreness in the pathophysiology of acute mountain sickness. Aviat Space Environ Med 2001; 72:513-21.
46. Roche E, Romero Alvira D. Role of oxygen free radicals in altitude-related disorders. Med Hypotheses 1994; 42:105-9.
47. Watanabe Yamamoto J, Takano Morón J, Arias Stella J, Yoshiwara Wakabayashi E, Rodríguez Ulloa C, Miyagui Maeda J, et al. Prevalencia de la úlcera gástrica, úlcera duodenal y el adenocarcinoma gástrico en el Policlínico Peruano Japonés. Período 1985-2002 (en prensa).
|


![]()
![]()

