Introducción
Actualmente existe consenso acerca de que Helicobacter pylori,
bacteria gramnegativa que infecta el estómago humano, es el
agente causal de la gastritis crónica activa y uno de los tantos
factores contribuyentes a la aparición de úlcera
péptica, adenocarcinoma gástrico y el linfoma tipo MALT
de grado leve.1,2
Es una infección muy difundida en el mundo, cuya prevalencia se
estima en 30% en los países desarrollados y en 90% en las
naciones en vías de desarrollo.
Desde su descripción por Marshall y Warren en 1984, hasta la
fecha, en los países industrializados se registra una
disminución de la presencia de esta bacteria en pacientes con
úlcera duodenal, úlcera gástrica y gastritis
crónica activa; se observa además, paralelamente, que la
frecuencia de úlcera gástrica, úlcera duodenal y
adenocarcinoma gástrico, está igualmente en
disminución.3,4 En el Perú, en el curso de los últimos 20 años, hemos observado igual variación.5
En el Grupo de Fisiología Gastrointestinal de la Universidad
Peruana Cayetano Heredia y de la Universidad de Johns Hopkins, desde
poco tiempo después de la descripción de Marshall y
Warren hemos venido estudiando diversos aspectos de la infección
del estómago por esta bacteria.6-11
Dentro de nuestro campo de estudio y observaciones están los
aspectos epidemiológicos de la infección estomacal por Helicobacter pylori en el Perú, que creemos pertinente presentar en el presente artículo.
Métodos
Pacientes
Todos nuestros estudios se realizaron en pacientes con síntomas
crónicos del tracto gastrointestinal superior que acudían
a consulta y para quienes se programaba una endoscopia
esofagogastroduodenal.
Endoscopia
Se realizó en ayunas y luego de administrar anestesia
orofaríngea con xylocaína al 10%. Después de cada
endoscopia el instrumento era enjuagado y lavado con solución de
glutaraldehído y con agua estéril para evitar la
contaminación del paciente o de las biopsias.
Prueba de la ureasa
Los especímenes fueron incubados a temperatura ambiente en un
medio urea-R-Broth, a una concentración de 20 g/l de urea en PBS
(pH = 7.1) y 1% de rojo fenol. Se consideró un resultado
positivo cuando había un cambio rápido (menos de 1
minuto) del anaranjado al rosado.12
Cultivo
Las biopsias gástricas se colocaban en placas de agar
sangre-Skirrow. Se procedía luego a la siembra del material, y
posteriormente se colocaba en una campana de anaerobiosis para su
transporte. Una vez en el laboratorio se siguió el procedimiento
de gaseado, lectura a la hora, 6 horas y 24 horas luego de la
incubación, procediéndose a las pruebas de
coloración con tinción de Gram, campo oscuro y las
pruebas bioquímicas de ureasa, catalasa, citocromo oxidasa y
antibiograma.13
Serología
Las muestras de sangre se obtuvieron por venopunción en
pacientes adultos y por punción de la yema del dedo en
niños. Se utilizó un antígeno crudo preparado de
una fuente de nueve cepas de Helicobacter pylori para el método ELISA. La prueba de ELISA fue estandarizada usando titulaciones del antígeno versus diluciones de suero de pacientes confirmados de ser positivos para Helicobacter pylori o
negativos, por biopsias múltiples e historia clínica. El
procedimiento final involucró una capa de antígeno
preparada usando 2.5 μg/l de antígeno en buffer carbonato
(pH 9.6) y diluciones de suero de 1:200 a 1:500. La prueba se
llevó a cabo en platos de Inmulon usando peroxidasa de conejo
anti-IgG humana marcada para completar el “sándwich”
y ortofenilendiamina (Sigma Cp.) en buffer de citrato (2.95 de
citrato de sodio 0.1 M y 2.05 M de ácido cítrico 0.01 M)
como sustrato para la reacción colorimétrica. Una
reacción seropositiva era definida en un suero dado con una OD
mayor de 2 desviaciones estándar sobre una media de OD para
control negativo del suero incluyendo el plato.
Prueba del aliento con 13C-urea
Se colectó una muestra de aliento basal, luego de lo cual se administraron 125 mg de 13C-urea (99% 13C
Isotec Corporation, Miamisburg, EE.UU.) disueltos en un frasco con 120
ml de agua. En niños pequeños se administró el
sustrato en 40 ml de agua. El sustrato fue ingerido en 3 a 5 minutos.
Para colectar las muestras de aliento se usó un equipo
pediátrico de reanimación con válvula de una a dos
entradas unidas a una bolsa colectora. Las muestras fueron obtenidas
colocando la máscara sobre la boca y nariz del niño. La
respiración normal llenaba la bolsa. Se colectaron muestras a
los 20, 30, 40 y 50 minutos. Luego las muestras fueron transferidas de
la bolsa a un tubo evacuatorio para enviarlas a Houston. El 13C del CO2
respirado fue medido por espectrometría automática de
masa de rango gas isótopo y comparado con el estándar de
referencia. El enriquecimiento por encima del basal fue expresado con
partes por mil, y una prueba de aliento con más de 6 partes por
mil de enriquecimiento sobre un basal en el período de 50
minutos fue considerada positiva para Helicobacter pylori.
Pruebas histológicas
Las biopsias para estudios histológicos se fijaron en formol
neutro. Luego de su inclusión en parafina se efectuaron cortes
de 3 a 4 micras de espesor, se colorearon con hematoxilina-eosina en
todos los casos y con coloración con plata, PAS y Waysson en
ciertos grupos. La lectura histológica se hizo de manera ciega
considerando: presencia de Helicobacter pylori en el epitelio y
en el mucus o mucina, daño mucinoso o alteración de la
vacuola mucinosa del epitelio de cubierta, pérdida de las
glándulas propias o atrofia, displasia y metaplasia intestinal.
Prueba de PCR
Los fragmentos de ADN de H. pylori fueron amplificados mediante el uso de primers dirigidos al gen de la ureasa, en un volumen de reacción de 25 μl que contenía 2 mM de MgCl2, 0.25 mM de dNTPs, 0.4 μM de cada primer, 1X de buffer, 0.02
U/μl Taq polimerasa, y 5 μl del ADN extraído. Los
siguientes oligonucleótidos, los cuales fueron usados como
cebadores o primers, fueron derivados de la secuencia del gen
de la ureasa (ureB) reportados por Jeong y col.: ureaseB-F
(5’CGTCCGGCAATAGCTGCCATAGT) y ureaseB-R
(GTAGGTCCTGCTACTGAAGCCTTA). Las temperaturas que se usaron fueron las
siguientes: 1 min a 94°C, 1 min a 67 °C y 1 min a 72 °C. Se
realizaron 35 ciclos de amplificación, luego una corrida
electroforética en agarosa al 2% con bromuro de etidio en la
muestra. Se observó bajo iluminación ultravioleta que
puso de manifiesto la presencia de un fragmento de banda amplificado de
un tamaño de 467 pares de bases.
Determinación del nivel socioeconómico
Para establecer el nivel socioeconómico de los pacientes se
usó una ficha-cuestionario que contenía la siguiente
información: lugar y zona de residencia en la ciudad, nivel
educativo, ocupación, tipo y características de la
vivienda, número de personas que la habitan, material de
construcción de la vivienda, características del
abastecimiento de agua y servicios de desagüe, número de
comidas al día, nivel de ingresos, cobertura de las necesidades
de alimentación, vestido, educación, atención de
salud y capacidad de agua.
En cada uno de los grupos estudiados, especificamos los métodos que hemos empleado.
Resultados
Prevalencia de la infección por Helicobacter pylori
Hasta fines de la década del ’80 estudiamos 672 pacientes,
325 de nivel socioeconómico bajo y 347 de nivel
socioeconómico alto. En todos se realizó endoscopia
esofagogastroduodenal y biopsias que fueron coloreadas por el
método de hematoxilina-eosina (nivel socioeconómico alto)
y hematoxilina-eosina y coloración con plata por el
método de Warthin Starryen en el estrato socioeconómico
bajo. No encontramos diferencias en las prevalencias según el
estrato social al que perteneció el paciente y en ambos grupos
la prevalencia de la infección por Helicobacter pylori fue
similar a la informada en los países industrializados: gastritis
crónica activa 91.8%; úlcera gástrica activa 70.9%
y úlcera duodenal activa 86%.14
En una evaluación de 1 815 endoscopias realizadas entre 1985 y
2002 en pacientes de estrato socioeconómico medio y alto,
utilizando la coloración de las biopsias con
hematoxilina-eosina, observamos que al comparar con los resultados
arriba mencionados, se ha producido una significativa
disminución de la prevalencia de la infección del
estómago por Helicobacter pylori en pacientes con diagnóstico de gastritis crónica activa, úlcera gástrica y úlcera duodenal.15
Estudio de los factores de riesgo para la infección por Helicobacter pylori
Edad: Con el objetivo de determinar la persistencia longitudinal de la infección por Helicobacter pylori en
niños peruanos, evaluamos 105 niños, a partir de los 6
meses de edad, a intervalos de 6 meses con la prueba de aliento con 13C-urea,
logramos estudiar satisfactoriamente a 56 niños hasta los 30
meses de edad. Demostramos que los niños peruanos se infectan
por Helicobacter pylori a temprana edad vida y que el número de infectados se incrementa con la edad.16
Luego determinamos una prevalencia de infección por Helicobacter pylori de 48% con la prueba del aliento con 13C-urea
en 407 niños con edades comprendidas entre 2 meses y 12
años, de familias de nivel socioeconómico alto y bajo.17
Por otro lado, en la serie de pacientes estudiados durante el
período de 1985 a 2002, en el estrato socioeconómico
medio y alto encontramos, utilizando la coloración
hematoxilina-eosina en biopsias gástricas, que la prevalencia de
la infección por H. pylori se incrementa conforme
aumenta la edad en los grupos de pacientes con gastritis crónica
activa, úlcera gástrica y mucosa gástrica normal,
hasta llegar a un pico de prevalencia entre los 41 y 50 años,
para luego disminuir paulatinamente conforme la edad supera los 50
años.
Raza-etnia: Con el fin de observar si en nuestro medio
había una predisposición genética para contraer la
infección, diseñamos un estudio para comparar la
prevalencia de la infección por H. pylori entre la
población de origen japonés residente en el Perú y
la población peruana con síntomas del tracto digestivo
superior, excluyendo pacientes con diagnóstico de úlcera
péptica y adenocarcinoma.18 La población
japonesa residente en el Perú estuvo compuesta por: inmigrantes
japoneses con más de 10 años de residencia en el
Perú, niseis peruanos (hijos de madre y padre japoneses)
y japoneses con menos de un año de residencia en el Perú;
la población peruana estaba conformada por peruanos nativos. Se
realizó endoscopia, cultivo, estudio bacteriológico,
histológico (coloración con hematoxicilina-eosina, PAS y
plata) y serología.
La frecuencia de la infección por Helicobacter pylori fue elevada en los cuatro grupos estudiados (tabla 1), 69% en niseis, 59%
en inmigrantes no recientes, 78% en inmigrantes recientes y 77% en
peruanos nativos. Nuestros resultados no mostraron diferencias
estadísticas significativas en la prevalencia de la
infección por Helicobacter pylori asociada a gastritis entre los grupos analizados.

A la fecha, hemos realizado otro estudio que incluyó un mayor
número de casos: 168 pacientes japoneses (cuyos ascendentes eran
japoneses, por lo menos las tres últimas generaciones, por
línea materna y paterna) y 161 pacientes peruanos, ambos grupos
del mismo estrato socioeconómico.19
La prevalencia observada en los pacientes japoneses utilizando la
prueba de la ureasa fue de 47%, y en los peruanos, de 48%; en tanto que
al emplear la prueba de PCR fue de 50% en peruanos y 43% en japoneses
(tabla 2), sin tampoco encontrar diferencias significativas.

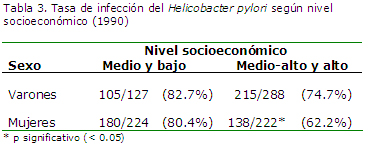
Nivel socioeconómico: En el estudio realizado en 1990,20
que incluyó la evaluación endoscópica de 861
pacientes de diferentes edades con síntomas del tracto
gastrointestinal superior, establecimos a través de la
coloración hematoxilina-eosina y la de plata en biopsias
gástricas, que la tasa de infección por Helicobacter pylori era
igual en los diversos niveles socioeconómicos de Lima, con
excepción de las mujeres de nivel socioeconómico alto, en
las que la prevalencia era menor, con significación
estadística.
Recientemente, como ya hemos mencionado, en 1 815 endoscopias
realizadas en pacientes con síntomas del tracto gastrointestinal
superior de niveles socioeconómicos medio y alto de Lima, entre
1985 y 2002, demostramos una disminución significativa de la
prevalencia de infección por H. pylori en este estrato social15 (tabla 3).
Ecología de la infección por H. pylori
Con la finalidad de determinar la ecología de la infección por H. pylori estudiamos
a 356 pacientes de la costa (principalmente de Lima), 64 pacientes de
la sierra (La Oroya, a 3 600 metros sobre el nivel del mar [msnm]) y 96
pacientes de la ciudad de Pucallpa, localizada en la selva peruana;
estos grupos eran de nivel socioeconómico bajo. Además
del examen endoscópico, a todos los pacientes se les realizaron
estudios bacteriológicos, tinción de Gram del cepillado y
estudios histológicos con hematoxilina-eosina.16
La frecuencia de infección por H. pylori fue de 80%, 85%
y 70% en mujeres de la selva, la sierra y la costa, respectivamente, y
de 90%, 93% y 78% en hombres de la selva, la sierra y la costa,
respectivamente.
Estudio de la infección por H. pylori en la altura
Recientemente, con el objetivo de comparar la patología gástrica asociada a la infección por H. pylori en
pacientes residentes en la altura con la de pacientes a residentes
nivel del mar, diseñamos un estudio que incluyó la
evaluación endoscópica y estudios histológicos con
hematoxilina-eosina, PAS y coloración de plata de 38 pacientes
del Hospital de La Oroya (3 600 msnm) y 40 controles de Lima (a nivel
del mar) con infección por H. pylori. Un mayor
compromiso de la mucosa gástrica fue más común en
los pacientes residentes en la altura al compararlos con los residentes
al nivel del mar.21
Transmisión de la infección
En un estudio realizado en Lima se recolectaron 48 muestras de agua
bebible de diferentes localidades en pueblos jóvenes cerca de
Lima: 30 muestras del sistema de agua municipal en el Valle Sharon, 14
de la comunidad de Pampas de San Juan y 4 de casas a las cuales se
administraba el agua de camiones cisterna. Mediante la técnica
del PCR se halló material genético de H. pylori en
24 muestras, 20 de ellas procedían de la planta tratamiento de
agua de la Atarjea. Además, en ese mismo estudio se
demostró un aumento del riesgo de infección por Helicobacter pylori en
aquellos que bebían agua de la red municipal (Atarjea), en
comparación con los que bebían el agua de pozos
particulares. Esta asociación fue independiente del nivel
socioeconómico y de la presencia de una instalación de
agua adecuada en el interior del hogar.22
Prevalencia de enfermedades gastrointestinales asociadas a la infección
Al evaluar 31 446 endoscopias digestivas altas realizadas entre 1985 y
2002 en personas de nivel socioeconómico medio y alto de Lima,
encontramos una reducción significativa y sostenida de la
prevalencia de úlcera gástrica, úlcera duodenal y
adenocarcinoma gástrico (figura 1).

Discusión
Al comparar nuestras observaciones en el curso de 23 años sobre la infección del estómago por Helicobacter pylori en el Perú, encontramos variaciones que ameritan la presente comunicación.
Inicialmente informamos igual prevalencia de la infección por
esta bacteria en pacientes con síntomas crónicos del
tracto gastrointestinal superior, tanto de nivel socioeconómico
alto como bajo, en la ciudad de Lima,23 así como en las tres regiones del país, en pacientes de nivel socioeconómico bajo.24
A la fecha, no hemos realizado un nuevo estudio de la prevalencia de
esta infección en las tres regiones del país (costa,
sierra y selva), pero sí a nivel de la zona metropolitana de
Lima, y es interesante señalar que en pacientes de nivel
socioeconómico bajo, la prevalencia de la infección se
mantiene elevada, en tanto que en los niveles socioeconómicos
medio y alto, al igual de lo que se informa en los países
industrializados, observamos una disminución significativa,
así como de las enfermedades vinculadas a esta infección
(úlcera péptica y adenocarcinoma gástrico).14,25,26
La persistencia de una prevalencia alta de la infección del estómago por H. pylori en
el nivel socioeconómico bajo puede explicarse por el hecho de
que las condiciones de vida de este sector poblacional no han variado
sustancialmente y porque una mayoría de ellos no consumen agua
potable sino agua proveniente de ríos que es expendida a ellos
por camiones cisterna, sin que el líquido elemento haya sido
potabilizado.
La explicación de la disminución de la prevalencia de la
infección en los niveles socioeconómicos medio y alto se
debería, por una parte, a que a partir de 1991, luego de la
epidemia de cólera que sobrevino en el Perú, la
potabilización del agua mejoró mucho y es conocido que el
agua con niveles adecuados de cloro se asocia a inhibición del
crecimiento de esta bacteria.27
La población de nivel socioeconómico medio y alto tiene
acceso al agua potable, a diferencia de la de nivel
socioeconómico bajo, que adquiere el agua principalmente de
pozos, acequias o ríos.
Otra explicación adicional para este cambio de prevalencia de la infección por Helicobacter pylori entre
los niveles socioeconómicos bajo y alto, es el hecho de que en
este último estrato, para el tratamiento de diversas infecciones
se emplean antibióticos que en cierto modo actuarían
sobre la bacteria.
En nuestras investigaciones demostramos una mayor proporción, aunque pequeña, de varones infectados por H. pylori; hallazgo
similar a lo descrito anteriormente en la literatura internacional;
existe además un metanálisis que concluye que el riesgo
de infección es ligeramente mayor para el sexo masculino.28
Sin embargo, se debe que considerar que existe un trabajo que comunica
que en México la infección es más común en
las mujeres.29
En relación con la edad, encontramos que en nuestro país la infección por H. pylori se
adquiere en edades muy tempranas de la vida, a diferencia de los
países industrializados. Estos hallazgos también han sido
informados por otros autores, quienes confirmaron que en los
países en vías de desarrollo, la población
infantil se infecta tempranamente. Además, se acepta ahora que
la infección en la infancia es la que determina la elevada
prevalencia de la infección en adultos y es la infección
infantil la que hay que prevenir para evitar los efectos
deletéreos de la infección en adultos.30
Respecto de la posible predisposición racial para contraer la
infección, comprobamos que al menos respecto de los pacientes
japoneses, no hay diferencias significativas en las tasas de
infección por Helicobacter pylori en comparación
con la población peruana; observamos además que en la
población japonesa, al igual que en la población peruana,
las tasas de infección disminuyeron a cifras significativamente
inferiores a las observadas a inicios de la década del ’90.17,31
La altura (por ancima de los 3 600 msnm) favorecería la mayor
gravedad de la gastritis asociada a la infección por H. pylori. Nuestros
resultados muestran que las alteraciones histológicas de
gastritis crónica y metaplasia intestinal son más
prevalentes en nativos de la altura en comparación con quienes
residen a nivel del mar.32,33 Estos cambios probablemente están asociados con una respuesta exagerada del estómago a la infección por H. pylori en
la altura, lo que es consistente con la elevada prevalencia de
folículos linfoides y centros germinales activos observados en
este grupo poblacional. Los folículos linfoides se acepta que
están ausentes en el estómago normal,34 su
presencia está significativamente asociada con el grado y
actividad de la gastritis y la densidad de la colonización por H. pylori.34-36
La aparente susceptibilidad incrementada de la mucosa gástrica a los efectos patogénicos de H. pylori en
la altura está relacionada probablemente a factores
fisiológicos, nutricionales y del medio ambiente. Entre los
priemros se han descrito cambios vasculares y variaciones
autonómicas.37,38 La hipoxemia crónica lleva a
policitemia, que incrementa la viscosidad sanguínea, que resulta
en una perfusión vascular disminuida, incremento de la estasis,
aumento de la trombosis e isquemia. Por otra parte, los nativos de
altura presentan alteraciones autonómicas que pueden inducir a
espasmos vasculares y musculares que también resultan en
isquemia.39,40 Entre los factores nutricionales, la
presencia de nitritos puede desempeñar un papel en la alta
prevalencia de gastritis crónica observada en la altura. Una
baja secreción ácida se ha asociado con un incremento en
la presencia de nitritos,41,42 y ha sido previamente descrita en pacientes residentes en la altura.43,44
La dieta de los residentes en las zonas andinas del Perú es baja
en proteínas y vitaminas y antioxidantes. Estas deficiencias
dietarias pueden aumentar el nivel de radicales libres. Estos radicales
libres se asocian con el daño tisular en la altura y
están implicados en la patogenia del mal de altura.45,46
En el Perú, probablemente, la propagación de la bacteria
a través del agua desempeñe el papel más
importante para la transmisión de la infección por esta
bacteria. Esta hipótesis se apoya por el hallazgo de la bacteria
en el agua procedente de la Atarjea y el mayor riesgo de presentar la
infección en la población usuaria de ésta en
comparación con la población que bebe agua procedente de
pozos.
Asociada al descenso de la prevalencia de H. pylori en los
países desarrollados, hubo una marcada disminución de
incidencia de las enfermedades vinculadas con esta infección
como la úlcera gástrica, la úlcera duodenal, la
gastritis crónica activa y el adenocarcinoma de estómago.
En Lima, en el estrato socioeconómico medio y alto,
también está sucediendo un fenómeno similar.47
BIBLIOGRAFÍA
1. Taylor DN, Blazer MJ. The epidemiology of Helicobacter pylori infection. Epidemiol Rev 1991; 13:42-58.
2. Eurogast Study Group. An international association between Helicobacter pylori infection and gastric cancer. Lancet 1993; 341:1359-1362.
3. Blaser MJ. Hipótesis: The changing relationships of Helicobacter pylori and humans: implications for health and disease. JID 1999; 179:1523-30.
4. Marshall BJ. Epidemiology of H. Pylori in Western countries. In: Hunt RH, Tytgat NJ eds. Helicobacter pylori basic mechanism to clinical cure. London: Kluwer Academic 1994:75-84.
5. Ramírez Ramos A. Observaciones personales próximas a ser publicadas.
6. León Barúa R. El Campylobacter pilórico y la patología gastroduodenal. Editorial Acta Gastroenter Latin Americ 1985 17:35-42.
7. Gilman RH, León Barúa R, Cok J et al. Rapid identification of Campylobacter pylori in Peruvians with gastritis. Dis Dis Sci 1986; 31:1089-94.
8. Ramírez Ramos A. Campylobacter pylori y patología gastroduodenal. 1ra Edición, Edit. Santa Ana. 1988; 101:140-141.
9. León Barúa R, Ramírez Ramos A, Gilman RH, et
al. Colonización diferencial del estómago por el Campylobacter pilórico. 10º Congreso Peruano Endoscopia Digestiva. Nov 1996. Libro Resúmenes No 4.
10. Ramírez Ramos A, Recavarren S, León Barúa R, et al. Campylobacter pilórico,
gastritis crónica, duodenitis crónica, úlcera
gástrica y úlcera duodenal. Arq Gastroenterol São
Paulo. 1987; 24(1):10-15.
11. Gilman RH, León Barúa R, Ramírez Ramos A, et al. Campylobacter pylori
fails to colonize site of adenocarcinoma but non-cancerous tissue in
patients with gastric cancer. Gastroenterology 1987; 92:1409.
12. Brown KE, Peura DA. Diagnosis of Helicobacter pylori infection. Gastroenterology Clinics of North America 1993; 22(1):105-115.
13. Ramírez Ramos A. Campylobacter pylori y patología gastroduodenal. 1ra. Edición, Edit. Santa Ana. 1988; 101:140-141.
14. Ramírez Ramos A, Hurtado Muñoz O, Rodríguez Ulloa C, et al. Campylobacter pilórico y nivel socioeconómico. Acta Gastroent Lat Amer 1987; 17:35-42.
15. Ramírez Ramos A, Chinga Alayo E, Mendoza Requena D, Leey
Casella J, Segovia M, et al. Variación de la prevalencia del H. pylori en
el Perú. Período 1985-2002 - Nivel socioeconómico
medio y alto. Rev Gastroenterol Perú 2003; 23:92-98.
16. Ramírez Ramos A, Gilman R, Recavarren S, et al. Algunas características de la infección por Helicobacter pylori en el Perú. Acta Gastroenterol Latin 1991; 21:211-219.
17. Hulten K, Han SW, Enroth H, et al. Helicobacter pylori in the drinking water in Peru. Gastroenterology 1996, 110:1031-1035.
18. Ramírez Ramos A, Gilman R, Watanabe J, et al. Helicobacter pylori infection in long-term and short-term Japanese visitors to Peru. Lancet 1994; 344:1017.
19. Ramírez Ramos A, Gilman HR, Watanabe Yamamoto J, Takano
Moron J, Arias Stella J. et al. Comparación de la prevalencia de
la infección del estómago por el Helicobacter pylori en el Perú en población japonesa y peruana. Acta Gastroenterol Latinoam 2005; 35:219-224.
20. Gastrointestinal Physiology Working Group. Helicobacter pylori and gastritis in Peruvian patients: Relationship to socioeconomic level, age and sex. Am J Gastroenterol 1990; 85(7):819-823.
21. Recavarren Arce S, Ramírez Ramos A, Gilman R H, Chinga Alayo
E, Watanabe Yamamoto J, Rodríguez Ulloa C, Miyagui J, Passaro
DJ, Eza D. Severe gastritis in the peruvian andes. Histopathology 2005,
46:374-379.
22. Klein D. Gastrointestinal Physiology Working Group. Water source as risk factor for Helicobacter pylori infection in Peruvian children. Lancet 1991; 337:1503-1505.
23. Hulten K, Han SW, Enroth H, et al. Helicobacter pylori in the drinking water in Peru. Gastroenterology 1996, 110:1031-1035.
24. Brown KE, Peura DA. Diagnosis of Helicobacter pylori infection. Gastroenterology Clinics of North America 1993; 22(1):105-15.
25. Rufnow MFT, Shachter RD, Owens DK, Parsonnet J. A dynamic transmission model for predicting trends in Helicobacter pylori associated diseases in the United States. Emerg Infect Dis 2000; 6(3):228-237.
26. Soto G, Bautista C, Roth D, Gilman H, Velapatino B, et al. and Gastrointestinal Physiology Working Group in Peru. Helicobacter pylori reinfection is common in Peruvian adults following antibiotic eradication therapy (enviado para publicación).
27. Webb PM, Knight T, Greaves S, et al. Relation between infection with Helicobacter pylori and
living conditions in childhood: evidence for person to person
transmission in early life. British Medical Journal 1994; 308:750-753.
28. Replogle ML, Glaser SL, Hiatt RA, Parsonnet J. Biologic sex as risk factor for Helicobacter pylori infection in healthy young adults. Am J Epidemiol 1995; 142(8):856-863.
29. Torres J, Leal Herrera Y, Pérez Pérez G, Gómez
A, Camorlinga Ponce M, et al. A community-based seroepidemiology study
of Helicobacter pylori infection in Mexico. J Infect Dis 1998; 178:1089-94.
30. León Barúa R. Factores geográficos y
socioeconómicos en la orientación de la patología
gastroduodenal asociada a la infección por Helicobacter pylori. En: Robles C, ed., Cáncer Gástrico. Ecuador: Gráfica Ramírez, 2002: 43-53.
31. Ramírez Ramos A, Watanabe J, Arias Stella J, et al. Helicobacter pylori infection in Peruvian patients of Japanese descent residing in Peru. 2003. (en prensa).
32. Recavarren Arce S, León Barúa R, Cok J, Berendson R,
Gilman RH, Ramírez Ramos A, Rodríguez C, Spira WM. Helicobacter pylori and progressive gastric pathology that predisposes to gastric cancer. Scand J Gastroenterol 1991; 26(S181):51-7.
33. Pajares García JM, Correa P, Pérez Pérez GI. Helicobacter pylori infection in gastroduodenal lesions, the second decade, 1st ed. Barcelona: Prous Science, 2000.
34. Genta RM, Hamner HW, Graham DY. Gastric lymphoid follicles in Helicobacter pylori infection: Frequency, distribution, and response to triple therapy. Human Pathology 1993; 24:577-583.
35. The Gastrointestinal Physiology Working Group. Rapid identification of pyloric Campylobacter in Peruvians with gastritis. Dig Dis Sci 31:1089-94, 1986.
36. Eidt S, Stolte M. Prevalence of lymphoid follicles and aggregates in Helicobacter pylori gastritis in antral and body mucosa. J Clin Pathol 1993; 46:832-835.
37. Monge M, Monge C. High altitude diseases. Springfield, Ill: Charles C. Thomas Publ, 1966.
38. Monge C, Arregui A, León Velarde F. Pathophysiology and
epidemiology of chronic mountain sickness. Int J Sports Med 1992;
13(Suppl 1):S79-81.
39. Monge C, Pesce H. Sistema neurovegetativo del hombre de los Andes. An Fac Med Lima 1935; 17:42-5.
40. Cabieses F. Contribución al estudio del sistema nervioso
vegetativo en relación con la vida en las grandes alturas. An
Fac Med Lima 1946; 29:5-8.
41. León Barúa R, Recavarren Arce S, Gilman RH, Berendson R. Can eradication of Helicobacter pylori prevent gastric cancer? Drugs 1993; 46:341-6.
42. Correa P, Cuello C, Duque E, Burbano LC, García FT, Bolanos
O, Brown C, Haenszel W. Gastric cancer in Columbia. III. Natural
history of precursor lesions. J Natl Cancer Inst. 1976; 57:1027-35.
43. Garrido Klinge G, Horna J, Peña L. Estimulación de la
secreción gástrica con Histalog en las grandes alturas de
los Andes del Perú. Trib Méd Per 1964; 1:8.
44. Frisancho D, Frisancho O. Fisiología y Patología
digestiva en la altura. Rev Gastroenterol Peru 1992; 12:155-8.
45. Bailey DM, Davies B, Young IS, Hullin DA, Seddon PS. A potential
role for free radical-mediated skeletal muscle soreness in the
pathophysiology of acute mountain sickness. Aviat Space Environ Med
2001; 72:513-21.
46. Roche E, Romero Alvira D. Role of oxygen free radicals in altitude-related disorders. Med Hypotheses 1994; 42:105-9.
47. Watanabe Yamamoto J, Takano Morón J, Arias Stella J,
Yoshiwara Wakabayashi E, Rodríguez Ulloa C, Miyagui Maeda J, et
al. Prevalencia de la úlcera gástrica, úlcera
duodenal y el adenocarcinoma gástrico en el Policlínico
Peruano Japonés. Período 1985-2002 (en prensa).
|


![]()

