 INFECCIONES
POR VIRUS LA CROSSE EN TENNESSEE: UNA INFECCION
EMERGENTE INFECCIONES
POR VIRUS LA CROSSE EN TENNESSEE: UNA INFECCION
EMERGENTE
|
|

|
Autor:
Timothy F. Jones
Columnista Experto de SIIC
Institucion:
Tennesse Department of Health and Vanderbit Univ.
School of Medicine, Nashville, TN , EE.UU.
|
|
Introducción
El virus La Crosse,
uno de los bunyavirus del serogrupo California, es la
causa más frecuente de encefalitis por arbovirus en
pacientes pediátricos de EE.UU. Los mosquitos lo
transmiten al ser humano y provoca enfermedad
esencialmente en niños.
En el pasado, la
encefalitis por virus La Crosse era una infección que
predominaba en los estados de la franja norte del
medio oeste norteamericano. Desde 1993 se registra un
nuevo foco endémico en la región sudeste y la mitad
de los casos informados en todo el país se producen
en West Virginia.1 En 1997, se informó un grupo de
casos de encefalitis por virus La Crosse en pacientes
pediátricos en el este de Tennessee.1 Desde entonces,
el virus aparenta ser endémico en la región.
El virus La Crosse se
transmite al ser humano por la picadura de mosquitos
infectados, en especial de los mosquitos de los huecos
de los árboles en el este, el Aedes triseriatus. El
mosquito de los huecos de los árboles se considera el
reservorio primario del virus en la naturaleza.2 Esta
especie se reproduce en huecos naturales de los árboles,
neumátricos viejos y otros envases fabricados por el
hombre en los que se acumula agua. El Ae. triseriatus
se alimenta activamente durante el día y tiene un
radio de vuelo limitado.
Aunque anualmente se
informan alrededor de 70 casos de encefalitis por
virus La Crosse al Centro de Control y Prevención de
Enfermedades de EE.UU.,1 se estima que cada año se
producirían alrededor de 300 000 infecciones en seres
humanos y que por cada caso informado se producen unas
1 000 infecciones asintomáticas o con síntomas
leves.3-5 Las estimaciones de la relación entre
infecciones inaparentes y aparentes en niños variaron
entre 26:15 y 1 500:1.4 En áreas muy endémicas, la
seropositividad aumenta con la edad y la prevalencia
de anticuerpos puede alcanzar el 35% al llegar a la
vida adulta.6 La encefalitis por virus La Crosse es
una enfermedad esencialmente pediátrica, 75% de los
casos informados se producen en menores de 10 años y
sólo 3% en mayores de 20 años.2 Después de un período
de incubación de 3 a 7 días, los niños a menudo
desarrollan un pródromo leve, típico de muchas
enfermedades virales, que incluye fiebre, cefaleas,
malestar y vómitos. En la mayoría de los casos, la
enfermedad sigue un curso no complicado, con resolución
de los síntomas al cabo de 7 u 8 días. Se desconoce
la proporción de infecciones sintomáticas que
evolucionan a encefalitis o meningitis, ya que la
mayoría de los casos con sintomatología leve
probablemente no son detectados y no se comunican a
las autoridades de salud pública. Se informó que
entre el 6% y el 15% de los pacientes que se
recuperaron de cuadros de encefalitis por virus La
Crosse sufren convulsiones recurrentes.2 La tasa de
mortalidad de los casos es inferior a 1%.7 Es difícil
distinguir a las infecciones por virus La Crosse de
otras infecciones virales del sistema nervioso
central. La mayoría no se diagnostica clínicamente.
En las que se establece el diagnóstico, las
manifestaciones varían desde enfermedades virales
inespecíficas hasta meningitis aséptica o
encefalitis evidente. Los síntomas más frecuentes de
la infección del SNC por el virus La Cross entre 40
casos informados en Tennessee entre 1997 y 2000
incluyeron fiebre (98%), cefaleas (98%), vómitos
(78%), rigidez de nuca (40%), cambios de conducta
(63%), fotofobia (53%) y alteración del estado de
conciencia (60%). A menudo se producen convulsiones
(40%). El recuento leucocitario promedio en el líquido
cefalorraquídeo (LCR) fue de 210 por mm3. La media de
edad de los pacientes de Tennessee fue de 7.3 años;
95% de los casos de meningitis/encefalitis eran
menores de 18 años y 65% eran varones.
Se requieren estudios
de laboratorio específicos para establecer el diagnóstico
de infección por virus La Crosse. La presencia de
anticuerpos IgM específicos contra este agente en el
LCR es diagnóstica. Los niveles séricos de
anticuerpos IgM pueden permanecer elevados durante más
de 9 meses en más de la mitad de los pacientes; 8 por
lo tanto, el diagnóstico serológico requiere la
demostración de un cambio en el título de
anticuerpos séricos (IgG o IgM) equivalente a cuatro
veces el valor inicial. El diagnóstico también se
confirma con la demostración de anticuerpos IgM específicos
contra el virus La Crosse en LCR o suero mediante
enzimoinmunoensayo (ELISA) de captura. Los anticuerpos
IgM en suero se confirman mediante la demostración de
anticuerpos IgG en otro ensayo serológico (como
neutralización o inhibición de la hemaglutinación).9
Epidemiología en
Tennessee
En 1997 se informaron diez casos de encefalitis por
virus La Crosse en el este de Tennessee.1 En los 33 años
anteriores sólo se habían informado 9 casos en todo
el estado. Desde 1997, anualmente se han informado
casos en la misma región (figura 1), con propagación
gradual hacia el este (figura 2).
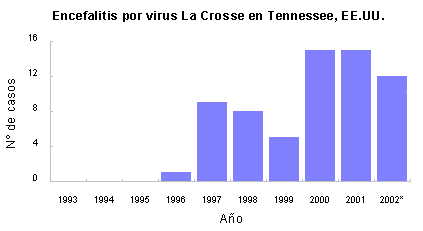
Figura 1. Número de
casos de encefalitis por virus La Crosse informados
en Tennessee, EE.UU. * Los datos del año 2002 son
preliminares.

Figura 2.
Distribución de los casos de encefalitis por virus
La Crosse en EE.UU. Cada año se comunican, en
promedio, 73 casos al Centro de Control y Prevención
de Enfermedades. Se informaron casos en 27 estados;
aquellos informados entre 1997 y 2001 en Tennessee
se agruparon en forma predominante en la región
oriental del estado.
En 1998 y 1999 se
realizó un catastro serológico para detectar
anticuerpos contra el virus La Crosse en muestras de
suero obtenidas por el laboratorio estatal en el este
de Tennessee.10 Sólo se detectaron evidencias de
anticuerpos contra el virus La Crosse en 5 (0.5%) de 1
000 muestras de suero. Tres de estos 5 especímenes
pertenecían a personas menores de 26 años. Los
hallazgos indicaron que el virus La Crosse había sido
introducido recientemente en la región, y no que se
encontraba allí desde hacía muchos años pero no había
sido identificado.
Para comprender mejor
el surgimiento de la infección por virus La Crosse en
el este de Tennessee, en el año 2000 se realizó un
estudio de cohortes a ciegas. 11 Se incluyeron 40 niños
con infecciones del sistema nervioso central, en 16
(40%) de los cuales posteriormente se confirmó por métodos
serológicos la infección por el virus La Crosse. Los
factores asociados significativamente con ella
incluyeron el número promedio de horas por día que
el paciente se encontraba al aire libre (5.9 horas
para los casos por virus La Crosse vs. 4.0 horas para
el resto de los pacientes; p = 0.049), vivienda en un
terreno con uno más huecos en los árboles en un
radio de 100 m (riesgo relativo = 3.96; p = 0.028) y
la carga de Aedes albopictus alrededor de la vivienda
(que fue más de 3 veces mayor en los casos de
encefalitis por virus La Crosse).
Discusión
El Ae. triseriatus, o mosquito del hueco de los árboles
del este, es el vector primario del virus La Crosse.3
El virus se transmite en esta especie de mosquito en
forma vertical (por vía transovárica) u horizontal
(venérea). Diversos mamíferos pequeños, tales como
la ardilla listada del este, la ardilla gris y el
zorro rojo, pueden actuar como huéspedes de
amplificación.3 Este aspecto de la biología del
virus La Crosse es considerablemente diferente de la
del virus del Oeste del Nilo; por ejemplo, posee un
ciclo natural ave-mosquito. En el año 2000, el virus
La Crosse se aisló por primera vez de Ae. albopictus
(mosquito del tigre asiático) infectados naturalmente
en el este de Tennessee.12 Con anterioridad, en
estudios de laboratorio se había demostrado que esta
especie era un vector competente del virus La Crosse,
pero el agente nunca había sido identificado en
mosquitos del tigre asiático infectados naturalmente.
El Ae. albopictus fue introducido en los EE.UU. en
1985 y se propagó rápidamente a unos 30 estados.
Actualmente es el
mosquito más abundante en Tennessee. El Ae.
albopictus es un picador agresivo que comparte un
nicho ecológico con el Ae. triseriatus y puede
reemplazar rápidamente a esa especie en sus áreas de
reproducción, en especial en los ambientes peridomésticos.
Es un vector natural del dengue y puede desempeñar un
papel en la transmisión de otros arbovirus que
afectan a los seres humanos.13 Será importante
continuar con el estudio de la importancia de la
transmisión por Ae. albopictus en la propagación del
virus La Crosse a nuevas áreas.
No existe un
tratamiento específico para la enfermedad provocada
por el virus La Crosse. Debido a que sus vectores típicamente
se reproducen en huecos de los árboles o en envases
creados por el hombre, puede ser difícil controlarlos
con los aerosoles insecticidas utilizados a menudo
para eliminar otras plagas de insectos. En áreas endémicas,
el personal sanitario y los médicos deben conocer el
diagnóstico posible de infección por virus La
Crosse. Se deben alentar las medidas de protección
personal; entre las principales se encuentran el uso
de repelentes de insectos, vestimentas protectoras,
evitación de las áreas infestadas y eliminación del
hábitat de reproducción, como neumáticos
descartados u otros recipientes que pudieran contener
agua, en particular los que se encuentran próximos a
áreas en donde juegan los niños.
Aún persisten varios
interrogantes importantes acerca de la biología y la
epidemiología del virus La Crosse. Por ejemplo, es
probable que la rápida propagación del virus del
oeste del Nilo en EE.UU. se deba a la dispersión de
su reservorio natural más importante, las aves. Por
el contrario, el virus La Crosse típicamente ha sido
una enfermedad más localizada, con focos endémicos
netos. No se conocen completamente las causas de la
propagación del virus La Crosse a nuevas áreas geográficas.
También se ignora por qué las infecciones primarias
se manifiestan principalmente en niños, a diferencia
de las provocadas por el virus del oeste del Nilo, que
afectan especialmente a los ancianos.
Hasta hace poco tiempo,
los arbovirus transmitidos por mosquitos no se
consideraban una amenaza importante para la salud en
EE.UU. La encefalitis de St. Louis ha provocado
epidemias intermitentes, localizadas, pero el último
brote importante se produjo en la década de 1970. En
1999, se introdujo el virus del oeste del Nilo en el
nordeste de EE.UU., y a partir de entonces se propagó
rápidamente por todo el país.
En 2002 se informaron
alrededor de 3 600 casos en seres humanos en 39
estados, con más de 210 casos fatales.14 En 1999 se
produjo una gran epidemia de encefalitis de St. Louis
en Louisiana (20 casos) y en el año 2002, el mismo
estado informó el mayor número de infecciones por
virus del oeste del Nilo. Todos estos arbovirus tienen
ciclos de vida, manifestaciones clínicas y características
epidemiológicas diferentes.
Sin embargo, el aumento
general observado de las enfermedades transmitidas por
mosquitos en EE.UU. tiene importantes consecuencias.
En particular, la epidemia reciente de virus del oeste
del Nilo ha generado gran atención en los medios de
comunicación y preocupación en la población. Aunque
la comunidad médica debe realizar todos los esfuerzos
para mantener en perspectiva la amenaza de las
enfermedades por arbovirus en comparación con otros
peligros para la salud pública, el estado de alerta
de la población puede brindar una oportunidad para
resaltar la importancia de la protección personal y
la prevención de las enfermedades. La aparición del
virus La Crosse y otros arbovirus en EE.UU. nos
recuerda, una vez más, que no podemos ser
complacientes con respecto a la prevención y el
control de enfermedades, y que el surgimiento continuo
de algunas y la reaparición de otras obliga a
mantener una infraestructura de salud pública
adaptable y con recursos suficientes.
BIBLIOGRAFIA
- Jones TF, Craig AS,
Nasci RS, et al. Newly recognized focus of La
Crosse encephalitis in Tennessee. Clin Infect Dis
1999;28:93-97.
- McJunkin JE, Minnich
LL, Tsai TF: California/La Crosse encephalitis, in
Feigin RD, Cherry JD (eds): Textbook of Pediatric
Infectious Diseases. Philadelphia, W.B. Saunders;
1998:2150-2158.
- Calisher CH.
Medically important arboviruses of the United
States and Canada. Clin Microbiol Rev
1994;7:89-116.
- Grimstad PR, Barrett
RL, Humphrey RL, Sinsko MJ. Serologic evidence for
widespread infection with La Crosse and St. Louis
encephalitis viruses in the Indiana human
population. Am J Epidemiol 1984;119:913-930.
- Kappus KD, Monath
TP, Kaminski RM. Reported encephalitis associated
with California serogroup infections in the United
States, 1963-1981. Prog Clin Biol Res
1983;123:31-41.
- Szumlas DE, Apperson
CS, Hartig PC, Francy DB, Karabatsos N.
Seroepidemiology of La Crosse virus infection in
humans in western North Carolina. Am J Trop Med
Hyg 1996;54:332-337.
- Parkin WE, Hammon
WM, Sather GE. Review of current epidemiologic
literature on viruses of the California arbovirus
group. Am J Trop Med Hyg 1972;14:964-978.
- Tsai TF. Arboviral
infections in the United States. Infect Dis
Clinics North Am 1991;5:73-103.
- Centers for Disease
Control and Prevention. Case definitions for
infectious conditions under public health
surveillance. MMWR 1997;46:12-13.
- Jones TF, Erwin PC,
Craig AS, et al. Serological survey and active
surveillance for La Crosse virus infections among
children in Tennessee. Clin Infect Dis
2000;31:1284-1287.
- Erwin PC, Jones TF,
Gerhardt RR, et al. La Crosse encephalitis in
eastern Tennessee; clinical, environmental and
entomological characteristics from a blinded
cohort study. Am J Epidemiol 2002;155:1060-1065.
- Gerhardt RR,
Gottfried KL, Apperson CS, et al. The first
isolation of La Crosse encephalitis virus from
naturally infected Aedes albopictus. Emerg Infect
Dis 2001;7:807-811.
- Hawley WA. The
biology of Aedes albopictus. J Am Mosq Control
Assoc 1988;4:2-39.
- Centers for Disease
Control and Prevention. West Nile virus
statistics, surveillance and control.
http://www.cdc.gov/ncidod/dvbid/westnile/surv&control.htm
. 11-15-2002. Centers for Disease Control and
Prevention, Atlanta, GA.
|
|
 DETERMINACION
DE ANTICUERPOS ANTI VIRUS DE HEPATITIS C EN FAMILIARES DE
PORTADORES DETERMINACION
DE ANTICUERPOS ANTI VIRUS DE HEPATITIS C EN FAMILIARES DE
PORTADORES
|

|
Autor:
José Hipólito Vilar
Columnista Experto de SIIC
Institucion:
Universidad Nacional del Nordeste, Corrientes, Argentina
|
Introducción
Teniendo en cuenta las publicaciones referidas a la trasmisión
del virus de la hepatitis C (HCV), se concluye que la forma más
usual de contagio es la vía parenteral.1-2 La transmisión por
contagio sexual y perinatal es considerablemente menor, en relación
con la producida por el virus de la hepatitis B.2-3 Por lo
expresado anteriormente, continúa siendo de interés conocer la
difusión familiar de HCV en familiares de portadores, ya que
estudios epidemiológicos dan, por ejemplo en España, de 2% a 3%
de la población con evidencias serológicas de infección por
este agente.4 En un trabajo realizado por nuestro grupo12 se
analizaron 270 familiares de 80 pacientes serológicamente
positivos provenientes de centros de hemodiálisis y pacientes
hemofílicos.
De los pacientes que han recibido transfusiones en algún momento
de su vida y que se contagian del virus de la hepatitis C, el 80%
puede ir a la cronicidad, y de éstos el 80% tiene mayor riesgo, a
largo plazo, de desarrollar cirrosis y carcinoma hepatocelular.2
Actualmente, al disponer de marcadores de la infección, se ha
visto que el HCV es el responsable del mayor número de hepatopatías
crónicas de origen viral en el mundo occidental. Y a medida que
aumenta la sensibilidad de las técnicas, aparecen marcadores de
infección en personas asintomáticas o con otras entidades clínicas
no relacionadas con una hepatitis viral, como el síndrome de Sjögren
o liquen plano, entre otras.
Resulta claro entonces, que conocer la difusión del virus de la
hepatitis C en familiares de portadores tiene interés por cuanto,
cuando más temprano se realice el diagnóstico, más precozmente
se puede realizar un tratamiento.
Material y métodos
Para conocer la difusión del virus de la hepatitis C en
familiares de portadores y en base a la variada bibliografía
relacionada al diagnóstico serológico del HCV, se utilizó como
prueba el test de ELISA de segunda generación Abbott Illinois,
EE.UU.
Se incluyeron en la encuesta 270 contactos familiares de 80
pacientes serológicamente positivos provenientes de centros de
hemodiálisis y pacientes hemofílicos.
De los 80 pacientes portadores del HCV, 68 se habían contagiado
aparentemente por transfusiones de sangre; uno de los pacientes
bajo diálisis era personal sanitario y 11 no tenían antecedentes
de transfusiones.
Todos los datos obtenidos de los familiares de portadores fueron
extraídos por encuesta programada, cuyos parámetros fueron:
edad, sexo, grado de relación familiar, uso de drogas
intravenosas, hábitos sexuales, transaminasas, y anti-HCV por
test de ELISA Abbott de segunda generación.
Además se tuvo en cuenta 5 683 donantes voluntarios de sangre, a
quienes se le practicó el mismo método serológico en el momento
de la donación, pero sin realizarle encuesta, incluyéndoselo
como grupo de incidencia de marcadores de infección del virus de
hepatitis C en la población general.
Resultados
De los convivientes en estudio se obtuvo positividad del anti-HCV
en tres personas de los 270 familiares (1.11%). Ninguno pertenecía
a grupo de riesgo (homosexuales, hemodializados, personal
sanitario, drogadictos) o al menos negaron serlo.
En cuanto a la distribución entre los contactos familiares, la
pareja sexual fue positiva en 2 casos del total, y1 hijo de la
madre portadora. En lo que respecta a donantes voluntarios de
sangre, se obtuvo positividad en 11 personas de 5 683 (0.1%).
Discusión
Las vías de transmisión más frecuentes del HCV es la percutánea,
a través de la administración de productos sanguíneos, órganos
donados, punciones con agujas contaminadas.1-5 Sin embargo, hay
otras formas de transmisión, como perinatal, sexual u
ocupacional, tal como lo expresan algunas publicaciones.5-7 La
prevalencia mundial entre donantes voluntarios de sangre varía
entre 0.3% y 1.5%.2 En EE.UU. la prevalencia es de 0.6%.8 En la
población que nosotros estudiamos, la incidencia en los donantes
de sangre fue de 0.19%.
Habría una relación importante entre el número de productos
sanguíneos recibidos y el riesgo de infectarse por HCV, como
ocurre con los pacientes hemofílicos. Se comprobó que en los que
reciben más de 100.000 unidades de crioprecipitados por año, la
tasa de infección fue de 76%, mientras que en aquellos que
requirieron menos, fue de 46%.3 Esto nos obliga a tener en cuenta
que entre los puntos a considerar en los pacientes portadores del
HCV se encuentra una estimación de los productos sanguíneos
recibidos (factor que no hemos considerado en nuestro trabajo por
carecer de archivos adecuados). En cuanto a la población de
hemodializados, se considera que el 70% presenta hepatitis aguda
por HCV en algún momento de su tratamiento dialítico, y
generalmente se los identifica en estados crónicos.
Por su parte, el personal sanitario que tiene contacto con sangre
o sus productos presenta riesgo incrementado de contraer HCV. El
riesgo es estimado en 18%.
En cuanto al uso de drogas intravenosas, es elevada la incidencia
de infección por HCV,9 pero en la población objeto del presente
trabajo negaron todos estos antecedentes.
La tasa de prevalencia de infección en individuos que la
contrajeron por relaciones sexuales se calcula en 4%, según
diferentes trabajos;10 en nuestro estudio tuvo resultado positivo
el 2.5% ya que eran pareja sexual de la población afectada. Es
importante considerar el número de parejas sexuales y la
concomitancia con infección por HIV, que no estuvo presente en el
estudio, pero que es interesante valorar.
Un individuo era hijo de madre portadora (2.7%). Sabiendo que la
transmisión perinatal es del 7% aproximadamente. En más del 40%
de portadores de HCV no se identifica la vía de infección; estos
casos se denominan esporádicos, y podrían haberla adquirido por
vía percutánea, exposición mucosa o por vías no tradicionales
como tatuajes o incluso contacto casual en un ámbito familiar;
trabajos realizados en Japón demostraron una tasa de infección
de familiares de portadores del 8.8%, aparentemente por las vías
no tradicionales antes citadas.2-5 Es importante destacar que se
deberían evaluar los títulos de HCV en otros fluidos corporales
además del plasma, como saliva y semen; en el estudio realizado
por Fried y colaboradores no detectaron por HCV-ARN en portadores
crónicos, pero otras experiencias demuestran que está presente
en el semen y otras en la saliva.10 Estos resultados nos llevaron
a pensar que no hay diferencias con respecto al resto del mundo en
cuanto a las formas de transmisión del HCV y que deberían
tomarse medidas que conduzcan a educar a la población sobre las
formas de contagio, así como también instruir a los dirigentes
de la salud y cuidadores sobre las formas de evitar la difusión
del virus, ya que otras vías como saliva, semen o contacto
familiar pueden ser responsables del contagio.
BIBLIOGRAFIA
- Suou T, Tanaka H, Miura K et al:
Age at infection of Hepatitis C Virus and risk of
hepatocellular carcinoma in cirrhosis. Digestion,1998, 59
(suppl 3) pag. 33 World Congress of Gastroenterology.
September 6- 11 Vienna, Austria
- Epidemiología e Historia
Natural del virus de la Hepatitis C. IX simposio Internacional
Trianual sobre Hepatitis Vírica y Enf Hepática. Abril 21-25
de 1996, Roma, Italia. Pag 1-6 Diamond GA. Lim. Assur. AM. J.
Cardiol. 1989; 63:99-100
- Rizzeto M, Weiland T.
Prevalencia e Incidencia de la Infección y Enfermedad por
VHC. Com. Europea de Salud Pública. Luxemburgo, 14 de febrero
de 1994, pag. 5-10
- Civeira Murillo MP. Marcadores
serológicos para el diagnóstico de la Infección por el
Virus de la Hepatitis C. Gastroenterología. Mayo 1993, Vol.
16; Nº 5: 336-338
- Owucki, M.J., and Balistriri,
W., The hepatitis C Virus: Identification, Epidemiology and
Clinical Controversies Journal of Pediatric Gatroenterology
and Nutrition. Vol 20: 254-256. 1995
- Barrera JM, Bruguera M,
Guadalupe Ercilla M, et al: Persistent Hepatitis C Viremia
After Acute seolf-Limiting Post-Transfusion Hepatitis C.
Hepatology, Mar 95: 269-644
- Van der Poel LI. VHC y Hepatitis
Post-transfucional: Diagnóstico del VHC en Receptores y
Donantes de sangre. Gastroenterol. Y Hepatol. Mayo 1993, Vol
16: 332-335
- Enfermedades del Aparato
Digestivo: Hepatitis Vírica. Medicine Nº 5, julio 1997:
185-187
- Castro A, Pereiro C, Pedreira
JD. et al: Prevalencia de los Virus de Hepatitis y Significación
Clínica de la Infección por VHC en Usuarios de drogas por Vía
Parenteral. Gastroenterol. Y Hepatol. Mayo 1993, Vol. 16; Nº
5: 287-291
- Olaso V, Córdoba J, Verdú RC.
ARN-VHC en la saliva de pacientes con Hepatitis Crónica C.
Gastroenterol. Y Hepatol. Mayo 1993. Vol 16; Nº 5: 303-308
- Declaración de Concenso Latino
Americano de Hepatitis C. Bs.As. Argentina 17 de septiembre de
1996.
- Vilar, JH, Rivera, MA, Rodríguez,
A., Valenti, SM, Martinez, R.T. Lanari- Zubiaur, FJB.
Determinación de Anti-HC en familiares de portadores , como
pesquisa de Nuevos Casos. Acta Gastroenterológica
Latinoamericana Vol. 5 Nov. 2000:497.500
Trabajos Distinguidos, Serie Infectología, integra
el Programa SIIC
de Educación Médica Continuada.

[Bienvenidos
a siicsalud]
[Acerca de SIIC] [Estructura de SIIC] [Círculo SIIC de Lectores]
[Salud(i)Ciencia]
[Trabajos Distinguidos]
Sociedad Iberoamericana de Información
Científica (SIIC)
Av. Belgrano 430, (C1092AAR), Buenos Aires, Argentina
Correo electrónico (e-mail): atencionallector@siicsalud.com;
Tels: +54 11 4342-4901; Fax:+54 11 4331-3305.
Correo SIIC: Casilla de Correo 2568, (C1000WAZ) Correo Central, Buenos Aires.
Copyright siicsalud© 1997-2003, Sociedad Iberoamericana de Información Científica
(SIIC)
|


