Introducción
Hace ya más de un siglo Escherich describió una bacteria aislada de heces de
individuos sanos y la denominó Bacterium coli comune.
Este microorganismo anaerobio facultativo, conocido actualmente como
Escherichia coli es un habitante normal del intestino grueso de los
mamíferos, donde juega un papel importante en su fisiología; la mayoría de las
cepas de E. coli son inofensivas y además pueden ejercer un efecto
protectivo por impedir la proliferación de otras más virulentas. Pero la minoría de
E. coli que causan enfermedad son un excelente ejemplo del modo por el
cual mínimas variaciones en la estructura genética pueden permitir a las bacterias
causar diferentes enfermedades como meningitis, septicemia, pielonefritis y
diarrea. Recién en 1945 Bray pudo comprobar que E. coli puede ser
diarreigénico en humanos, especialmente en niños. Las cepas de E. coli
diarreigénicas constituyen un grupo heterogéneo de microorganismos con
diferentes propiedades de virulencia y epidemiología.
Categorías diarreigénicas1
Escherichia coli enterotoxigénica (ETEC) se adhiere al intestino
delgado mediante fimbrias y elabora dos tipos de enterotoxinas: termolábil (LT) y
termoestable (ST). Escherichia coli enteroinvasiva (EIEC) invade el
enterocito y produce una diarrea similar a la producida por Shigella. Escherichia
coli enteropatogénica (EPEC) produce la lesión A/E (attaching and
effacing) con destrucción de las microvellosidades. Escherichia coli
enterohemorrágica (EHEC) posee fimbrias de adherencia y elabora potentes
citotoxinas SLT (shiga-like-toxins) que se relacionan con el síndrome
urémico-hemolítico (SUH). Escherichia coli enteroagregativa (EAEC)
también posee fimbrias de adherencia y elabora dos enterotoxinas. Escherichia
coli con adherencia difusa (DAEC) posee una fimbria mediadora de este tipo de
adherencia, pero aún no existen estudios epidemiológicos concluyentes con
respecto a su capacidad diarreigénica.2
Factores de patogenicidad1
Como la mayoría de los patógenos, E. coli sigue una estrategia de
infección: 1) colonización de un sitio en la mucosa, 2) evasión de las defensas del
huésped, 3) multiplicación, 4) daño al huésped.
El hecho más destacable de las cepas de E. coli diarreigénicas es su
habilidad para colonizar la superficie de la mucosa intestinal, a pesar de los
movimientos peristálticos y de la competencia de los integrantes de la microbiota
normal, incluyendo cepas de E. coli no patógenas.
La presencia de fimbrias de adherencia es una propiedad de todas las cepas de
E. coli, incluidas las no patógenas. Sin embargo, las cepas diarreigénicas
poseen antígenos fimbriales específicos que incrementan su habilidad colonizadora
y permiten su adherencia al intestino delgado, sitio que normalmente no es
colonizado.
Una vez que ha colonizado el intestino, sigue diferentes estrategias de patogénesis,
según su tipo o categoría, a saber:
- producción de enterotoxinas (ETEC y EAEC),
- invasión (EIEC) y/o
- adherencia íntima con señales o eventos de membrana (EPEC y EHEC).
Cabe aclarar que el modo de interacción es específico para cada categoría.
La versatilidad en el genoma de E. coli, que le confiere las diferentes
propiedades de virulencia, se fundamenta principalmente en dos configuraciones
genéticas: plásmidos de virulencia e islas cromosomales de patogenicidad. Las seis
categorías de E. coli diarreigénicas descritas son portadoras de al menos
un plásmido de virulencia. Por una parte, EIEC, EHEC, EPEC y EAEC son portadoras
de familias de plásmidos, cada uno de los cuales codifica para múltiples factores de
virulencia. Asimismo, EPEC, EHEC y EAEC poseen además genes cromosomales
organizados como un grupo denominado "isla de patogenicidad".
Los rasgos de patogenicidad individuales, como la producción de toxinas, pueden
ser codificados por transposones (toxina ST de ETEC) o por fagos (toxina
Shiga).3,4,5
Escherichia coli enteroagregativa (EAEC)
La observación de la adherencia de EPEC a células HEp-2, realizada por
Cravioto y col. en 1979, fue crucial no sólo en el campo de la investigación de
EPEC, sino que permitió, además, establecer dos categorías más de E. coli
patogénicas. El patrón de adherencia de EPEC fue descrito como "adherencia
localizada", denotando la presencia de microcolonias en la superficie de las células
en cultivo. Las bacterias no EPEC adherían de una manera diferente que fue
definida inicialmente como "difusa". Sin embargo, en un estudio realizado por
Nataro, en Chile en 1987, se subdividió el fenotipo difuso en dos categorías:
agregativas y difusas "verdaderas". Las agregativas se distinguen por la
autoaglutinación de las bacterias y por su adhesión, además, a la superficie de
vidrio del cubreobjetos. El patrón se define como stacked-brick (pilas de
ladrillos). Mientras que en la adherencia difusa las bacterias se observan dispersas
sobre la superficie de las células HEp-2 con poca agregación y poca adherencia al
vidrio entre las células.
A fines de la década del '80 y comienzos de los '90, la relación inconsistente entre
EAEC y diarrea condujo a dudar acerca de su papel como patógeno humano, de
manera similar a lo ocurrido con EPEC en los '70.6
Si bien la patogenicidad de ETEC y EIEC pudo atribuirse a marcadores específicos y
demostrarse en modelos animales, la evidencia de la patogenicidad de EPEC fue
sólo epidemiológica hasta 1978, cuando dos cepas de EPEC demostraron su
patogenicidad en adultos voluntarios. Y así como con EPEC, en los primeros
aislamientos de EAEC no se pudo demostrar la presencia de ningún factor de
virulencia conocido como diarreigénico. La observación de que estas cepas a
menudo eran recuperadas de individuos aparentemente sanos condujo a un
escepticismo sobre la patogenicidad de EAEC, hasta que dos estudios con
voluntarios y un número de brotes de diarrea probaron que al menos algunas cepas
de EAEC causaban diarrea en humanos. Además, estudios de casos y controles y de
vigilancia en los últimos quince años sugieren fuertemente que EAEC constituye una
causa importante de diarrea en personas de todas las edades en países
industrializados y en vías de desarrollo.7,8
Patogénesis
Las cepas EAEC producen aumento en la secreción de mucus con
atrapamiento de las bacterias formando una biopelícula de mucus y bacterias. Se
demostró a través de diversos experimentos que esta película se produce in
vivo, y también se observó que la diarrea por EAEC es predominantemente
mucosa, aunque no se ha dilucidado completamente el significado de esta
característica. Además de esta propiedad, se ha observado que la infección por
EAEC está acompañada por efectos citotóxicos en la mucosa intestinal. Vial y col.,
en 1988, observaron la lesión producida por EAEC a través de microscopia óptica.
La lesión se caracteriza por acortamiento de las microvellosidades, necrosis
hemorrágica de los extremos de la vellosidad y respuesta inflamatoria leve con
edema e infiltración mononuclear de la submucosa. En biopsias de pacientes
fallecidos por diarrea persistente causada por EAEC se evidenció la destrucción de
la mucosa ileal. Los efectos citotóxicos se demostraron por cultivo en células T84,
en las cuales la citotoxicidad causada por EAEC se manifiesta por vesiculización de
la membrana, seguida de muerte celular y exfoliación de las células de la
monocapa. Además, este efecto se acompaña de incremento en la formación de
vacuolas y separación del núcleo del citoplasma circundante. Estos efectos
citotóxicos requieren la presencia de genes codificados en un plásmido de 65 mDa,
que contiene además los genes que codifican la adherencia. Sin embargo, no todas
las EAEC producen efectos citotóxicos sobre la mucosa, lo cual indica la elevada
heterogeneidad que presentan estas cepas, y conduce a resultados inconsistentes
entre su presencia y diarrea, como demuestran algunos estudios
epidemiológicos.9,10,11
Adherencia
Nataro y col. identificaron en 1992 una estructura fimbrial flexible de 2 a 3 nm
de diámetro, denominada fimbria de adherencia agregativa I (AAF/I). La adherencia
a células HEp-2 producida por la cepa 17-2 está mediada por esta fimbria. Los
genes que codifican para la fimbria están organizados en dos grupos, separados por
9 Kb, dentro del plásmido pAA. La región 1 contiene un grupo de genes requeridos
para la síntesis y el ensamblaje de la proteína, incluida la subunidad estructural de
la fimbria misma. La región 2 contiene un gen activador de la transcripción,
denominado aggR.
Más recientemente se identificó una fimbria que presenta una homología del 25%
con la primera y fue denominada AAF/II, cuya cepa prototipo es la 042, aislada en
Perú.
No existen datos concluyentes sobre la frecuencia de aparición de una u otra. Las
fimbrias AAF son necesarias para la adherencia a células epiteliales y para la
formación de la biopelícula. Una proporción considerable de EAEC presenta este
fenotipo pero no expresa ninguna de las fimbrias citadas, lo que indica que podrían
existir otras adhesinas de naturaleza no fimbrial, lo que aún no se
demostró.12,13
EAST1
Es una proteína de 38 residuos de aminoácidos, homóloga a ST (toxina
termoestable de ETEC), sólo que en lugar de 6 residuos de cisteína, EAST1 presenta
4.14,15 También presenta homología con un péptido de la
membrana de las células eucariotas, denominado guanilina, y se observó que
produce aumento en la diferencia de potencial y corriente de cortocircuito a través
de tejido ileal de conejo montado en using chambers. Se ha visto que el
gen astA que codifica para esta proteína, está presente en el 40% de las
cepas EAEC, pero también se lo ha encontrado, aun con mayor frecuencia, en cepas
EHEC y también asociado a E. coli no patógenas. En un estudio reciente
realizado en Japón, cepas de E. coli que presentaron EAST1 como única
característica diarreigénica, fueron incluidas como posibles
patógenos.16
Otras citotoxinas
Los efectos tóxicos observados en modelos animales, en explantos de células
intestinales y en células T84 no son acompañados por internalización de la bacteria
o por adherencia íntima.1 Diversos grupos informaron la
identificación de citotoxinas secretadas por EAEC. Es el caso de Pet, una
serinproteasa originalmente identificada como una proteína secretada capaz de
reducir la resistencia e incrementar la corriente de cortocircuito a través de tejido
yeyunal de rata montado en using chambers. Además de su actividad
enterotóxica, Pet tiene efectos citotóxicos en células epiteliales en cultivo y sobre
eritrocitos por un mecanismo que probablemente involucra la degradación de la
proteína de membrana espectrina.17,18
Modelo propuesto para el mecanismo patogénico de EAEC
Hasta el presente, con los datos disponibles, se puede formular sólo una
hipótesis del mecanismo: Nataro propone un modelo en tres etapas basado en
ensayos in vitro y con animales.
La primera etapa involucra la adherencia inicial a la mucosa intestinal o a la capa de
mucus o a ambas. Tanto AAF/I como AAF/II parecen ser las mediadoras de esta
primera etapa. En la segunda etapa se produciría un incremento en la producción
de mucus, que conduciría a la formación de una biopelícula espesa conteniendo
bacterias. Esta biopelícula podría facilitar la colonización persistente y contribuir a la
mala absorción de nutrientes. La tercera etapa, sugerida por evidencias
histopatológicas y moleculares, incluiría la elaboración de citotoxinas que podría
resultar en daño de las células intestinales. Con respecto al sitio de colonización, los
datos no son concluyentes, pero las evidencias señalan como más probable la
colonización del intestino delgado.19,20
Epidemiología
Un número creciente de publicaciones sostienen la asociación entre diarrea y
EAEC en los países en vías de desarrollo, con mayor prominencia en diarreas
persistentes (14 días o más).
Parece haber una asociación geográfica entre EAEC y diarrea. En la India, por
ejemplo, se publicaron diferentes trabajos en los cuales EAEC fue hallado en
diarreas persistentes, pacientes ambulatorios e internados y casos esporádicos
detectados durante estudios de vigilancia. También existen estudios realizados en
Brasil, en los cuales EAEC se asoció con diarreas persistentes en un elevado
porcentaje de casos. EAEC también ha sido implicada como agente causal en casos
esporádicos en México, Chile, Bangladesh e Irán.
Si bien la mayoría de los trabajos implican a EAEC en casos esporádicos endémicos
de diarrea, cada vez se informa un mayor número de brotes en los cuales este
patógeno está involucrado.21 Un ejemplo es el trabajo de
Eslava22 que describe dos brotes de diarrea ocurridos en el servicio
de nutrición de un hospital de la ciudad de México. Smith y col. informaron cuatro
brotes en Gran Bretaña en 1994, que involucraron 19, 10, 51 y 53 pacientes. Los
síntomas en estos pacientes fueron vómitos y diarrea, habitualmente sin fiebre. Si
bien cada uno de estos brotes estuvo relacionado con el consumo de comida en un
restaurante, no se pudo identificar un origen único.
Detección y diagnóstico
La infección por EAEC se diagnostica mediante el aislamiento de E. coli
de las heces del paciente y la demostración del patrón agregativo en células
HEp-2. Esta prueba es el gold standard. Si bien se describieron diferentes
variantes de esta técnica, varios estudios comparativos sugieren que la forma
original de incubación de las bacterias con las células durante 3 horas, sin cambio
de medio, es la que mejor permite discriminar entre los tres patrones, difuso,
agregativo y localizado.
Se demostró que el plásmido de 60 mDa presente en la mayoría de EAEC tiene un
alto grado de homología entre las diferentes cepas. A partir de él se desarrolló una
sonda de 1 Kb que, en general, presenta elevada especificidad.23,24
Se diseñaron primers para detectar diferentes regiones del plásmido de 60
mDa. Estos primers pueden estar dirigidos a las regiones estructurales o
de regulación de la expresión de las fimbrias o a la identificación de los genes
codificadores de toxinas.
Los laboratorios de bacteriología clínica no disponen, habitualmente, de un
laboratorio de cultivo de células para poder arribar al diagnóstico preciso de EAEC.
En nuestro medio, el esquema de diagnóstico no permite discriminar entre EPEC y
EAEC, ya que la clasificación se realiza sobre la base de pruebas serológicas. En las
figuras 1 y 2 se observa la distribución de frecuencias de patógenos aislados en el
Hospital Materno Infantil Dr. Humberto Notti durante 1995 y 1996. Se observa que,
en general, EPEC se aísla en segundo lugar entre los patógenos bacterianos, con
una frecuencia de alrededor de 20%.
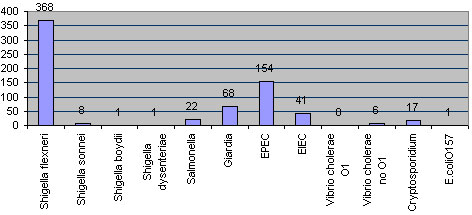
Figura 1. Distribución de frecuencias de patógenos aislados durante 1995 en el laboratorio de
Bacteriología del Hospital Materno Infantil Dr. Humberto Notti de la provincia de Mendoza, Argentina.
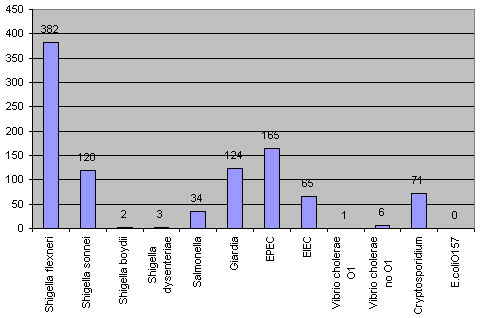
Figura 2. Distribución de frecuencias de patógenos aislados durante 1996 en el laboratorio de
Bacteriología del Hospital Materno Infantil Dr. Humberto Notti de la provincia de Mendoza, Argentina.
El interés por arribar a un diagnóstico certero que permitiera evaluar la importancia
de EPEC no sólo en cuanto a su frecuencia, sino a las características de las cepas
circulantes en nuestro medio condujo a la realización de un primer
trabajo,25 en el que se utilizaron ensayos de adherencia en células
para distinguir entre los patrones localizado, difuso y agregativo, relacionados con
diferentes categorías diarreigénicas, como se aclaró anteriormente. El fenotipo de
adherencia localizada fue encontrado en 15% de las cepas y el agregativo en 21%.
Estos resultados señalaron que entre las cepas clasificadas como EPEC sobre la
base de la serología existía otra clase de cepas, con factores de patogenicidad
específicos, diferentes de EPEC.
A partir de estos resultados se propuso un segundo trabajo, orientado a proponer
una metodología alternativa, que se utilice como prueba de tamizaje y que permita
restringir el cultivo de células para la confirmación del resultado.
Este estudio estuvo orientado a evaluar la utilidad de PCR como herramienta para
el diagnóstico de EAEC, comparando los resultados con los obtenidos a través de la
prueba de referencia.
Materiales y método
Se estudiaron 87 cepas de Escherichia coli aisladas durante 1995 y
1996, identificadas por pruebas bioquímicas y serología, correspondiendo cada cepa
a un caso de diarrea. La población estudiada corrrespondió a niños menores de 2
años con diarrea aguda, atendidos en el Hospital Materno Infantil Dr. Humberto
Notti de la provincia de Mendoza.
Las muestras fueron obtenidas por evacuación espontánea, recogidas en recipientes
estériles y procesadas dentro de las 2 horas. Se realizaron extendidos para examen
microscópico directo de materia fecal con tinción de Gram, tinción de azul de
metileno (observación de leucocitos) y examen en fresco para la detección de
Entamoeba histolytica y Giardia lamblia; para la investigación de
Cryptosporidium se realizó tinción de Ziehl-Neelsen modificada.
Una dilución adecuada de materia fecal se destinó a la siembra en placas de Petri
con agar Mac Conkey. De cada placa se tomaron 3 colonias fermentadoras de
lactosa y se les realizaron las pruebas bioquímicas de rutina.
En cada colonia tipificada bioquímicamente como Escherichia coli se
investigaron los antígenos somáticos "O", por la técnica de aglutinación en
portaobjetos, utilizando sueros monovalentes provistos por el Instituto Malbrán. Los
serogrupos investigados fueron los siguientes: O26, O44, O55, O86, O111, O114,
O119, O125, O126, O127, O128, O136, O142. La investigación de factores de
patogenicidad por PCR y ensayo de adherencia en células se realizó en las cepas
que fueron positivas para alguno de los serogrupos mencionados.
Ensayo de adherencia en células HEp-2
Se utilizaron células HEp-2 (ATCC: American Type Culture Collection),
adquiridas en la Asociación Banco Argentino de Células (ABAC). Las células se
cultivaron en Minimum Essential Medium (MEM) con sales de Earle (Sigma Co.),
suplementado con 10% de suero fetal bovino (Gen) sin antibióticos, en estufa a
37ºC y 5% de CO2. Se adaptó el método descrito por Cravioto y col.
en 1979. Los frascos de cultivo con monocapas de células fueron tripsinizados para
desprender las células, que se resuspendieron en MEM con suero fetal bovino 2%.
Se realizó recuento celular en cámara de Neubauer y luego 2.5x104
células se sembraron sobre cubreobjetos de vidrio dentro de placas de Petri de
vidrio de 50 mm y se incubaron hasta que alcanzaron el 70% de confluencia (24
hs.). Se retiró el MEM y se remplazó por medio fresco con 0.5% de D-manosa. Se
inocularon las placas con 20 μl de caldos de cultivos bacterianos, durante 3
horas a 37°C, se retiró el caldo, se lavó tres veces con PBS, se fijó con metanol y
se coloreó con Giemsa al 7.5%. Las cepas de referencia utilizadas en cada ensayo
fueron: 2348/69: patrón de adherencia localizada; AA17-2: patrón agregativo;
RS51-1: patrón difuso, HS (O9:H4): patrón negativo. Los ensayos se realizaron por
duplicado. Los cubreobjetos se montaron sobre portaobjetos y se observaron con
aumento 1 000x.
Amplificación de un fragmento de la fimbria AAF/I
Esta región forma parte del plásmido pCVD432 que está relacionado con el
patrón de adherencia agregativa en el ensayo en células HEp-2. Se utilizó el
siguiente set de primers:
pCVD432/start (5' CTG GCG AAA GAC TGT ATC AT 3') y pCVD432/stop (5' CAA
TGT ATA GAA ATC CGC TGT T 3'). El tamaño del fragmento amplificado es de 630
bp.26
A continuación se transcribe la región amplificada y la ubicación de los primers
en su interior:

Condiciones de la reacción
Mezcla de nucleótidos trifosfato (dNTP): 0.2 mM; MgCl2: 1.5
mM; cebadores: 0.5 μM de cada uno; Taq polimerasa: 2 unidades; buffer 10x
(usar 1X). Volumen final: 50 μl.
Esquema de ciclado
1 paso de 5 min a 94ºC
30 ciclos de 40 s a 94ºC
30 ciclos de 1 min a 53ºC
30 ciclos de 1 min a 72ºC
1 paso de 3 min a 72ºC
Control positivo: cepa AA 17-3
Control negativo: cepa HS
Amplificación de un fragmento del gen de la enterotoxina EAST1
(Enteroaggregative Heat Stable Enterotoxin I)
Los cebadores fueron diseñados para amplificar una región de 108 pares de
bases (bp) del gen astA-1, que codifica para la enterotoxina EAST1 de
EAEC.
Estos fueron diseñados en el Institut für Hygiene und Mikrobiologie de la
Universidad de Würzburg, Alemania (datos no publicados).
START 5´ GCC ATC ACA GTA TAT CCG 3´
STOP 5´ GCG AGT GAC GGC TTT GTA GT 3´
A continuación se reproduce parte de la secuencia del gen obtenida del Genbank N°
de acceso L11241

Condiciones de la reacción
Mezcla de nucleótidos trifosfato (dNTP): 0.2 mM; MgCl2:
1.5mM; cebadores: 0.6 μM de cada uno; Taq polimerasa: 2 unidades; buffer
10x (usar 1X).
Esquema de ciclado
1 paso de 5 min a 94ºC
30 ciclos de 40 s a 94ºC
30 ciclos de 1 min a 65ºC
30 ciclos de 1 min a 72ºC
1 paso de 3 min a 72ºC
Control positivo: cepa AA 17-3
Control negativo: cepa HS
Preparación del templado
Se incubó 1 ml de un caldo de cultivo bacteriano en TSB (tripticasa soya
broth) durante 18 horas. Se centrifugó y el sedimento fue tratado con 150
μl de Tritón 1% y hervido durante 10 minutos a 100ºC y centrifugado 5
minutos a 10 000 rpm. Para la reacción de PCR se emplearon 10 μl de
templado.
Análisis con enzimas de restricción
El análisis con enzimas de restricción constituye una metodología para
comprobar que el fragmento amplificado presenta la secuencia específica. Después
de la reacción de PCR se llevó a cabo la digestión con AluI que corta el
producto de PCR de los primers de AAF/I en dos fragmentos de 391 y 239
bp26 y con HhaI que corta el producto de PCR de astA-
1 en dos fragmentos de 71 y 37 bp.27 En la figura 3
se observa la fotografìa que muestra los productos de PCR.

Figura 3. Productos de PCR de los primers pCVD 432 y astA y análisis con enzimas de
restricción. M: Marcador de peso molecular 100 bp. 1: Producto de amplificación de 630 bp
de pCVD432. 2,3: Producto de digestión del amplificado de pCVD432, de 391 bp y 239 bp
obtenido con la enzima de restricción Alu I. 4: Control negativo. 5: Producto de
amplificación de 108 bp de astA. 6,7: Producto de digestión del amplificado de astA,
de 71 bp y 37 bp obtenido con la enzima de restricción Hha I.
Resultados
Como se observa en la figura 4, según el ensayo de adherencia en células
HEp-2, 22 cepas (25%) mostraron el patrón de adherencia localizada; 18 cepas
(21%) presentaron adherencia agregativa; 10 (11%) evidenciaron el patrón difuso.
Estos resultados fueron similares a los hallados en un trabajo
anterior.25 En las figuras 5, 6 y 7 se observan las fotografìas
correspondientes a los patrones de adherencia.

Figura 4. Distribución de los patrones de adherencia en células HEp-2. La figura muestra el porcentaje
observado para cada patrón, sobre un total de 87 cepas.

Figura 5. Patrón de adherencia localizada (1 000x) Las flechas señalan los acúmulos de bacterias
típicos.
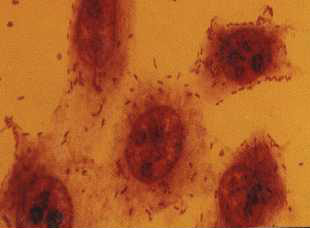
Figura 6. Patrón de adherencia difusa (1 000x). Se observa la distribución de las bacterias sobre la
superficie de las células, con escasa o nula adhesión sobre el cubreobjeto.
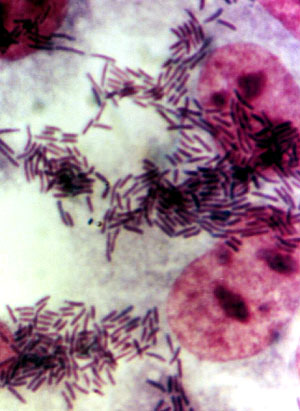
Figura 7. Patrón de adherencia agregativa (1 000x). Las bacterias forman acúmulos entre sí, sobre las
células y sobre la superficie del cubreobjeto.
La tabla 1 muestra los resultados de PCR para AAF/I y de adherencia agregativa en
el ensayo en células HEp-2. Ocho cepas de las 18 que presentaron el patrón de
adherencia agregativa portaron el gen de AAF/I. Las 10 cepas que presentaron
adherencia agregativa pero fueron negativas para AAF/I estarían indicando que
otros factores, fimbriales o no, podrían estar involucrados en la adherencia. Cinco
cepas positivas para AAF/I no presentaron el fenotipo agregativo, lo que señala la
posibilidad de existencia de otras condiciones para la expresión de la fimbria de
adherencia.

Tabla 1. Comparación de los resultados de PCR para AAF/I PCR y del patrón de adherencia agregativa
en el ensayo en células HEp-2.
La tabla 2 compara el resultado de EAST1 PCR y el ensayo en HEp-2. Mientras que
25 cepas portaron el gen de EAST1, sólo 13 de éstas expresaron el patrón de
adherencia agregativa en el ensayo en HEp-2, lo cual parece estar en relación con
el hecho de que la presencia del gen de EAST1 fue encontrado en otras categorías
de E. coli diarreigénicas como EPEC y EHEC. Cinco cepas que presentaron
el fenotipo agregativo en el ensayo en HEp -2 fueron negativas para EAST1.

Tabla 2. Comparación de los resultados de PCR para EAST 1 PCR y del patrón de adherencia
agregativa en el ensayo en células HEp-2.
La tabla 3 compara la presencia de uno o ambos genes con el ensayo en HEp-2.
Treinta y dos cepas portan los genes, elevando considerablemente la sensibilidad
de la reacción de PCR. El fenotipo agregativo se observó en 17 de las 32 muestras
portadoras de los genes; en general las cepas EAST1 positivas fueron las que
carecían de dicho fenotipo.
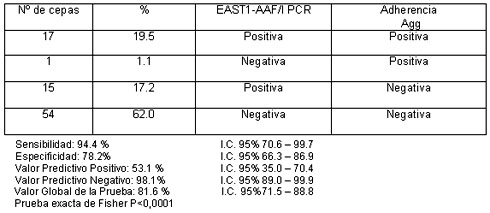
Tabla 3. Comparación de los resultados de PCR para AAF/I/EAST 1 PCR y del patrón de adherencia
agregativa en el ensayo en células HEp-2.
Discusión
Escherichia coli diarreigénica (DEC) representa un blanco elusivo a la
hora del diagnóstico debido a que no resulta fácilmente distinguible de las cepas
que no portan factores de virulencia y que son habitantes normales del intestino
humano y de los animales.
En el primer trabajo realizado por nuestro grupo,25 se detectó 21%
de cepas EAEC, clasificadas sobre la base de su patrón de adherencia. Esto
despertó un interés especial por investigar la distribución y relación epidemiológica
de estas cepas en nuestra comunidad. Con el propósito de desarrollar una
metodología rápida, sensible y específica que permitiera el estudio de un número
considerable de cepas, se desarrollaron dos tipos de PCR, aplicables al diagnóstico
de EAEC. Se utilizaron primers descritos y probados por otros autores,
para identificar AAF/I y EAST1.27
Una de las desventajas de PCR como método de diagnóstico lo constituye el hecho
de que la observación de la banda del producto de amplificación otorga información
sobre el tamaño de una molécula de ADN, pero no sobre su secuencia. Por ello es
que si se utiliza esta reacción como método de diagnóstico único, debería
acompañarse de un sistema que permita corroborar que el amplificado corresponde
a la secuencia esperada. Existen diferentes metodologías disponibles; una de ellas
es la de buscar un sitio de corte para alguna enzima de restricción dentro del sector
amplificado que permita distinguir dos fragmentos de tamaño conocido. Para el
caso de la PCR para AAF/I, los autores describieron un sitio de corte para la enzima
AluI, que fragmentaba el amplificado de 639 bp en dos partes de 391 bp y
239 bp. Para el amplificado del gen astA, para el cual no se había descrito
ningún sistema de confirmación, se realizó una búsqueda con el programa PCgene,
detectando un sitio diana para HhaI. Los resultados de las digestiones
enzimáticas se muestran en la figura 3.
Para poder establecer la utilidad de PCR en el diagnóstico de EAEC se compararon
los resultados con los obtenidos por la prueba de referencia (ensayo de adherencia
en células HEp-2). En la figura 4 se observa la distribución de los patrones de
adherencia. El patrón agregativo apareció, al igual que en el primer trabajo de
Ortiz,25 en 21% de las cepas. Si se refieren estos resultados a los
datos sobre los diferentes patógenos aislados de coprocultivos en el Hospital Notti,
presentados en la Introducción, se observa que durante 1995 y 1996, período
durante el cual se realizó este trabajo, el porcentaje de EPEC fue del 20% en
promedio. De las 87 cepas estudiadas, 20% correspondieron a la categoría EAEC
clasificada sobre la base de la prueba de adherencia. Si se proyecta este dato al
total de patógenos aislados durante los dos años de estudio, EAEC tendría una
prevalencia similar a la de Salmonella, que es aproximadamente del 3%,
lo cual permite postular la importancia de caracterizar las cepas de E. coli
por sus factores de patogenicidad, lo que a su vez podría tener impacto
considerable en el conocimiento de la etiología de los casos esporádicos de
diarrea.
En la tabla 1 se comparan los resultados entre PCR para AAF/I y el patrón
agregativo, obteniéndose una sensibilidad del 44%. Se observa que 8 de las 18
cepas que presentaron el fenotipo agregativo eran portadoras de la fimbria I; las 10
cepas que presentaron adherencia agregativa pero fueron negativas para AAF/I, lo
que parece indicar que otros factores, fimbriales o no, podrían estar involucrados
en la adherencia. Cinco cepas, de las 13 que fueron positivas para AAF/I
presentaron un patrón diferente al agregativo. Estos resultados podrían explicarse,
por un lado, por la subjetividad del ensayo de adherencia en células, y por otro, por
el requerimiento de otros factores, además de la presencia del gen estructural de la
fimbria, para que se produzca la adherencia.
En la tabla 2 se muestra la comparación entre PCR para astA (proteína
EAST1) y el patrón agregativo. Quince por ciento de las cepas resultaron portadoras
del gen astA y presentaron el patrón agregativo, mientras que 6%
presentaron el patrón agregativo pero no el gen astA. La prueba resultó
con una sensibilidad del 72%, considerablemente mayor que la demostrada por
AAF/I, reduciéndose la especificidad del 92.7% al 82.61%.
Se observa, además, que 13.7% de las cepas estudiadas fueron positivas para
astA y no presentaron adherencia agregativa. Existen evidencias, descritas
por diferentes autores, de que el gen astA tendría una distribución amplia
entre las cepas de E. coli diarreigénicas, no encontrándose restringido sólo
a EAEC. De hecho, fue hallado en DAEC y EPEC,28 en
ETEC20 y en EHEC,29-31 razón por la cual fue
incluido como posible Escherichia coli diarreigénica
(DEC).32
Para el diseño de la tabla 3 se utilizó como criterio considerar positivas las cepas
portadoras de AAF/I, de astA, o de ambos (prueba en paralelo). De este
modo se observa que el porcentaje de cepas clasificadas como positivas por ambas
pruebas es de 19.5%, bastante cercano al valor observado para el patrón de
adherencia agregativa en la figura 4. La sensibilidad de la prueba fue 94.4% y la
especificidad 78.2%. El valor global, es decir la posibilidad de que la cepa sea
clasificada correctamente por la prueba, es de 81.6%.
Estos datos sugieren que la detección de ambos genes es la que otorga mayor
utilidad a la prueba, por lo que se postula su empleo como método de tamizaje,
limitando el empleo del ensayo de adherencia, más costoso y laborioso, a aquellas
cepas portadoras de los genes.27
Conclusión
La implementación de técnicas que detectan factores de patogenicidad
específicos permitió identificar EAEC en los coprocultivos de la población infantil
estudiada, pone en evidencia la heterogeneidad que presentan las cepas
pertenecientes a esta categoría de E. coli diarreigénicas y demuestra la
necesidad de métodos de diagnóstico complementarios a los que rutinariamente se
utilizan en los laboratorios bacteriológicos. La prevalencia estimada para EAEC fue
de 3%; si la búsqueda se ampliara, realizándose en forma independiente del
serogrupo, este porcentaje podría ser mayor. Teniendo en cuenta la importancia de
EAEC como patógeno emergente se sugiere la implementación del diagnóstico
diferencial por PCR y su posterior confirmación por el método de referencia.
Los autores no manifiestan conflictos.
BIBLIOGRAFÍA
-
Nataro JP and Kaper JB. Diarrheagenic Escherichia coli. Clin.
Microbiol.Rev. 1998. 11: 142-201.
-
Gomes TA, Vieria MA, Abe CM y col. Adherence patterns and adherence-related
DNA sequences in Escherichia coli isolates from children with and without
diarrhea in Sao Paulo city, Brazil. J. Clin. Microbiol. 1998. 36: 3609-13.
-
Gilligan PH. Escherichia coli EAEC, EHEC; EIEC, ETEC. Clin. Lab.
Med.1999. 19(3):505-21.
-
Gioppo NM, Elías WP Jr, Vidotto MC y col. Prevalence of HEp-2 cell adherent
Escherichia coli and characterisation of enteroaggregative E. coli
and chain-like adherent E. coli isolated from children with and without
diarrhoea, in Londrina, Brazil. 2000. FEMS Microbiol Lett 190:293-8.
-
Levine MM, Bergquist EJ, Nalin DR y col. Escherichia coli strains that
cause diarrhoea but do not produce heat-labile or heat-stable enterotoxins and are
non-invasive. Lancet 1978. i:1119–1122.
-
Vial PA, Robins Browne R, Lior H y col. Characterization of enteroadherent-
aggregative Escherichia coli, a putative agent of diarrheal disease. J.
Infect. Dis.1988. 158:70–79.
-
Okeke IN y Nataro JP. Enteroaggregative Escherichia coli. The Lancet
Inf. Dis. 2001. 1: 304-13.
-
Rich Ch, Favre-Bonte S, Sapena F y col. Characterization of Enteroaggregative
Escherichia coli Isolates. FEMS Microbiol. Lett.1999. 173:55-61.
-
Hicks S, Candy DCA y Phillips AD. Adhesion of Enteroaggregative
Escherichia coli to pediatric intestinal mucosa In Vitro. Am. Soc.
Microb.1996. 64:4751-4760.
-
Knutton S, Shaw RK, Bhan MK y col. Ability of enteroaggregative
Escherichia coli strains to adhere in vitro to human intestinal
mucosa.Infect. Immun. 1992. 60:2083–2091.
-
Nataro JP, Steiner T y Guerrant RL. Enteroaggregative Escherichia coli.
Em. Infect. Dis. 1998. 4:251-261.
-
Czeczulin JR, Balepur S, Hicks S y col. Aggregative Adherence Fimbria II, a
second fimbrial antigen mediating aggregative adherence in Enteroaggregative
Escherichia coli. Am.Soc.Microb.1991. 65: 4135-4145.
-
Czeczulin JR, Whittam TS, Henderson IR y col. Phylogenetic analysis of EAEC
and diffusely adherent Escherichia coli. Infect. Immun. 1999. 67(6):2692-
9.
-
Savarino SJ, Fasano A, Robertson DC y col. Enteroaggregative Escherichia
coli elaborate a Heat-Stable Enterotoxin demonstrable in an In Vitro rabbit
intestinal model. J. Clin. Invest.1991. 87:1450–1455.
-
Savarino SJ, Fasano A, Watson J y col. Enteroaggregative Escherichia
coli Heat-Stable Enterotoxin 1 represents another subfamily of E. coli
Heat-Stable toxin. Proc. Natl. Acad. Sci. USA.1993. 90:3093–3097.
-
Zhou Z, Ogasawara J, Nishikawa Y y col. An outbreak of gastroenteritis in
Osaka, Japan due to Escherichia coli serogroup O166:H15 that had a
coding gene for enteroaggregative E. coli Heat-Stable Enterotoxin 1
(EAST1). Epidemiol. Infect. 2002. 128(3):363-71.
-
Eslava C, Navarro-García F, Czeczulin JR y col. Pet, an autotransporter
enterotoxin from enteroaggregative Escherichia coli. Infect. Immun.1998.
66:3155-63.
-
Henderson IR, Hicks S, Navarro-García F y col. Involvement of the
enteroaggregative Escherichia coli plasmid-encoded toxin in intestinal
damage. Infect. Immun. 1999. 67 (10): 5338-44.
-
Benjamin P, Federman M y Wanke C A. Characterization of an invasive
phenotype associated with enteroaggregative Escherichia coli. Infect.
Immun.1995. 63:3417–3421.
-
Yamamoto T Echeverria P y Yokota T. Drug resistance and adherence to human
intestines of enteroaggregative Escherichia coli. J. Infect.Dis. 1992.
165:744–749.
-
Cobeljic M, Miljkovic-Selimovic B, Paunovic-Todosijevic D y col.
Enteroaggregative Escherichia coli associated with an outbreak of
diarrhoea in a neonatal nursery ward. 1996. Epidemiol. Infect. 117:11– 16.
-
Eslava C, Villaseca J, Morales R y col. Identification of a protein with toxigenic
activity produced by Enteroaggregative Escherichia coli, abstr. B-105, p.
44. In Abstracts of the 93rd General Meeting of the American Society for
Microbiology 1993. American Society for Microbiology, Washington, D.C.
-
Baudry B, Savarino SJ, Vial P y col. A sensitive and specific DNA probe to
identify enteroaggregative Escherichia coli, a recently discovered diarrheal
pathogen. J. Infect. Dis.1990. 161:1249–1251.
-
Debroy C, Bright BD, Wilson RA y col. Plasmid-coded DNA fragment developed
as a specific gene probe for the identification of enteroaggregative Escherichia
coli . J. Med. Microbiol.1994. 41: 393-8.
-
Ortiz A, Rüttler M, García B y col. Acumulación de actina y adherencia a células
HEp-2 de cepas de Escherichia coli aisladas de niños con diarrea en
Mendoza, Argentina. Rev. Arg. Microbiol. 1998. 30:13 -19.
-
Schmidt H, Knop C, Franke S y col. Development of PCR for screening of
enteroaggregative Escherichia coli. J. Clin. Microbiol. 1995. 33: 701-5.
-
Rüttler ME, Renna NF, Ortiz A y col. Characterization of enteroaggregative
Escherichia coli strains isolated from children with acute diarrhea, in
Mendoza, Argentina. Rev. Arg. Microbiol.2002. 34: 167-170.
-
Yamamoto T y Nakazawa. Comparison of the nucleotide sequence of
enteroaggregative E. coli heat-stable enterotoxin 1 genes among diarrhea
associated E. coli. FEMS Microbiol. Lett.1997. 147: 89-95
-
Yamamoto I, Taneike I. The sequences of enterohemorraghic Escherichia
coli and Yersinia pestis that are homologous to the enteroaggregative
Escherichia coli heat-stable enterotoxin gene: cross-species transfer in
evolution. FEBS Lett 2000. 472(1): 22-6.
-
Lai XH, Wang SY y Uhlin BE. Expression of cytotoxicity by potential pathogens
in the standard Escherichia coli Collection of Reference (ECOR) strains.
Microbiol.1999. 145:3295-3303.
-
Yatsuyanagi J, Saito S, Miyajima Y y col. Characterization of atypical
enteropathogenic Escherichia coli strains harboring the astA gene
that were associated with a waterborne outbreak of diarrhea in Japan.J.Clin.
Microbiol.2003. 41: 2033-9.
-
Nishikawa Y, Zhou Z, Hase A y col. Diarrheagenic Escherichia coli
isolated from stools of esporadic cases of diarrheal ilness in Osaka City, Japan
between 1997 and 2000: Prevalence of Enteroaggregative E. coli Heat-
Stable Enterotoxin 1 Gene-Possessing E. coli. Jpn. J. Infect. Dis. 2002.
55(6):183-90.
|


![]()

