 LINFOMAS CUTANEOS. LA
CONEXION ULCERACION-SEPSIS Y OTRAS CARACTERISTICAS LINFOMAS CUTANEOS. LA
CONEXION ULCERACION-SEPSIS Y OTRAS CARACTERISTICAS |
 |
Columnista
Experto de SIIC
Dr. Sergio Gabriel Carbia
Médico de planta. Cátedra de Dermatología, Hospital de Clínicas
"José de San Martín", Facultad de Medicina,
Universidad de Buenos Aires, Buenos Aires, Argentina
en colaboración con el doctor
Alberto Woscoff, Profesor titular consulto. Cátedra
de Dermatología, Hospital de Clínicas "José de San
Martín", Facultad de Medicina, Universidad de Buenos
Aires.
Otro trabajo publicado: Carbia SG, Martín A, Charas G,
Dei-Cas I, Casas G, Devés A, Woscoff A: "Nevo de
Duperrat sobre un nevo spilus" Dermatología
Argentina 8:198-200, 2002 |
Buenos Aires, Argentina (especial
para SIIC)
En pacientes con úlceras cutáneas
linfomatosas la sepsis es la principal causa de mortalidad, por lo
que se destaca el valor del adecuado estudio bacteriológico y rápido
tratamiento.
RESUMEN
Las úlceras cutáneas linfomatosas predicen mal pronóstico al ser
potencial fuente de sepsis. Se estudiaron 12 pacientes con linfomas
cutáneos ulcerados entre 59 pacientes con linfoma y compromiso cutáneo
en piel durante 10 años. Las úlceras se caracterizaron en su mayoría
por presentarse en individuos mayores a 50 años, asentar sobre
tumores y ser múltiples, necróticas e infectadas. Usualmente
aparecen en estadios tardíos y resultaron la principal vía de
entrada para el desarrollo de sepsis, en especial a Staphylococcus
aureus meticilino-resistente. La sobrevida media de los
pacientes fallecidos después del inicio de las úlceras fue de 6.27
meses. En otro trabajo con 62 pacientes con micosis fungoide las
ulceraciones cutáneas linfomatosas mostraron una asociación
fuertemente significativa para desarrollar sepsis (p < 0.001).
Otros factores predisponentes para sepsis hallados en este grupo de
pacientes fueron eritrodermia, adenopatías histológicamente
infiltradas, metástasis viscerales, estadio IV y células atípicas
circulantes > 5% (síndrome de Sézary; del cual se realiza una
actualización del tema). Se identifica a la sepsis como la
principal causa de mortalidad por lo que destacamos el valor de un
adecuado estudio bacteriológico y un rápido tratamiento.
Palabras clave: linfomas cutáneos, sepsis, micosis
fungoide, úlceras cutáneas.
SUMMARY
Ulcerated cutaneous lymphomas have a poor prognosis and may be the
source of sepsis. We analyzed 12 patients with ulcerated cutaneous
lymphomas between 59 patients with lymphomas and skin involvement
during the period 1990-2000. Usually the ulcers were presented in
people older than 50 years, placed on tumors and were multiple,
necrotic and infected. More frequently they appeared at late stages
and they were the main pathway of development of sepsis, specially
by meticillin-resistant Staphylococcus aureus. Mean survival of
deceased patients after onset of ulcers was 6.27 months. On other
work we studied 62 patients with mycosis fungoides (MF) and sepsis.
Cutaneous ucers by MF were strongly associated with sepsis (p <
0.001). Other predisposing factors that we found in this group of
patients were erythroderma, lymph node and/or visceral involvement,
stage IV and atypical circulating cells > 5% (Sézary syndrome;
which an update is made). We emphasize the importance of an
appropiate microbiological study and a prompt therapy
Key words: cutaneous lymphoma, sepsis, mycosis fungoides,
cutaneous ulcer.
COMENTARIO
La sepsis es la principal causa de mortalidad en pacientes con
linfomas cutáneos y su aparición es favorecida por diversos
factores. Se estudiaron en nuestro servicio 12 pacientes con
linfomas cutáneos ulcerados entre 59 pacientes con linfoma y
compromiso cutáneo en piel durante un período de 10 años
(1990-2000).1 Usualmente, como ocurrió en nuestra serie,
las úlceras cutáneas linfomatosas aparecen en individuos mayores
de 50 años y en estadios tardíos de la enfermedad.2 Sólo
excepcionalmente son signo de presentación del linfoma.3,4
Las úlceras se caracterizaron por ser irregulares, de borde
inflamatorio elevado, 3 a 5 cm de diámetro y fondo fibrino-necrótico.
En ocasiones exudaron material purulento o hemorrágico. La mayoría
eran múltiples, necróticas y asentaban principalmente sobre
tumores y/o placas. Si bien no hubo una localización típica, la
mayoría comprometía abdomen, tórax y extremidades.1,5
Como sabemos, el pioderma gangrenoso (PG) está asociado a
trastornos mieloproliferativos (como leucemia mieloide aguda o crónica)
y linfoproliferativos (como leucemia linfoide aguda o crónica,
leucemia de células vellosas y linfomas Hodgkin y no-Hodgkin).6
Recientemente se lo ha asociado a linfomas de células T (LCCT).7.
Sin embargo las úlceras cutáneas linfomatosas pueden simular PG.4,8,9.
Aunque infrecuentes, son úlceras que clínicamente parecen PG pero
que la histopatología revela la presencia de células atípicas.4,8
Recientemente publicamos un caso en un varón de 47 años que debutó
con múltiples ulceraciones PG-símil como signo de presentación de
micosis fungoide (MF).4 Si bien excepcional, este caso
nos alerta sobre las múltiples manifestaciones atípicas en este
grupo de pacientes.
La histopatología puede ser inespecífica, como ocurrió con 2
de nuestros pacientes, debido a que la infección bacteriana produce
un infiltrado inflamatorio que oculta las células linfoides
malignas.1,2 Helm y colaboradores observaron esta
dificultad en 8 de sus 25 pacientes estudiados.2 De ahí
la necesidad de realizar biopsias cutáneas repetidas del borde de
la lesión y/o la realización de estudios de reordenamiento
monoclonal del receptor antigénico de linfocito T (TCR).
Los estudios bacteriológicos son claves y deben correlacionarse
con los hemocultivos.1 Los principales agentes detectados
en las úlceras fueron Staphylococcus aureus y Pseudomonas
aeruginosa aislándose los mismos gérmenes en hemocultivos (70%
para S. aureus y 66% para P. aeruginosa).1
Estos datos, como en las series de Helm y Posner, indican cuáles
son las principales bacterias involucradas en los pacientes sépticos
que cursan con un linfoma.2,10 Al respecto, estos
organismos son responsables de más del 50% de las muertes en
pacientes con LCCT.11 La sobrevida varía según el tipo
de linfoma y su estadio. Los estadios tardíos y los linfomas
no-Hodgkin ganglionares (LNH) son los de menor sobrevida. A modo de
comparación, mientras la sobrevida a los 6 meses de los LNH fue de
3.30 ± 2.06 meses, para los pacientes con MF fue de 9.69 ± 6.78
meses.1 Entre las causas de muerte en este grupo de
pacientes la sepsis fue la principal, seguida por la progresión del
linfoma y el tromboembolismo pulmonar.1. En nuestra casuística
no hemos tenido pacientes con LCCT no-MF. En este grupo de pacientes
Beljaards y colaboradores hallaron que los pacientes con linfomas a
células grandes CD30 positivo tenían mejor pronóstico que con
linfomas CD30 negativo los cuales desarrollaban rápidamente
enfermedad sistémica.12 Las ulceraciones cutáneas
linfomatosas indican mal pronóstico independientemente del estadio
del linfoma.13 Están asociadas con mayor riesgo de
sepsis como demostramos en otro trabajo realizado en 62 pacientes
con el linfoma cutáneo más frecuente, la micosis fungoide (p <
0.001).14 Otros factores predisponentes de sepsis que
hallamos en este grupo de pacientes fueron eritrodermia (p <
0.01), adenopatías histológicamente infiltradas (p < 0.001),
metástasis viscerales (p < 0.01), células atípicas circulantes
> 5% (p < 0.02) y estadio IV (p < 0.001).14 Como
observamos, la presencia de células atípicas circulantes, también
conocidas como células de Sézary, resultó un factor de mal pronóstico.
Si bien no hay acuerdo en definir al síndrome de Sézary (SS),15
en nuestro trabajo consideramos la presencia de más de 5% de células
atípicas circulantes. La EORTC propuso como criterios la presencia
de una población clonal celular T-CD4 que incremente
significativamente la tasa CD4/CD8 mayor a 10 en sangre periférica.16
Utilizando estos criterios encontraron una sobrevida de veinticuatro
meses. Más recientemente se determinó que la ausencia del antígeno
pan-T CD7 es un útil marcador pronóstico.17 Al
respecto, Bernengo y colaboradores demostraron que la expresión de
CD7 en pacientes con SS está asociada con una sobrevida media del
67% a los cinco años, a diferencia del grupo con ausencia de CD7
que era del 20%.17 Finalmente Russel-Jones y Whitaker18
propusieron en el año 2001 nuevos criterios para definir el SS,
debiendo incluir como mínimo:
- Eritrodermia
- Histopatología compatible (similar a la MF, pudiendo faltar
el epidermotropismo).
- Células atípicas circulantes ? 5% (elegido porque
corresponde al estadio B1 del compromiso hematológico según la
estadificación original de Bunn- Lambert19 y tiene
significancia pronóstica en pacientes con LCCT eritrodérmicos).
- Población celular T clonal en sangre periférica evidenciada
por una o más de las siguientes pruebas: células de Sézary
grandes (> 14 µ), evidencia citogenética de un clon
anormal, pérdida de antígenos celulares pan-T (inmunofenotipo)
y presencia de un clon celular T por southern blot o reacción
de cadena de la polimerasa.
Sin embargo, recientemente Bernengo y colaboradores determinaron que
la pérdida del antígeno de superficie CD26 mayor al 30% de los
linfocitos de sangre periférica sería el parámetro inmunofenotípico
más confiable para identificar los LCCT con SS.20 En
nuestros trabajos la presencia de neutropenia febril
pos-quimioterapia fue variable. En los pacientes con MF y sepsis14
la incidencia de neutropenia fue baja y se debería a que la MF no
presenta alteración del sistema fagocítico-mononuclear (principal
responsable del sistema de defensa contra S. aureus) ni
defectos inmunológicos que favorezcan el desarrollo de sepsis.21,22
Además, se agrega el hecho que la mayoría de los pacientes con MF
requieren tratamientos diferentes de la quimioterapia, a diferencia
de lo que ocurre con otros tipos de linfomas. En nuestra casuística,
aunque limitada, comprobamos que, en los pacientes con linfomas
ganglionares y compromiso en piel, la neutropenia febril posterior a
la quimioterapia estuvo siempre presente.1 Como este
grupo fue el de peor pronóstico, pensamos que en estos pacientes la
ulceración sería la puerta de entrada de las infecciones y la
neutropenia facilitaría su diseminación.1 El
tratamiento antibiótico cubriendo S. aureus (incluyendo
cepas meticilino-resistentes) y bacterias gramnegativas (en especial
P. aeruginosa) debe iniciarse ante evidencia clínica
de sepsis (en nuestra serie expresadas usualmente en taquicardia,
hipotensión y fiebre).1,14 No está claro cómo se
producen las ulceraciones cutáneas por infiltración linfomatosa2
al no ser típica de un subtipo de linfoma. Se han propuesto
diversas teorías. De acuerdo con la observación de Piepkorn,23
la ulceración sería provocada por necrosis epidérmica debido al
marcado epidermotropismo que presentan algunos tipos de linfomas.
Esto explicaría la alta frecuencia de necrosis que presentan las
ulceraciones cutáneas linfomatosas.1 Otras hipótesis
posibles para el desarrollo de las ulceraciones serían la destrucción
de los vasos sanguíneos dérmicos (situación detectada en el
linfoma angiocéntrico de células T, una variedad de linfoma cutáneo
de células T)24 o por vasculitis (situación
aisladamente observada en la MF).25 El papel de los
factores inmunológicos tampoco puede ser excluido, ya que diversos
factores dermonecróticos, deficiencias en el sistema fagocítico
mononuclear o en la función neutrófila han sido postulados en su
patogénesis.2 En conclusión, las ulceraciones cutáneas
linfomatosas son fuente de sepsis.
Ante su presencia, los estudios microbiológicos y el tratamiento
antibiótico precoz y apropiado son elementos clave para evitar el
desarrollo de sepsis y muerte.
BIBLIOGRAFIA
- Carbia SG, Hochman A, Dei-Cas I et
al. Linfomas cutáneos ulcerados. Diez años de experiencia.
Medicina (Buenos Aires) 2000; 60: 565-569.
- Helm KF, Su WPD, Muller SA, Kurtin
PJ. Malignant lymphoma and leukemia with prominent ulceration:
clinicopathologic correlation of 33 cases. J Am Acad Dermatol
1992; 27: 553-559.
- Stringer MD, Melcher C, Stachan
CJ. The lower limb as a presenting sign of malignant lymphoma.
Ann R Coll Surg Engl 1987; 69: 8-11.
- Carbia SG, Hochman A, Chaín I et
al. Mycosis fungoides presenting with extensive pyoderma
gangrenosum-like ulcers. J Eur Acad Dermatol Venereol 2002; 16:
401-404.
- Carbia SG, Dahbar M, Acuña K et
al. Ulceras linfomatosas. Dermatol Argent 2001; 3: 220-224.
- Powell FC, Su WPD, Perry HO.
Pyoderma gangrenosum: classification and management. J Am Acad
Dermatol 1996; 34: 395-409.
- Kitahama A, Roland PY, Kerstein
MD. Pyoderma gangrenosum with cutaneous T-cell lymphoma
manifested as lower extremity ulcers. Angiology 1991; 42:
498-503.
- Vose JM, Armitage JO, Duggan JD,
Braddock SW. Pyoderma gangrenosum or cutaneous lymphoma: a
difficult clinical diagnosis. Cutis 1988; 42: 335-337.
- Ho KKL, Browne A, Fitzgibbons J et
al. Mycosis fungoides bullosa simulating pyoderma gangrenosum.
Br J Dermatol 2000; 142: 124-127.
- Posner LE, Fossieck BE, Eddy JL et
al. Septicemic complications of the cutaneous T-cell lymphomas.
Am J Med 1981; 71: 210-216.
- Lorincz AL. Cutaneous T-cell
lymphomas. Lancet 1996; 347: 871-876.
- Beljaards RC, Meijer CJ, Scheffer
E et al. Prognostic significance of CD30 (Ki-1/Ber-H2)
expression in primary cutaneous large-cell lymphomas of T-cell
origin: a clinico-pathologic and immunohistochemical study in 20
patients. Am J Pathol 1989; 135: 1169-1178.
- Green SB, Byar DP, Lamberg SI.
Prognostic variables in mycosis fungoides. Cancer 1981; 47:
2671-2677.
- Carbia SG, Dei-Cas I, Dahbar M,
Acuña K, Woscoff A. Factores predisponentes de sepsis en
micosis fungoide. Actas Dermosifiliogr 2001; 92: 491-497.
- Carbia SG, Woscoff A. ¿Qué es el
síndrome de Sézary?. Dermatol Argent 2001; 7: 296-298.
- Willemze R, Kerl H, Sterry W et
al. EORTC classification for primary cutaneous lymphomas: a
proposal from the Cutaneous Lymphoma Study Group of the European
Organization for Research and Treatment of Cancer. Blood 1997;
90: 354-371.
- Bernengo M, Quaglino P, Novelli M
et al. Prognostic factors in Sézary syndrome: A multivariate
analysis of clinical, haematological and immunological features.
Ann Oncol 1998; 9: 857-863.
- Russell Jones R, Whitaker S. TCR
gene analysis in the diagnosis of Sézary syndrome. J Am Acad
Dermatol 1999; 41: 254-259.
- Bunn P, Lambert W. Report of the
commitee on staging and classification of cutaneous T-cell
lymphomas. Cancer Treat Rep 1979; 63: 725-728.
- Bernengo MG, Novelli M, Quaglino P
et al. The relevance of the CD4+CD26- subset in the
identification of circulating Sézary cells. Br J Dermatol 2001;
144: 125-135.
- Seitz LE, Golitz LP, Weston WL,
Aeling JE, Dustin RD. Defective monocyte chemotaxis in mycosis
fungoides. Arch Dermatol 1977; 113: 1055-1057.
- Blaylock WK, Clendenning WE,
Carbone PP, Van Scott EJ. Normal immunologic reactivity in
patients with the lymphoma mycosis fungoides. Cancer 1966; 19:
233-236.
- Piepkorn M, Tigelaar RE. The
intracutaneous growth of murine lymphomas: epidermal invasion is
characteristic of multiple tumor phenothypes. J Invest Dermatol
1984; 83: 281-285.
- Chan JKC, Ng Cs, Ngan KC et al.
Angiocentric T-cell lymphoma of the skin: an aggresive lymphoma
distinct from mycosis fungoides. Am J Surg Pathol 1988; 12:
871-876.
- Granstein RD, Soter NA, Haynes HA.
Necrotizing vasculitis within cutaneous lesions of mycosis
fungoides. J Am Acad Dermatol 1983; 9: 128- 133.
|
 EVALUAN EL TRASPLANTE AUTOLOGO DE PRECURSORES HEMATOPOYETICOS EN
EL AMBITO DE LA MEDICINA AMBULATORIA
EVALUAN EL TRASPLANTE AUTOLOGO DE PRECURSORES HEMATOPOYETICOS EN
EL AMBITO DE LA MEDICINA AMBULATORIA
|
|

|
Columnista
Experto de SIIC
Pranatharthi H.
Chandrasekar, MD
Profesor de Medicina, Infectólogo. División de
Enfermedades Infecciosas, Harper University Hospital,
Wayne State University School of Medicine, Detroit,
Michigan, EE.UU.
Otro trabajo publicado: Soubani AO, Chandrasekar PH:
«Clinical spectrum of pulmonary aspergillosis», Chest
121:1988-1999, 2002 |
|
|
Michigan, EE.UU. (especial
para SIIC)
El trasplante autólogo de precursores
hematológicos de sangre periférica puede llevarse a cabo en forma
segura y eficaz en forma ambulatoria.
RESUMEN
El trasplante de precursores hematopoyéticos, un método cada vez más
frecuentemente usado en el tratamiento de pacientes con enfermedades
malignas y trastornos genéticos, se ha efectuado tradicionalmente
en enfermos internados. Las complicaciones inmediatas que ocurren
durante la neutropenia (período preinjerto), particularmente
aquellas debidas a infección y mucositis que requieren tratamiento
inmediato, dificultaron la posibilidad del trasplante en el contexto
de la medicina ambulatoria. Retrospectivamente analizamos datos de
mujeres receptoras de trasplante autólogo de precursores hematopoyéticos
de sangre periférica fuera del hospital. El ensayo se realizó
finalmente sobre 105 mujeres con cáncer de mama que recibieron
profilaxis con antibióticos de amplio espectro. El régimen
seleccionado de acondicionamiento no produjo o sólo generó
manifestaciones leves a nivel de mucosa oral y gastrointestinal.
Todas las pacientes fueron controladas diariamente en los
consultorios externos de la clínica de trasplante y el personal médico
especializado estuvo disponible día y noche. La patología
infecciosa fue considerablemente baja sin que se registraran
fallecimientos o eventos adversos graves. La duración de la
neutropenia fue corta (en promedio 7.5 días). El 50% de las
enfermas debió internarse por fiebre persistente, con un promedio
de 3 días. El esquema de acondicionamiento que respeta mucosas, el
uso de factores estimulantes de colonias, la profilaxis con antibióticos
de amplio espectro y, esencialmente, la disponibilidad inmediata de
personal médico y el control diario de las enfermas fueron
elementos cruciales para garantizar el éxito del trasplante en este
contexto. Por lo tanto, el trasplante autólogo de precursores
hematopoyéticos es factible en el ámbito de la medicina
ambulatoria. Se requieren estudios clínicos cuidadosos para evaluar
su aplicabilidad en otras técnicas de trasplante (técnica sin
mieloablación en el grupo alogénico) que involucran diferentes
poblaciones de pacientes ambulatorios. En caso de confirmarse el éxito,
este tipo de trasplante podrá representar ventajas económicas
importantes y, esencialmente, podría significar una mejora
sustancial en la calidad de vida de los enfermos.
Palabras clave: trasplante, ámbito ambulatorio,
profilaxis antibiótica.
ABSTRACT
Hematopoietic stem cell transplantation, an increasingly popular
method to treat malignancies and genetic disorders, has been
traditionally performed in an in-hospital setting. Immediate
complications during neutropenia (pre-engraftment period),
particularly those due to infection and mucositis that need prompt
care have made transplantation difficult in the outpatient setting.
We retrospectively analyzed data on women undergoing autologous
peripheral blood stem/progenitor cell transplantation (PBPCT) out of
the hospital. There were 105 women with breast cancer receiving
broad-spectrum antimicrobial prophylaxis. The conditioning regimen
chosen produced minimal or no oral/gastrointestinal mucositis. All
women were seen daily in the out- patient transplant clinic;
appropriate medical personnel were readily available during
day/night. Infectious morbidity was remarkably low with no deaths or
serious adverse events. Duration of neutropenia was short (mean, 7.5
days). Fifty percent women were hospitalized usually due to
persistent fever; mean duration of hospital stay was 3 days.
Mucositis-sparing conditioning regimen, liberal use of
colony-stimulating factors, use of broad-spectrum antimicrobial
prophylaxis and importantly, ready availability of medical personnel
and close daily care were the key elements for successful
transplantation in the outpatient setting. Thus, autologous stem
cell transplantation as an outpatient procedure is feasible. Careful
clinical studies are needed of other transplant techniques (e.g.
non-myeloablative technique in the allogeneic group) involving
different populations in the out-of-hospital setting. If successful,
transplant procedure will become economically far less expensive and
importantly, patient's quality of life is likely to be significantly
improved.
Key words: transplantation, outpatient setting,
antimicrobial prophylaxis
El trasplante de precursores hematopoyéticos (HSCT) es un método
comúnmente aceptado en el tratamiento de neoplasias hematológicas
y no hematológicas así como en diversos trastornos genéticos.
Tradicionalmente, tanto el trasplante autólogo como el alogénico
se realizan en pacientes internados. Hasta hace poco, las
complicaciones infecciosas graves en los receptores de trasplante
constituían un obstáculo fundamental en el éxito del
procedimiento en el contexto ambulatorio. Desde que se cambió la práctica
del trasplante de médula ósea por el trasplante de sangre periférica
como fuente esencial de precursores hematopoyéticos, la duración
de la neutropenia disminuyó considerablemente, con reducción de
las complicaciones infecciosas.1-3 Asimismo, la
administración de factor estimulante de colonias de granulocitos se
ha transformado en rutina con lo cual se redujo aún más el período
de riesgo de infección.4 Debido a ello, el HSCT se ha
transformado en un procedimiento pasible de realizarse en el ámbito
ambulatorio. El ahorro económico y la mejor calidad de vida son dos
aspectos particularmente ventajosos en relación con este
procedimiento. Sin embargo, sólo se han publicado unos pocos
estudios al respecto y los datos acerca de complicaciones precoces
(preinjerto y periinjerto) son escasos.5-9 Nuestro centro
de trasplante (Barbara Ann Karmanos Cancer Institute) ha
efectuado trasplante autólogo de precursores hematopoyéticos de
sangre periférica (PBSCT) en el ámbito externo en mujeres con cáncer
de mama metastásico. Con la finalidad de evaluar las complicaciones
tempranas (primeras dos semanas luego del trasplante), realizamos un
estudio retrospectivo en esta población uniforme de pacientes.10
Estudiamos 105 mujeres con cáncer de mama primario de alto riesgo o
con cáncer de mama metastásico sometidas a PBSCT autólogo durante
1996 y 1997. El esquema de acondicionamiento consistió en
ciclofosfamida intravenosa (iv), cisplatino iv y carmustina iv.
Luego de la quimioterapia en altas dosis, las enfermas fueron dadas
de alta y controladas diariamente en los consultorios externos de la
clínica. Las células precursoras de sangre periférica fueron
infundidas en las pacientes.
Simultáneamente se inició terapia con filgrastim (factor
estimulante de colonias de granulocitos) que continuó hasta el
injerto de médula. Se indicó profilaxis antibiótica con
ciprofloxacina oral (500 mg tres veces por día) más rifampicina
oral (300 mg dos veces por día) desde dos días antes del
trasplante y se continuó hasta que se desarrollara fiebre, infección
documentada o hasta que el recuento de neutrófilos fuese de 500 células/mm3
o más alto. La fiebre durante la neutropenia se trató empíricamente
con antibióticos. La terapia antimicrobiana incluyó ceftriaxona iv
una vez por día o tobramicina iv una vez al día y vancomicina iv
también una vez por día.
Ambos fármacos se administraron durante los controles diarios en
consultorios externos. Este esquema empírico se modificó según
los hallazgos clínicos y microbiológicos, y el tratamiento se
mantuvo en forma ambulatoria a menos que se registrara fiebre
persistente o que surgieran complicaciones tales como hipotensión,
sobrecarga de líquidos o mucositis grave. Las enfermas que debieron
ser internadas fueron rápidamente dadas de alta una vez que el
problema agudo se resolvió y siguieron controladas diariamente en
consultorios externos. Las mujeres con infecciones documentadas clínica
o microbiológicamente fueron tratadas hasta la desaparición
completa de los signos y síntomas. Todas las enfermas recibieron
clotrimazol, cada dosis de 10 mg cinco veces por día como
profilaxis antimicótica. El protocolo permitió la terapia antifúngica
sistémica preventiva en pacientes con fiebre persistente o
inexplicable a pesar de 5 días de tratamiento antibacteriano empírico.
No se administró profilaxis antiviral y sólo se indicó aciclovir
oral o iv en caso de infección probable o documentada por virus
herpes simplex (HSV).
La edad promedio de las mujeres fue de 45 años. Aunque la mayoría
recibió células no seleccionadas, 9 de las 105 recibieron células
seleccionadas CD34+. La duración promedio de la neutropenia fue de
7.5 días (5 días en 2 pacientes, 6 a 8 días en 86, 9 a 10 días
en 16 y 11 días en una enferma). El 78% toleró la profilaxis
antimicrobiana oral mientras que el resto debió ser tratado en
forma parenteral. En el 71% se registró fiebre; no se identificó
la causa en 64 de 75 pacientes. Cabe mencionar que el 29% no demostró
fiebre durante la neutropenia, por lo que no requirió
antimicrobianos en forma empírica. Se produjeron complicaciones
infecciosas en 36 enfermas (34%) y hubo 40 episodios infecciosos.
Los tipos de infección y la frecuencia se muestran en la tabla 1.
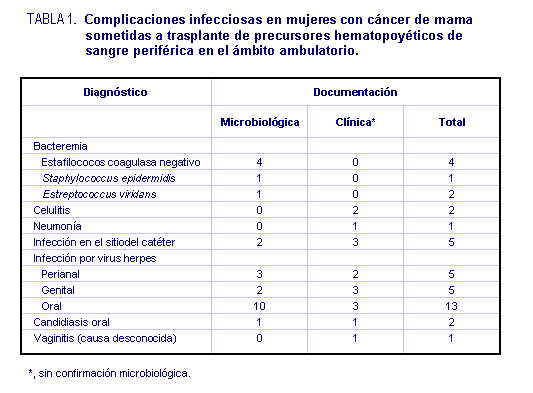
No hubo episodios de septicemia por gramnegativos ni tampoco
infecciones micóticas sistémicas documentadas. En 6 oportunidades
se registró bacteriemia por gérmenes grampositivos, cinco de ellas
atribuibles a estafilococos coagulasa negativos y la restante a Streptococcus
viridans. Las infecciones más comunes fueron por HSV. Todos las
pacientes respondieron rápidamente al tratamiento antimicrobiano.
La mucositis o diarrea grave, complicaciones habituales de la
quimioterapia citotóxica, fueron muy raras. Los catéteres
vasculares (Arrowgard, en subclavia) fueron removidos en 8
pacientes y se sospechó infección en 6 de los 8 casos. El uso
global de antibióticos, independientemente del régimen profiláctico,
fue común. El 72% recibió agentes antibacterianos, 5 fueron
tratadas con antifúngicos y 24 pacientes recibieron aciclovir. El
antimicótico utilizado fue el fluconazol; ninguna paciente recibió
anfotericina B o formas lipídicas de anfotericina B.
La mitad de las enfermas no debió ser internada durante el período
de estudio (hasta 14 días luego del trasplante). Cuarenta y una de
las 53 pacientes fueron hospitalizadas por fiebre, 4 por náuseas y
vómitos, y 7 por otros problemas (insuficiencia cardíaca,
insuficiencia renal). La duración de la internación fue corta en
la mayoría de los casos; 28 pacientes (53% de las internadas)
permanecieron 3 días o menos mientras que 19 enfermas (36%)
debieron permanecer entre 4 y 6 días (gráfico 1).

No se registraron fallecimientos o eventos adversos graves
(transferencia a unidad de cuidados intensivos) durante el período
de estudio. Debe remarcarse que todas las pacientes estuvieron cerca
del hospital, que el personal médico estuvo disponible las 24 horas
del día y que a las enfermas en la clínica se les realizó un
cuidadoso.
El hallazgo más destacable fue que la morbilidad infecciosa
durante la neutropenia (período preinjerto) fue muy baja y las
pocas infecciones que ocurrieron fueron de gravedad leve o moderada,
sin fallecimientos o eventos adversos graves. Creemos que la baja
incidencia de infecciones registradas en el estudio obedeció al régimen
de quimioterapia que no se asocia con mucositis. De hecho, las
manifestaciones clínicas indicadoras de mucositis (como dolor oral
o de fauces, úlceras orales, vómitos y diarrea) estuvieron
ausentes. Debido a que la mayoría de las infecciones que ocurren
durante la neutropenia son endógenas, esencialmente de origen
gastrointestinal, no fue sorprendente observar marcada reducción en
la frecuencia de infecciones asociada con mucositis mínima o
ausente. Con los regímenes de acondicionamiento que se acompañan
de mucositis oral o gastrointestinal grave, la incidencia esperada
de bacteriemia por gramnegativos y de otras complicaciones
infecciosas es alta. Se han publicado al menos dos estudios que
demostraron asociación entre la mucositis y la mayor frecuencia de
infección en el contexto de trasplantes autólogos.11,12
La mucositis grado II a IV se acompañó de distinta frecuencia de
infección (p = 0.0001, odds ratio = 3.4). Los investigadores
notaron 33 episodios infecciosos (20 por bacterias grampositivas y
13 por bacterias gramnegativas) entre 150 receptores de trasplantes
autólogos.12 Entre los patógenos grampositivos, el
estreptococo -hemolítico de origen orofaríngeo fue causa de
septicemia en pacientes que desarrollaron mucositis ulcerosa oral o
gastrointestinal luego de la quimioterapia citotóxica.11
Probablemente, las ulceraciones en la mucosa oral representaron la vía
de entrada de este germen.
Ruescher y colaboradores encontraron que los pacientes con
mucositis ulcerosa tuvieron 3 veces más riesgo de bacteriemia por
estreptococo hemolítico que quienes no la demostraron (odds ratio =
3.2) en un grupo de enfermos sometidos a trasplante autólogo de médula
por neoplasias hematológicas.11 Asimismo, aquellos que
presentaron úlceras orales, independientemente de la bacteriemia,
debieron ser internados por más tiempo. La bacteriemia debida a
estreptococo hemolítico no es trivial y se observó que la demora
en el tratamiento es causa de sepsis fulminante y muerte.13,14
Algunos centros con mayor frecuencia de infección por estreptococo a-hemolítico
actualmente administran en forma rutinaria vancomicina en combinación
con profilaxis para gramnegativos en pacientes con neutropenia
febril. Así, es claro que la frecuencia y la gravedad de la
mucositis oral o gastrointestinal asociada con el esquema de
acondicionamiento deben tenerse en cuenta al estimar el riesgo de
infección durante el trasplante autólogo.
La duración de la neutropenia, un factor reconocido de riesgo de
infección, se reduce mediante tratamiento con factores estimulantes
de colonias, por ejemplo G-CSF (filgrastim) y GM-CSF (sargramostim).4.
Sin embargo, a pesar del uso de G-CSF durante el PBSCT autólogo, la
neutropenia no se evita por completo. Se ha visto que, incluso, un
período corto de neutropenia (5 días con recuento absoluto de
neutrófilos por debajo de los 100 por mm3) se
correlaciona con el desarrollo de infección (p = 0.0001, odds ratio
= 2.3) y con su evolución (p = 0.0024).12 Muchos
protocolos de trasplante autólogo de PBSCT actualmente incluyen en
forma rutinaria el uso de factores estimulantes de colonias luego de
la infusión de las células precursoras. Sin embargo, las
recomendaciones de la American Society of Clinical Oncology y
el panel de la Infectious Diseases Society of America no
avalan el uso rutinario de factores estimulantes de colonias para
tratar pacientes con neutropenia febril o afebril.15,16
La patología subyacente del huésped es un aspecto fundamental a
considerar en el riesgo de infección durante el trasplante. En
general, es común que los enfermos con tumores sólidos reciban regímenes
menos intensos de quimioterapia, lo cual se asocia con períodos más
cortos de neutropenia en comparación con los individuos portadores
de neoplasias hematológicas. Por ello los primeros pueden tener
riesgo de infección considerablemente más bajo. Asimismo, los
pacientes con tumores sólidos pueden estar internados menos tiempo,
con lo cual disminuye el riesgo de adquirir infección por gérmenes
intrahospitalarios multirresistentes.
En nuestra investigación se empleó profilaxis antibacteriana de
amplio espectro. Sin embargo, es importante evaluar el verdadero
beneficio de dichos protocolos preventivos, especialmente en
pacientes que reciben esquemas que no se asocian con mucositis. En
los últimos años, el uso masivo de antibióticos en múltiples
contextos (empírico, profiláctico y terapéutico) motivó un
problema importante por la aparición de cepas con resistencia a múltiples
antimicrobianos en pacientes sometidos a trasplante por cáncer.
En la profilaxis antibacteriana durante la neutropenia, el
objetivo esencial es la eliminación selectiva de bacilos
gramnegativos aeróbicos del intestino. En este sentido, las
quinolonas son ideales y estudios con ciprofloxacina u ofloxacina
durante la neutropenia mostraron su eficacia en la prevención de
infecciones por bacterias gramnegativas.17,18 Sin
embargo, en relación con el uso profiláctico de quinolonas
surgieron dos aspectos de particular preocupación: la aparición de
bacterias grampositivas (estafilococo y estreptococo resistentes a
la meticilina) con resistencia a las quinolonas como patógenos
significativos y la frecuencia en aumento de infecciones por
bacterias gramnegativas resistentes a quinolonas.19-23 En
este sentido se intentaron con diferente éxito diversas estrategias
(como el uso de una quinolona más penicilina, un macrólido
-claritromicina-, rifampicina) para la reducción o eliminación de
bacterias grampositivas.24-26 El agregado de penicilina o
vancomicina a la norfloxacina se asoció con reducción
significativa de las infecciones estreptocócicas.24 Con
el agregado de claritromicina a ciprofloxacina, como profilaxis en
PBSCT autólogo, se recuperaron cepas de estreptococo resistentes a
macrólidos.25 Con el esquema de ciprofloxacina en
combinación con rifampicina, tal como se usó en nuestro estudio, aún
se registraron casos de bacteriemia por grampositivos pero en muy
baja frecuencia. Hidalgo y colaboradores encontraron que la
profilaxis con ciprofloxacina más rifampicina, en comparación con
ciprofloxacina en forma exclusiva, se acompañaba de menor
frecuencia de bacteriemia por grampositivos en pacientes con tumores
sólidos que recibieron PBSCT autólogo.
Sin embargo, no se encontraron diferencias entre los dos grupos
en el tiempo que transcurrió hasta el inicio de la fiebre,
incidencia de episodios febriles, uso de anfotericina B y duración
de la internación.26 Asimismo, el esquema profiláctico
combinado se asoció con mayor incidencia de efectos adversos. En
nuestras pacientes, el 22% tuvo intolerancia a la rifampicina. Ante
estos resultados, es justificable que los profesionales cuestionen
el agregado de rifampicina a la quinolona en la profilaxis, en
especial en pacientes que recibieron un esquema de acondicionamiento
que se asocia con una baja frecuencia de infección bacteriana por
estreptococo u otro germen grampositivo. Además, muchos pueden
preguntarse si no sería conveniente reservar la rifampicina para el
manejo de infecciones por micobacterias. Debido a que la resistencia
a la rifampicina es rápido desarrollo, parece adecuado evitar su
uso con fines profilácticos. Este argumento es aún más válido en
el caso de pacientes con bajo riesgo de infección, por ejemplo los
que son tratados con regímenes de acondicionamiento que ocasionan
mucositis leve y neutropenia de corta duración.
Diversos estudios demostraron la aparición de bacilos
gramnegativos resistentes a las quinolonas durante la profilaxis con
estos antibióticos.20-23 En una población semejante a
la de nuestro estudio, investigadores españoles administraron
ofloxacina a 132 mujeres con cáncer de mama sometidas a PBSCT autólogo,
27 y encontraron frecuencia creciente de bacteriemia por
gramnegativos; es de destacar que el 71% de los bacilos
gramnegativos aislados era resistente a la ofloxacina. Así, el uso
de quinolonas o de cualquier otro antibacteriano con finalidad
profiláctica debe ser meticulosamente evaluado. La frecuencia y la
gravedad de la mucositis ocasionadas por el régimen de
acondicionamiento, la magnitud y la duración de la neutropenia y
las enfermedades subyacentes (tumores sólidos versus
neoplasia hematológica) son factores cruciales que deben ser
considerados. En las enfermas estudiadas (mujeres con tumores sólidos,
tratadas con esquemas que respetan mucosas y se asocian con
neutropenia de corta duración durante el PBSCT autólogo), las
desventajas del uso profiláctico de antibióticos de amplio
espectro podrían superar a los beneficios.
Nuestras enfermas adquirieron frecuentemente infección por virus
herpes simplex orogenital o anal (23 de 40 episodios infecciosos).
El 65% de las pacientes tenía serología positiva para este virus
por lo que, actualmente, administramos aciclovir en forma profiláctica
a todas las enfermas seropositivas durante la fase de preinjerto. En
este sentido son preferibles los preparados orales menos costosos
que la fórmula para uso iv. Cuando la mucositis es un factor
significativo, el aciclovir iv parece más apropiado. En este
contexto, dada la corta duración de la neutropenia, es más
improbable la aparición de HSV resistente al aciclovir. Dignani y
colaboradores evaluaron recientemente la eficacia del valaciclovir
oral en la profilaxis en pacientes con serología positiva antiHSV
sometidos a PBSCT autólogo.28 El fármaco fue tan eficaz
como el aciclovir por vía iv y de costo muy inferior. Por lo tanto,
en la prevención de la reactivación de la infección por HSV, en
áreas de elevada seroprevalencia, la profilaxis antiHSV estaría
indicada en estos enfermos, independientemente del tipo de esquema
de acondicionamiento o de la duración de la neutropenia. Otras
enfermedades virales, como la ocasionada por el citomegalovirus, son
infrecuentes en el contexto del trasplante autólogo y por ello la
profilaxis no está indicada.
Las infecciones micóticas en pacientes sometidos a trasplante
habitualmente son causadas por Candida y menos frecuentemente
por Aspergillus.29 Son más frecuentes en el
trasplante alogénico. La infección por Candida puede
expresarse como candidiasis oral o vaginal, candidemia
(habitualmente relacionada con catéteres vasculares) y, menos comúnmente,
como candidiasis sistémica. Se vio que la profilaxis con fluconazol
en receptores de trasplante alogénico reduce la infección por Candida
sistémica y superficial así como la morbilidad relacionada con la
infección fúngica.30,31 En nuestro estudio, a pesar de la ausencia
de profilaxis sistémica antimicótica, no se registraron casos de
infecciones sistémicas por hongos o candidemia. Por lo tanto,
sostengo que la profilaxis antimicótica sistémica (con fluconazol
o echinocandins) está justificada durante el período preinjerto en
pacientes similares a los que estudiamos.32 Esta política,
sin embargo, no parece aplicable a todos los receptores de
trasplante autólogo. Rotstein y colaboradores demostraron el
beneficio de la profilaxis con fluconazol en receptores de PBSCT autólogo
que no reciben en forma rutinaria factores estimulantes de colonias.33
La infección por hongos filamentosos, aspergilosis, no se evita con
el fluconazol y se observa típicamente en pacientes con neutropenia
prolongada (de más de 2 semanas) o que reciben esteroides por
enfermedad de injerto versus huésped. En trasplante autólogo,
la falla o retardo del injerto así como la administración de
esteroides por toxicidad asociada con el esquema puede colocar al
enfermo en riesgo de aspergilosis invasiva. Afortunadamente, este
escenario no es común durante el PBSCT autólogo. Además, en
nuestra cohorte muy pocas pacientes recibieron tratamiento empírico
con agentes antifúngicos por fiebre persistente. Durante estos períodos,
se empleó exitosamente fluconazol en vez de anfotericina B u otras
formas lipídicas costosas de anfotericina B. De esta forma se
reduce la toxicidad y la nefrotoxicidad relacionadas con la infusión.
Debido a que este grupo de mujeres tenía bajo riesgo de infecciones
micóticas por hongos no Candida y no recibió fluconazol
como profilaxis, el tratamiento empírico con fluconazol parece
eficaz y adecuado. Por lo tanto, la clara comprensión de los
factores de riesgo de infección micótica es esencial para
determinar el tipo (o tipos) de poblaciones de sujetos receptores de
trasplante que pueden beneficiarse más a partir de la
quimioprofilaxis antifúngica. Debe recalcarse que, a diferencia de
los receptores de PBSCT autólogo, los individuos sometidos a
trasplante alogénico, particularmente aquellos que reciben órganos
de dadores no relacionados y los que padecen enfermedad de injerto versus
huésped tratados con corticoides así como los que reciben un
esquema de acondicionamiento no mieloablativo, están expuestos a
mayor riesgo de enfermedad fúngica invasiva.34 En
resumen, nuestro estudio demuestra que el trasplante de precursores
hematológicos autólogos de sangre periférica puede llevarse a
cabo con seguridad y eficacia en forma ambulatoria. Las claves del
éxito residen en la elección de los enfermos (aquellos con tumores
sólidos y, por ende, con menor riesgo de infección); el empleo de
un esquema que respeta mucosas; la neutropenia de corta duración y
el uso de factores estimulantes de colonias; la profilaxis antibiótica
y, tal vez más importante, el monitoreo diario estricto de los
enfermos en el ámbito externo así como también la disponibilidad
permanente del equipo de profesionales. En este contexto de bajo
riesgo, la profilaxis con antibióticos de amplio espectro debe
reevaluarse. El abordaje ambulatorio ha sido exitosamente aplicado
en otras poblaciones de enfermos con cáncer. Por ejemplo, algunos
pacientes febriles neutropénicos cuidadosamente seleccionados
fueron exitosamente tratados de manera ambulatoria con antibióticos
orales.35-38 Se han identificado los factores que
influyen en un bajo riesgo de infecciones graves entre los enfermos
neutropénicos (tabla 2). Los resultados son promisorios.

El trasplante en el contexto ambulatorio parece factible en
receptores de trasplante autólogo y alogénico, por ejemplo, en
aquellos que son sometidos a un esquema sin mieloablación asociado
con neutropenia de corta duración. Parece oportuno evaluar esta
posibilidad en poblaciones de pacientes con un riesgo global bajo de
infección o de otras complicaciones, durante la fase de preinjerto.
Dicha estrategia, en caso de confirmarse su éxito, será sin duda
bienvenida por los administradores del área de salud, por los médicos
y, fundamentalmente, por los pacientes.
BIBLIOGRAFIA
- Nosanchuk JD, Sepkowitz KA, Pearse
RN, et al. Infectious complications of autologous bone marrow
and peripheral stem cell transplantation for refractory leukemia
and lymphoma. Bone Marrow Transplant 1996; 18:355-359.
- Mossad JB, Longworth DL,
Goormastic M, et al. Early infectious complications in
autologous bone marrow transplantation: a review of 219
patients. Bone Marrow Transplant 1996; 18:265-271.
- D'Antonio D, Iacone A, Pierelli L,
et al. Patterns of recovery phase infection after autologuos
blood progenitor cell transplantation in patients with
malignancies. The Gruppo Italiano di Studio per la Manipolazione
Cellulare in Ematologia. Eur J Clin Microbiol Infect Dis 1995;
14:552-556.
- TR, Mangan KF, Goldbert SL, et al.
Granulocyte colony-stimulating factor accelerates neurtophil
engraftment following peripheral blood stem cell
transplantation: a prospective, randomized trial. J Clin Oncol
1995; 13:1323-1327.
- Gilbert C, Meisenberg B,
Vredenburgh J, et al. Sequential prophylactic oral and empiric
once-daily parenteral antibiotics for neutropenia and fever
after high-dose chemotherapy and autologuos bone marrow support.
J Clin Oncol 1994; 12:1005- 1011.
- Peters WP, Ross M, Vredenburgh JJ,
et al. The use of intensive clinic support to permit outpatient
autologous bone marrow transplantation for breast cancer. Semin
Oncol 1994; 21 (Suppl 7):25-31.
- Meisenberg B, Gollard R, Brehm T,
et al. Prophylactic antibiotics eliminate bacteremia and allow
safe outpatient management following high-dose chemotherapy and
autologuous stem cell rescue. Support Care Cancer 1996;
4:364-369.
- Meisenberg BR, Miller WE, McMillan
R, et al. Outpatient high-dose chemotherapy with autologous
stem-cell rescue for hematologic and nonhematologic
malignancies. J Clin Oncol 1997; 15:11-17.
- Jagannath S, Vesole DH, Zhang M,
et al. Feasibility and cost-effectiveness of outpatient
autotransplants in multiple myeloma. Bone Marrow Transplant
1997; 20:445-450.
- Chandrasekar PH, Abraham OC, Klein
J, et al. Low infectious Morbidity after intensive chemotherapy
and autologous peripheral blood progenitor cell transplantation
in the outpatient setting for women with breast cancer. Clin
Infect Dis 2001; 32:546-551.
- Ruescher TJ, Sodefi A, Scrivani
SJ, et al. The impact of mucositis on alpha- hemolytic
streptococcal infection in patients undergoing autologous bone
marrow transplantation for hematologic malignancies. Cancer
1998; Jun 1;82(1):2275- 2281.
- Offidani M, Corvatta L, Olivieri
A, et al. Infectious complications after autologous peripheral
blood progenitor cell transplantation followed by G-CSF. Bone
Marrow Transplant 1999 Nov.; 24(10):1079-1087.
- Bochud PY, Calandra T, Francioli
P. Bacteremia due to viridans streptococci in neutropenic
patients: a review. Am J Med 1994; 97:256-264.
- Pizzo PA, Ladisch S, Robichaud K.
Treatment of gram-positive septicemia in cancer patients. Cancer
1980; 45:206-207.
- Ozer H, Armitage JO, Bennett CL,
et al. 2000 update of recommendations for the use of
hematopoietic colony-stimulating factors: evidence-based
clinical practice guidelines. J Clin Oncol 2000; 18:3558-3585.
- Hughes WT, Armstrong D, Bodey GP,
et al. 2002 Guidelines for the use of antimicrobial agents in
neutropenic patients with cancer. Clin Infect Dis 2002;
34:730-751.
- Kern W, Kurrle E. Ofloxacin versus
trimethoprim-sulfamethoxazole for prevention of infection in
patients with acute leukemia and granulocytopenia. Infection
1991; 19:73-80.
- Bow EJ, Mandell LA, Louie TJ, et
al. Quinolone-based chemoprophylaxis in neutropenic patients:
effect of augmented gram-positive activity on infectious
morbidity. Ann Intern Med 1996; 125:183-190.
- Harvathova Z, Spanik S, Sufliarsky
J, et al. Bacteremia due to methicillin-resistant staphylococci
occurs more frequently in neutropenia patients who received
antimicrobial prophylaxis and is associated with higher
mortality in comparison of methicillin-sensitive bacteremia. Int
J Antimicrob Agents 1998; 10:55-58.
- Carratala J, Fernandez-Sevilla A,
Tubau F, et al. Emergence of quinolone-resistant Escherichia
coli bacteremia in neutropenic patients with cancer who have
received prophylactic norfloxacin. Clin Infect Dis 1995;
20:557-560.
- Somolinos N, Arranz R, Del Rey MC,
et al. Superinfections by Escherichia coli resistant to
fluorouinolones in immunocompromised pateints [letter]. J
Antimicrob Chemother 1992; 30:730-731.
- Kern WV, Andriof E, Oethinger M,
et al. Emergence of fluoroquinolone-resistant Escherichia coli
at a cancer center. Antimicrob Agents Chemother 1994; 38:681-
687.
- Cometta A, Calandra T, Bille J, et
al. Escherichia coli resistant to fluoroquinolones in patients
with cancer and neutropenia [letter]. N Engl J Med 1994;
330:1240- 1241.
- Broun ER, Wheat JL, Kneebone PH,
et al. Randomized trial of the addition of gram-positive
prophylaxis to standard antimicrobial prophylaxis for patients
undergoing autologous bone marrow transplantation. Antimicrob
Agents Chemother 1994; 38(3):576-579.
- Naqvi B, Dorsky D, Ali SA, et al.
Efficacy of clarithromycin in preventing viridans streptococcal
bacteremia following autologous stem cell transplantation.
Infection 2001 Aug.; 29:201-204.
- Hidalgo M, Hornedo J, Lumbreras C,
et al. Lack of ability of ciprofloxacin-rifampin prophylaxis to
decrease infection-related morbidity in neutropenic patients
given cytotoxic therapy and peripheral blood stem cell
transplants. Antimicrob Agents Chemother 1997 May; 41:1175-1177.
- Palau J, Picon I, Angel Climent M,
et al. Infection in patients with neutropenia that undergo an
autologuous peripheral blood stem cell transplant due to breast
cancer. Enferm Infec Microbiol Clin 2001 Nov; 19:422-427.
- Dignani MC, Mykietiuk A, Michelet
M, et al. Valacyclovir prophylaxis for the prevention of Herpes
simplex virus reactivation in recipients of progenitor cells
transplantation. Bone Marrow Transplant 2002; 29:263-267.
- Marr KA, Crippa F, Carter R, et
al. Epidemiology of fungal infections in hematopoietic stem cell
transplant recipients in the1990s [abstract]. Clin Infect Dis
2000; 31:261.
- Slavin MA, Osborne B, Adams R, et
al. Efficacy and safety of fluconazole prophylaxis for fungal
infections after marrow transplantation--a prospective,
randomized, double-blind study. J Infect Dis 1995;
171:1545-1552.
- Marr KA, Seidel K, Slavin MA, et
al. Prolonged fluconazole prophylaxis is associated with
persistent protection against candidiasis-relatd death in
allogeneic marrow transplant recipients: long-term follow-up of
a randomized, placebo- controlled trial. Blood 2000;
96:2055-2061.
- Montesinos J, Sola C, Maroto P, et
al. Fungal infections in patients with solid tumors treated with
high-dose chemotherapy and autologous peripheral blood stem cell
transplantation. Eur J Clin Microbiol Infect Dis 2001 Aug;
20:569-572.
- Rotstein C, Bow EJ, Laverdiere M,
et al. Randomized placebo-controlled trial of fluconazole
prophylaxis for neutropenic cancer patients: benefit based on
purpose and intensity of cytotoxic therapy. The Canadian
Fluconazole Prophylaxis Study Group. Clin Infect Dis 1999 Feb;
28:331-340.
- Walsh TJ, Roden M, Nelson L, et
al. Invasive fungal infections complicating non- myeloablative
allogeneic peripheral blood stem cell transplantation (PBSCT).
42nd ICAAC Abstract # M-1233, San Diego, California, Sept.
27-30, 2002.
- Malik IA, Khan WA, Karim M, et al.
Feasibility of outpatient management of fever in cancer patients
with low-risk neutropenia: results of a prospective randomized
trial. Am J Med 1995; 98:224-231.
- Garcia-Carbonero R, Cortes-Funes
H. Outpatient therapy with oral ofloxacin for patients with low
risk neutropenia and fever: a prospective, randomized clinical
trial. Cancer 1999; 85:213-219.
- Rolston KVI. New trends in patient
management: risk-based therapy for febrile patients with
neutropenia. Clin Infect Dis 1999; 29:515-521.
- Freifeld A, Marchigiani D, Walsh
T, et al. A double-blind comparison of empirical oral and
intravenous antibiotic therapy for low-risk febrile patients
with neutropenia during cancer chemotherapy. N Engl J Med 1999;
341:305-311.
|
 EL
ACIDO ZOLEDRONICO ES EL NUEVO TRATAMIENTO ESTANDAR DE LA
HIPERCALCEMIA ASOCIADA A PROCESOS MALIGNOS
EL
ACIDO ZOLEDRONICO ES EL NUEVO TRATAMIENTO ESTANDAR DE LA
HIPERCALCEMIA ASOCIADA A PROCESOS MALIGNOS
|
|
Columnista
Experto SIIC
Pierre P. Major, MD
Médico Oncólogo, Medical Oncology Department,
Hamilton Regional Cancer Centre, Hamilton,
Ontario, Canada.
Otro trabajo publicado: Major PP, Cook R: «Efficacy
of bisphosphonates in the management of skeletal
complications of bone metastases and selection
of clinical endpoints», American Journal of
Clinical Oncology 25(6 Suppl 1):S10-8, Dic
2002 (Revisión).
|
|
|
Hamilton, Ontario, Canadá (especial
para SIIC)
Mediante el tratamiento de la
hipercalcemia asociada a procesos malignos con ácido zoledrónico,
se obtiene rápida respuesta y de mayor duración que con la
administración de 90 mg de pamidronato.
RESUMEN
Hasta hace poco tiempo, el tratamiento estándar para la
hipercalcemia asociada a procesos malignos fue la
administración endovenosa de 90 mg de pamidronato. A pesar
de esto, el análisis conjunto efectuado durante el año
2001 de dos trabajos paralelos, multicéntricos,
aleatorizados y a doble ciego demostró que 4 mg de ácido
zoledrónico tuvieron una respuesta superior a 90 mg de
pamidronato. En estas pruebas, 287 pacientes con
hipercalcemia moderada a severa a consecuencia de procesos
malignos (la cual se definió por una concentración de
calcio sérico corregido ≥ 3.00 mmol/l (12.0 mg/dl)),
fueron tratados con una dosis simple de ácido zoledrónico
(perfusión durante 5 minutos de 4 mg u 8 mg) o con
pamidronato (perfusión durante 2 horas de 90 mg); se obtuvo
una respuesta superior con la primera de estas drogas
independientemente de las dosis en estudio. Al décimo día
de tratamiento, 88% de los pacientes tratados con 4 mg de ácido
zoledrónico vs. 70% de los que recibieron
pamidronato tuvieron normalización completa del calcio sérico
corregido (p = 0.002). Además, la duración de la respuesta
fue mayor en los individuos tratados con 4 mg u 8 mg de ácido
zoledrónico respecto de los que recibieron 90 mg de
pamidronato, con valores de 32, 43 y 18 días,
respectivamente. El ácido zoledrónico proporciona
normalización más rápida y efectiva del calcio sérico y
respuesta de mayor duración, motivo por el cual es
considerado (en la dosis recomendada de 4 mg) el nuevo
tratamiento estándar.
Palabras clave: bisfosfonato, marcador óseo,
resorción ósea, hipercalcemia, ácido zoledrónico
Abreviaturas:
RC, remisión completa
CSC, calcio sérico corregido
HPM, hipercalcemia asociada a procesos malignos
PRHP, proteína relacionada con la hormona
paratiroidea
ABSTRACT
Until recently, the standard of care for the treatment of
hypercalcemia of malignancy was intravenous administration
of 90 mg pamidronate. However, in 2001, the pooled analysis
of 2 parallel, multicenter, randomized, double-blind trials
demonstrated that 4 mg zoledronic acid was superior to 90 mg
pamidronate. In these trials, 287 patients with moderate to
severe hypercalcemia of malignancy, defined as corrected
serum calcium ( 3.00 mmol/L (12.0 mg/dL), were treated with
either a single dose of zoledronic acid (4 or 8 mg via
5-minute infusion) or pamidronate (90 mg via 2-hour
infusion). Both doses of zoledronic acid were superior to
pamidronate. By Day 10, 88% of patients treated with 4 mg
zoledronic acid versus 70% of patients treated with
pamidronate had complete normalization of corrected serum
calcium (P = .002). Moreover, the median duration of
complete response favored zoledronic acid 4 and 8 mg over
pamidronate 90 mg, with response durations of 32, 43, and 18
days, respectively. Zoledronic acid provides a more rapid
and effective normalization of serum calcium and a longer
duration of response compared with 90 mg pamidronate.
Therefore, zoledronic acid (at a recommended dose of 4 mg)
is the new standard of care.
Key words: Bisphosphonate, bone marker, bone
resorption, hypercalcemia, zoledronic acid.
Abbreviations:
CR, complete response
CSC, corrected serum calcium
HCM, hypercalcemia of malignancy
PTHrP, parathyroid hormone-related protein
INTRODUCCION
La hipercalcemia asociada a procesos malignos (HPM) es una
complicación metabólica potencial con tratamiento de por
vida, y afecta aproximadamente a entre 10% y 20% de los
pacientes con cáncer avanzado.¹ Su incidencia es mayor en
caso de mieloma múltiple y carcinomas de mama, pulmón, riñón,
cabeza y cuello.2- 4 Los síntomas clínicos de
HPM tales como náuseas, vómitos y alteración del estado
cerebral producen angustia y disminución de la calidad de
vida en los últimos estadios de la progresión del cáncer;
además, la patología puede llevar a un daño renal y
generalmente se asocia con mal pronóstico, con
supervivencia mediana de sólo 30 días de los pacientes que
reciben terapia antihipercalcémica.5 Los
bisfofonatos son potentes inhibidores de la resorción ósea,
y por este motivo resultan la terapia más efectiva para la
HPM; la administración endovenosa de pamidronato en dosis
de 60 a 90 mg por perfusión durante 2 a 4 horas ha sido
considerado el tratamiento estándar desde principios de los
años '90. En estudios que investigaron varias dosis (30 a
90 mg) y programas de administración de pamidronato, se
observó un índice de remisión completa (RC) de 40% al
100% en los 7 días siguientes a la perfusión endovenosa
intensiva de fluidos para la hidratación, y la duración de
la respuesta en promedio fue desde los 11 días hasta las 3
o 4 semanas.1,6-12 El ácido zoledrónico es un
bisfosfonato de nueva generación que contiene nitrógeno en
su estructura, y en estudios preclínicos ha demostrado ser
más potente que otras drogas de la misma clase comúnmente
disponibles, incluido el pamidronato.13
Recientemente se realizaron de forma simultánea dos
estudios idénticos, multicéntricos, aleatorizados y a
doble ciego (uno en los EE.UU. y Canadá, y el otro en
Europa y Australia), con el fin de investigar la efectividad
clínica del ácido zoledrónico (4 mg y 8 mg) vs. 90
mg de pamidronato para el tratamiento de la HPM moderada a
severa. El análisis conjunto especificado en los protocolos
de los datos obtenidos en estas 2 pruebas, publicado en el Journal
of Clinical Oncology en enero del 2001,14
demostró que 4 mg u 8 mg de ácido zoledrónico fueron
superiores a 90 mg de pamidronato para el tratamiento de
HPM. Los resultados de este análisis conjunto son
brevemente resumidos a continuación.
PACIENTES Y METODOS
Para participar de estas pruebas, los pacientes debían
tener HPM moderada a severa, definida mediante un nivel
basal de calcio sérico corregido (CSC) ≥ 3.00 mmol/l
(12.0 mg/dl). Esta es una concentración bastante elevada de
calcio sérico en comparación con los valores requeridos
para comenzar otros estudios con bisfofonatos.
Los participantes fueron tratados en forma aleatorizada
por vía endovenosa con una dosis única de ácido zoledrónico
(4 mg u 8 mg) durante 5 minutos o con pamidronato (90 mg)
durante 2 horas. La terapia con bifosfonatos fue
administrada de forma simultánea con hidratación
endovenosa (en total, 500 ml de fluidos durante 4 horas).
Los pacientes recibieron 250 ml del fluido antes de la
perfusión con la droga en estudio, mientras que el resto
del liquido para hidratación fue administrado como parte de
una perfusión por doble simulación, lo cual mantuvo la
característica de doble ciego de la muestra. Esto quiere
decir que cada paciente recibió: (a) la administración por
5 minutos de ácido zoledrónico seguida de 2 horas de
perfusión salina, finalizando con otras 2 horas de
administración de fluidos, o (b) primero recibió una
solución salina durante 5 minutos seguida por la
administración de pamidronato por 2 horas, finalizando con
la perfusión durante 2 horas de fluidos. Cabe destacar que
este régimen de hidratación es mucho menos agresivo que el
utilizado en otros ensayos con bisfosfonatos, incluidos los
efectuados previamente con pamidronato, que a menudo
requieren hidratación endovenosa durante 24 a 48 horas
antes de la administración de los fármacos en estudio.
Se efectuó el seguimiento de los pacientes durante 56 días
o hasta la recaída; ésta fue definida por una concentración
de CSC ≥ igual a 2.90 mmol/l (11.6 mg/dl). El
tratamiento con ácido zoledrónico (8mg) fue reiniciado en
los pacientes refractarios al tratamiento inicial, cuando la
concentración de CSC respecto al nivel basal no disminuyó
más de 0.05 mmol/l (0.2 mg/dl) en el día 4 o no más de
0.25 mmol/l (1.0 mg/dl) en el día 7, o si al décimo día
el CSC fue ≥ mayor o igual a 2.90 mmol/l. Los
pacientes refractarios a la terapia inicial o que tuvieron
recaída dentro de los 56 días de iniciado el tratamiento
con ácido zoledrónico o pamidronato fueron tratados
nuevamente con una dosis única de 8 mg de ácido zoledrónico
por perfusión endovenosa durante 5 minutos y posteriormente
seguidos durante 28 días.
El criterio principal para evaluar los tratamientos fue
la proporción de pacientes con RC, definida como la
normalización de la concentración de CSC a valores ≤
2.70 mmol/l (10.8 mg/dl) al décimo día. Otros criterios clínicos
de comparación importantes incluyen el tiempo de recaída
de la HPM, duración de la respuesta, eficacia del
tratamiento repetido por recaída o refractariedad, y el
grado de seguridad de los fármacos. La metodología estadística
ha sido descripta en detalle con anterioridad.14
RESULTADOS
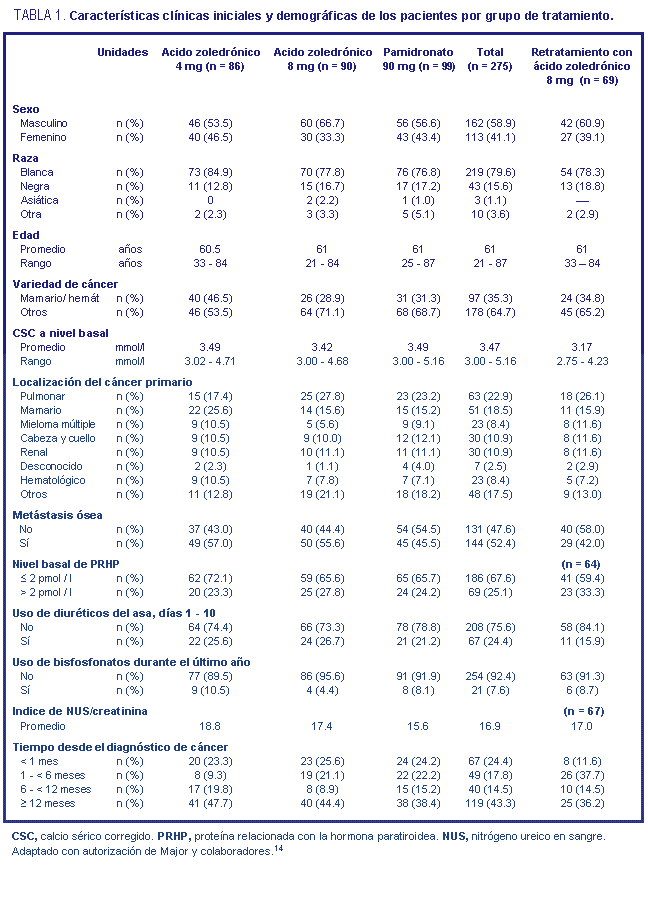
Características clínicas iniciales y demográficas de los
pacientes
Un total de 287 pacientes fueron seleccionados al azar, y
275 fueron elegidos para el análisis de eficacia (población
por protocolo); de estos participantes, 86 integraron el
grupo tratado con 4 mg de ácido zoledrónico, 90 fueron
administrados con 8 mg de esta droga, y 99 recibieron el
tratamiento con 90 mg de pamidronato. Las características
clínicas iniciales y demográficas fueron en general
comparables entre los grupos en estudio (tabla 1),14
con aproximadamente 60% de pacientes hombres y 80% de raza
blanca. La proporción de participantes con proceso maligno
a nivel mamario o hematológico fue mayor en el grupo
tratado con 4 mg de ácido zoledrónico que en los
restantes.
Indice de remisión completa
En el análisis primario efectuado al décimo día, 88.4% (p
= 0.002) de los pacientes tratados con 4 mg de ácido zoledrónico
y 86.7% (p = 0.015) de los que recibieron 8 mg alcanzaron la
RC; en cambio, sólo 69.7% de los participantes bajo
tratamiento con pamidronato obtuvieron tal respuesta. Por
otra parte, el porcentaje de RC fue mayor en los pacientes
administrados con ácido zoledrónico al 4to. y al 7mo. día
(figura 1),14 y no hubo diferencias
significativas entre los grupos bajo tratamiento con 4 mg u
8 mg en ningún momento durante el transcurso del trabajo.
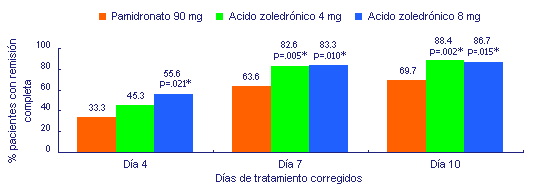
Figura 1. Porcentaje de pacientes que alcanzaron la
remisión completa (CSC ≤ 2.7 mmol/l [10.8 mg/dl]). (*),
significación estadística vs. pamidronato.
(Correción por día: día 4 = días 2 a 5; día 7 = días
6 a 8; día 10 = días 9 a 11.)14
Además, los niveles promedio de CSC en los días 4, 7 y
10 fueron significativamente menores (p ≤ 0.05) en
pacientes tratados con ácido zoledrónico respecto de los
que recibieron 90 mg de pamidronato (figura 2).14
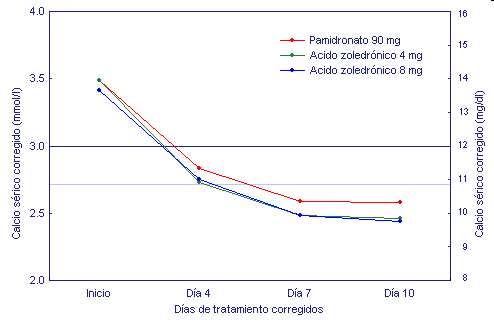
Figura 2. Calcio sérico corregido promedio al
inicio y en los días 4, 7 y 10 siguientes al tratamiento
de la hipercalcemia con ácido zoledrónico (4 mg u 8 mg)
o pamidronato (90 mg). Si no se encuentra el valor de
calcio, se considera el último valor obtenido.14
Fueron evaluados diversos factores con valor pronóstico,
pero el ácido zoledrónico demostró ser efectivo a pesar
de los niveles iniciales de CSC, concentración de proteína
relacionada con la hormona paratiroidea (PRHP) o presencia o
no de metástasis (tabla 2).14
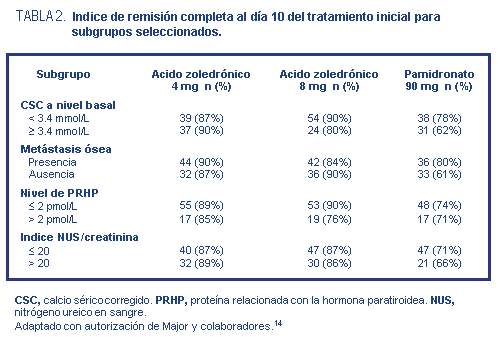
El porcentaje de pacientes con RC al décimo día fue
similar entre los participantes con CSC inicial < 3.4 o
≥ 3.4 mmol/l (13.6 mg/dl). Además, la RC en el día
10 fue similar dentro de cada grupo en tratamiento
independientemente de los niveles basales de PRHP, del índice
de nitrógeno ureico/creatinina en sangre, de la edad, sexo
o variedad de cáncer. Los índices de RC en los grupos
administrados con ácido zoledrónico fueron similares pese
a la presencia de metástasis ósea. Sin embargo, entre los
participantes tratados con pamidronato, sólo el 61% de los
pacientes sin metástasis obtuvieron la RC al décimo día vs.
80% de los que padecían esta patología.
Duración de la remisión completa y tiempo de recaída
El tiempo promedio de recaída en pacientes tratados con 4
mg u 8 mg de ácido zoledrónico fue de 30 días (p = 0.001)
y 40 días (p = 0.007) respectivamente, mientras que en los
receptores de pamidronato fue de 17 días (figura 3).14
Entre los pacientes que alcanzaron la RC, la duración
mediana de la respuesta fue de 32 y 43 días para los
tratados con 4 mg u 8 mg de ácido zoledrónico,
respectivamente, en tanto en el grupo al que se administró
pamidronato fue de 18 días.
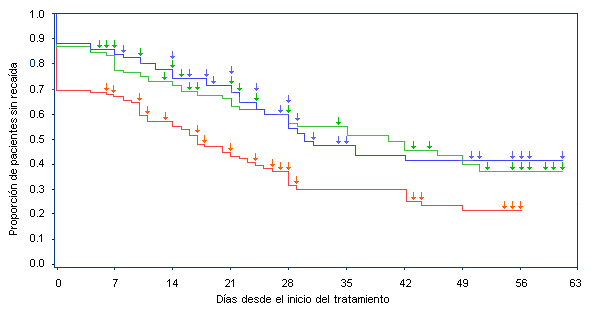
Figura 3. Estimación de Kaplan-Meier del tiempo de
recaída por hipercalcemia luego del tratamiento con ácido
zoledrónico 4 mg, 8 mg o pamidronato 90 mg. Las flechas
indican los momentos de registro.14
Retratamiento con ácido zoledrónico
Se efectuó un nuevo tratamiento con 8 mg de ácido zoledrónico
en 70 pacientes que sufrieron recaída luego de haber
alcanzado la RC o que fueron refractarios (n = 15) al
tratamiento inicial con ácido zoledrónico o pamidronato; sólo
69 participantes fueron evaluados respecto a la eficacia.
Las características demográficas de este grupo analizado
fueron similares en su mayoría a las de la población
participante del estudio completo. Aproximadamente 33% de
pacientes tuvieron niveles iniciales de PRHP > pmol/l.
Luego del retratamiento con 8 mg de ácido zoledrónico, los
valores medios del CSC disminuyeron desde 3.17 mmol/l
basales (es decir, después del tratamiento inicial) a 2.17
mmol/l en el día 10; además, se determinó que 36
participantes (52%) alcanzaron la RC al décimo día. La
duración de la RC fue en promedio de 10.5 días, la duración
mediana de la respuesta fue de 15 días y la mediana del
tiempo hasta la recaída, de 8 días.
Seguridad
Los efectos adversos más comúnmente informados (fiebre,
anemia, náuseas, constipación y disnea) ocurrieron con
frecuencia similar entre los grupos tratados con ácido
zoledrónico y con pamidronato (tabla 3).14
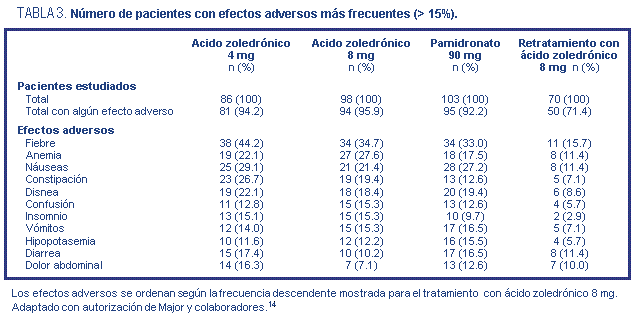
Las reacciones adversas posiblemente relacionadas con la
droga en estudio incluyeron fiebre, hipofosfatemia e
hipocalcemia asintomática. Fueron informados efectos
secundarios a nivel renal, con más frecuencia en los grupos
tratados con ácido zoledrónico; a pesar de esto, la
incidencia de cambios en la creatinina sérica de grado 3 o
4 fue baja y similar entre los grupos en tratamiento (tabla
4).14

DISCUSION
Entre las pruebas clínicas efectuadas hasta el momento, éstas
fueron las de mayor magnitud, realizadas de forma
prospectiva, aleatorizada y comparativa, con el fin de
evaluar 2 bisfosfonatos en pacientes con HPM. Los datos de
eficacia demuestran que el ácido zoledrónico (en dosis de
4 mg u 8 mg) es superior a 90 mg de pamidronato para el
tratamiento de HPM moderada a severa. La primera de estas
drogas normalizó el calcio sérico dentro de los 4 a 10 días
en un porcentaje significativamente alto de pacientes; además,
estos participantes mantuvieron niveles de calcio sérico clínicamente
aceptables por un tiempo mucho mayor que los individuos
tratados con 90 mg de pamidronato.
Debido a que la administración de 4 mg de ácido zoledrónico
fue tan efectiva como la de 8 mg en la población total de
HPM, la primera resultó la dosis recomendada. A pesar de
que la administración de 8 mg puede producir duración de
la respuesta levemente mayor, no se recomienda su utilización
por el gran potencialidad de daño renal. Luego de realizado
el presente trabajo, se efectuaron 3 pruebas en más de 3
000 pacientes con metástasis ósea, o lesiones como tumores
sólidos o mieloma múltiple; estos estudios demostraron la
amplia eficacia del ácido zoledrónico y su superioridad en
comparación con el pamidronato para el tratamiento y
prevención de las complicaciones óseas. En dichos ensayos,
las dosis repetidas de 8 mg de ácido zoledrónico
produjeron riesgo mayor de elevación de la creatinina sérica;
además, las pruebas demostraron que la perfusión durante
15 minutos de ácido zoledrónico (administrado cada 3 a 4
semanas) se asocia con riesgo menor de daño renal, en
comparación con su perfusión por 5 minutos. Por lo tanto,
basada en la mayor experiencia con el ácido zoledrónico,
la recomendación actual sobre su dosificación es de 4 mg
mediante perfusión por 15 minutos.15,16 A pesar
de que pocos pacientes respondieron al retratamiento, el índice
de respuesta del 52% observado en participantes con recaída
o HPM refractaria es importante. La poca respuesta al
retratamiento con bifosfonatos en la HPM ha sido sugerida en
otras pruebas con menor número de pacientes.17,18
Una de las inquietudes acerca de estos trabajos fue el índice
de respuesta menor al esperado (70%) con la administración
de 90 mg de pamidronato, ya que en pruebas anteriores sobre
HPM se informó que había normalizado el CSC en el 100% de
los pacientes.10,19,20 A pesar de esto, existen
diversas explicaciones razonables acerca de esta diferencia;
entre los factores que pueden contribuir están los cambios
en el tratamiento del cáncer y el diseño de los estudios.
En trabajos previos con pamidronato, se evaluó sólo un número
pequeño de pacientes (10 a 20) con una dosis de 90 mg, y
los niveles basales de CSC eran inferiores a los 3.49 mmol/l
(13.95 mg/dl) considerados en el grupo tratado con
pamidronato en los trabajos actuales.
Además, los estudios anteriores requirieron de 24 a 48
horas de hidratación endovenosa previa al tratamiento con
bifosfonatos, y hubo variaciones entre los trabajos respecto
al grado de hipercalcemia requerida para iniciar el estudio
y la definición de la respuesta.18 Es importante
considerar que la presente fue una prueba prospectiva y
aleatorizada con tratamientos equilibrados.
Otros dos bisfosfonatos que contienen nitrógeno también
han sido evaluados para el tratamiento de HPM en pequeñas
pruebas de fase II. Por ejemplo, en un estudio reciente de
147 participantes con un CSC iniciaal promedio de 3.4
mmol/l, la administración de ibandronato (4 mg o 6 mg por vía
endovenosa) normalizó los niveles de calcio sérico en 76%
y 77% de los pacientes, respectivamente.21 La
respuesta fue dependiente de la dosis administrada, de la
severidad de la hipercalcemia y de la variedad tumoral (los
pacientes con cáncer mamario y tumores hematológicos
tuvieron mejor respuesta que los participantes con otra
clase de tumor).
En otro pequeño estudio en que participaron 59 pacientes
con un CSC inicial mayor o igual a 2.88 mmol/l, la
administración de dosis únicas de 5 mg, 10 mg o 15 mg de
alendronato sódico permitió la RC en el 74% de los
individuos.18 La tasa de respuesta mas elevada
(90%) fue alcanzada con 15 mg de la droga, pero solo 10
pacientes recibieron dicha dosis. Estos estudios sugieren
que tales fármacos también tienen actividad en el
tratamiento de HPM, pero en ausencia de pruebas comparativas
aleatorizadas resulta dificultoso analizarlos con respecto a
la administración de 90 mg de pamidronato o de 4 mg de ácido
zoledrónico.
El ácido zoledrónico fue bien tolerado en el presente
estudio, con un perfil de seguridad total similar al de 90
mg de pamidronato. La hipocalcemia y la hipofosfatemia
ocurren con un poco más de frecuencia en pacientes tratados
con ácido zoledrónico en comparación con los que reciben
pamidronato, lo que puede obedecer a su actividad farmacológica
más potente. Debido a que todos los bisfosfonatos
endovenosos pueden ocasionar daños en el funcionamiento
renal y que la HPM también puede afectarlo de modo adverso,
la monitorización de la creatinina sérica es muy
importante en la práctica de rutina; esta determinación ha
de efectuarse especialmente cuando los pacientes presentan
patologías subyacentes o concomitantes asociadas con daño
renal, o cuando tienen función renal disminuida antes del
tratamiento.
En conclusión, la administración de 4 mg de ácido
zoledrónico mediante perfusión endovenosa durante 15
minutos proporciona un tratamiento mas efectivo y
conveniente para la HPM que el pamidronato, con niveles de
seguridad similar. Además, esta droga puede ser considerada
como el nuevo tratamiento estándar para la HPM. Desde su
aprobación en el año 2001, el ácido zoledrónico ha sido
aceptado de manera entusiasta por la comunidad médica
mundial, e igualmente es preferido por los pacientes que
toman en cuenta la conveniencia del menor tiempo de perfusión.
BIBLIOGRAFIA
- Gucalp R, Theriault R,
Gill I, Madajewicz S, Chapman R, Navari R, et al.
Treatment of cancer-associated hypercalcemia.
Double-blind comparison of rapid and slow intravenous
infusion regimens of pamidronate disodium and saline
alone. Arch Intern Med. 1994;154:1935-1944.
- Stewart AF, Horst R,
Deftos LJ, Cadman EC, Lang R, Broadus AE. Biochemical
evaluation of patients with cancer-associated
hypercalcemia: evidence for humoral and nonhumoral
groups. N Engl J Med. 1980;303:1377-1383.
- Mundy GR, Ibbotson KJ,
D'Souza SM, Simpson EL, Jacobs JW, Martin TJ. The
hypercalcemia of cancer: clinical implications and
pathogenic mechanisms. N Engl J Med. 1984;310:1718-1727.
- Lang-Kummer J.
Hypercalcemia. in: Groenwald SL, Goodman M, Froggee MH,
et al, eds. Cancer Nursing: Principles and Practice. 3rd
ed. Sudbury, Mass: Jones and Bartlett Publishers;
1993:644-661.
- Ralston SH, Gallacher SJ,
Patel U, Campbell J, Boyle IT. Cancer-associated
hypercalcemia: morbidity and mortality. Clinical
experience in 126 treated patients. Ann Intern Med.
1990;112:499-504.
- Body JJ, Borkowski A,
Cleeren A, Bijvoet OL. Treatment of
malignancy-associated hypercalcemia with intravenous
aminohydroxypropylidene diphosphonate. J Clin Oncol.
1986;4:1177-1183.
- Body JJ, Magritte A, Seraj
F, Sculier JP, Borkowski A. Aminohydroxypropylidene
bisphosphonate (APD) treatment for tumor-associated
hypercalcemia: a randomized comparison between a 3-day
treatment and single 24-hour infusions. J Bone Miner
Res. 1989;4:923-928.
- Cantwell BM, Harris AL.
Effect of single high dose infusions of
aminohydroxypropylidene diphosphonate on hypercalcemia
caused by cancer. Br Med J (Clin Res Ed). 1987;294:
467-469.
- Gucalp R, Ritch P, Wiernik
PH, Sarma PR, Keller A, Richman SP, et al. Comparative
study of pamidronate disodium and etidronate disodium in
the treatment of cancer-related hypercalcemia. J Clin
Oncol. 1992;10:134-142.
- Nussbaum SR, Younger J,
VandePol CJ, Gagel RF, Zubler MA, Chapman R, et al.
Single-dose intravenous therapy with pamidronate for the
treatment of hypercalcemia of malignancy: comparison of
30-, 60-, and 90-mg dosages. Am J Med. 1993;95:297-304.
- Sawyer N, Newstead C,
Drummond A, Cunningham J. Fast (4-h) or slow (24-h)
infusions of pamidronate disodium
(aminohydroxypropylidene diphosphonate [APD]) as single
shot treatment of hypercalcemia. Bone Miner.
1990;9:121-128.
- Thiébaud D, Jaeger P,
Jacquet AF, Burckhardt P. A single-day treatment of
tumor- induced hypercalcemia by intravenous
amino-hydroxypropylidene bisphosphonate. J Bone Miner
Res. 1986;1:555-562.
- Green JR, Müller K,
Jaeggi KA. Preclinical pharmacology of CGP 42´446, a
new, potent, heterocyclic bisphosphonate compound. J
Bone Miner Res. 1994;9:745-751.
- Major P, Lortholary A, Hon
J, Abdi E, Mills G, Menssen HD, et al. Zoledronic acid
is superior to pamidronate in the treatment of
hypercalcemia of malignancy: a pooled analysis of two
randomized, controlled clinical trials. J Clin Oncol.
2001;19:558-567.
- Rosen LS, Gordon D,
Kaminski M, Howell A, Belch A, Mackey J, et al.
Zoledronic acid versus pamidronate in the treatment of
skeletal metastases in patients with breast cancer or
osteolytic lesions of multiple myeloma: a phase III,
double-blind, comparative trial. Cancer J.
2001;7:377-387.
- Saad F, Gleason DM, Murray
R, Tchekmedyian S, Venner P, Lacombe L, et al. A
randomized, placebo-controlled trial of zoledronic acid
in patients with hormone- refractory metastatic prostate
carcinoma. J Natl Cancer Inst. 2002;94:1458-1468.
- Thiebaud D, Jaeger P,
Burckhardt P. Response to retreatment of malignant
hypercalcemia with the bisphosphonate AHPrBP (APD):
respective role of kidney and bone. J Bone Miner Res.
1990;5:221-226.
- Nussbaum SR, Warrell RP
Jr, Rude R, Glusman J, Bilezikian JP, Stewart AF, et al.
Dose-response study of alendronate sodium for the
treatment of cancer-associated hypercalcemia. J Clin
Oncol. 1993;11:1618-1623.
- Purohit OP, Radstone CR,
Anthony C, Kanis JA, Coleman RE. A randomised
double-blind comparison of intravenous pamidronate and
clodronate in the hypercalcaemia of malignancy. Br J
Cancer. 1995;72:1289-1293.
- Ostenstad B, Andersen OK.
Disodium pamidronate versus mithramycin in the
management of tumour-associated hypercalcemia. Acta
Oncol. 1992;31:861-864.
- Ralston SH, Thiébaud D,
Herrmann Z, Steinhauer EU, Thurlimann B, Walls J, et al.
Dose-response study of ibandronate in the treatment of
cancer-associated hypercalcaemia. Br J Cancer.
1997;75:295-300.
|
|
 ELINAFIDA,
ESTADO ACTUAL DE UNA NAFTALIMIDA ACTIVA ELINAFIDA,
ESTADO ACTUAL DE UNA NAFTALIMIDA ACTIVA
|

|
Columnista
Experto de SIIC
Tamila L. Kindwall-Keller, DO
Medical Oncology Fellow, Division of Hematology/Oncology.
Arthur G. James Cancer Hospital and Richard J Solove
Research Institute, The Ohio State University, Columbus,
Ohio, EE.UU.
en colaboración con
Miguel A. Villalona-Calero, MD. Medical Oncologist,
Associate Professor of Medicine. Division of
Hematology/Oncology. Arthur G. James Cancer Hospital and
Richard J Solove Research Institute, The Ohio State
University
Otro trabajo publicado: Villalona-Calero M, Kolessar J:
"Mitomycin C as a Modulator of Irinotecan Anticancer
Activity", Oncology 16(8, suppl 7): 21-25, 2002 |
Columbus, EE.UU. (especial
para SIIC)
La investigación futura deberá
establecer el esquema de quimioterapia con elinafida que se asocie
con la menor toxicidad sin afectar su eficacia.
RESUMEN
La elinafida es una binaftalimida, formada por la unión de dos
grupos naftalimida mediante un grupo de unión alquilamino. Induce
citotoxicidad al intercalarse en el surco mayor de la hélice de
ADN, con lo cual se altera la síntesis de ADN y su transcripción.
Adicionalmente, la elinafida inhibe la actividad catalítica de la
topoisomerasa II por un mecanismo único aún no identificado. En
estudios preclínicos con xenoinjertos de tumores humanos, la
elinafida inhibió el crecimiento en una variedad de modelos
tumorales sólidos, inclusive cáncer de mama, melanoma, cáncer
de pulmón y cáncer de colon. Se realizaron tres estudios clínicos
en fase I para establecer la toxicidad de la elinafida en el
hombre, así como para definir el mejor esquema de dosificación
para un estudio en fase II. Los efectos adversos más
frecuentemente observados con el fármaco son supresión medular y
toxicidad neuromuscular que se manifiesta como debilidad proximal
de las extremidades inferiores. Si bien los estudios de fase I
mostraron efectos tóxicos, también se han observado respuestas
parciales en tumores sólidos refractarios y con recidiva previa,
tales como mesotelioma, cáncer pancréatico, cáncer de mama en
varones refractario a antraciclina, melanoma y carcinoma seroso
papilar del peritoneo, un tumor histológicamente similar al cáncer
de ovario. Además, en pacientes con cáncer de pulmón no a células
pequeñas se apreció estabilización tumoral prolongada. La
actividad antineoplásica tan manifiesta observada con elinafida
en tumores sólidos previamente tratados y refractarios avala
investigaciones futuras para definir con precisión la toxicidad y
eficacia, y para establecer los pasos en su desarrollo como un
nuevo agente antitumoral.
Palabras clave: miotoxicidad, resistencia a drogas,
intercalación en el ADN, elinafida.
ABSTRACT
Elinafide is a bis-naphthalimide formed by joining two
naphthalimide groups with an alkylamino linker. It induces
cytotoxicity by bis-intercalating into the major groove of the DNA
helix causing disruption of DNA synthesis and transcription.
Additionally, elinafide inhibits topoisomerase II catalytic
activity by a unique and yet unidentified mechanism. In
preclinical studies using human tumor xenografts, elinafide
inhibited tumor growth in a variety of solid tumor models
including breast cancer, melanoma, lung cancer and colon cancer.
Three clinical phase I studies have been performed to access the
toxicity of elinafide in humans as well as to find the best dosing
administration schedule to take to a phase II trial. The most
common toxicities seen with the administration of elinafide
included myelosuppression and a neuromuscular toxicity manifested
by proximal lower extremity weakness. Despite the toxicities of
elinafide on the phase I trials, several partial responses were
seen in previously relapsed and refractory solid tumors including
mesothelioma, pancreatic cancer, anthracycline refractory male
breast cancer, melanoma, and papillary serous carcinoma of the
peritoneum, a tumor histologically similar to ovarian cancer.
Prolonged stabilization was also seen in patients with non- small
cell lung cancer. The impressive anti-neoplastic activity seen
with elinafide in previously treated refractory solid tumors
suggests that further studies of determinants of toxicity and
activity are warranted for elinafide. Information from these
studies would increase or understanding of elinafide and provide
new insights into its development as an anti-tumor agent.
Key words: myotoxicity, drug resistance, DNA
intercalation, elinafide
Las naftalimidas son una nueva clase de agentes que se
intercalan en el ADN e inhiben la topoisomerasa. Fueron
desarrolladas para incorporar componentes estructurales esenciales
de varias moléculas antitumorales bien definidas, como ácido
aristolóquico, tilorona, CG-603 y cicloheximida, en una molécula
única.1 La elinafida (LU 79553),
N,N'-bis[2-(1,8-naftalimido)etil]-1,3-diaminopropano
bimetanosulfonato, es una binaftalimida formada por la unión de
dos moléculas de naftalimida mediante un grupo alquilamino
(figura 1).2,3

Figura 1.
Estructura química
de la LU 79553, la mitonafida y la amonafida. Fuente:
Villalona-Calero MA, et al: "Phase I and Pharmacokinetic
Study of LU79553, a DNA Intercalating Bisnaphthalimide, in
Patients With Solid Malignancies", J Clin Oncol
19(3):857-869, 2001. Reimpreso con autorización de la American
Society of Clinical Oncology.
La elinafida tiene mayor afinidad de unión al ADN que las
mononaftalimidas debido a que se intercala en el surco mayor de la
hélice del ADN, con lo cual mejora la citotoxicidad in vitro
e in vivo.4-8 Debido a que la elinafida no tiene
sustituciones amina en los grupos naftalimida, no se metaboliza
por N- acetilación. Por este motivo, las diferencias farmacogenéticas
del fenotipo acetilador no se asocian con diferencias
interindividulaes en el metabolismo tal como se observa con la
amonafida, una mononaftalimida.6 Los estudios de
investigación mostraron que la elinafida induce citotoxicidad por
la doble intercalación en el surco mayor de la hélice del ADN,
con lo cual se interrumpe la síntesis del ADN, la transcripción
y la segregación cromosómica.5-7,9 Además, la
elinafida inhibe la actividad catalítica de la topoisomerasa II
mediante un mecanismo de acción único que aún no se ha
identificado con precisión.6 En forma llamativa, la
elinafida no estabiliza el complejo de ADN-topoisomerasa II tal
como lo hacen fármacos como doxorrubicina, VP-16 y m-AMSA.6
La elinafida tiene mayor citotoxicidad en líneas celulares
tumorales humanas y xenoinjertos que la mitonafida y la amonafida.
La elinafida también fue eficaz en tumores con resistencia a múltiples
drogas asociada con mayor expresión de glucoproteína P y por la
alteración de la topoisomerasa II. Sin embargo, en estos casos se
requieren concentraciones mayores de la droga para inducir la
misma citotoxicidad que en tumores no resistentes.6
ESTUDIOS PRECLINICOS
En estudios preclínicos, la elinafida demostró actividad
antineoplásica sustancial en sistemas de cultivo de tejidos y
xenoinjertos tumorales humanos; fue evaluada en líneas celulares
humanas y murinas, y mostró ser potente agente citotóxico.
Aproximadamente el 75% de todas las células tumorales
evaluadas en ensayo de formación de colonias tumorales se inhibió
con elinafida en una concentración de 1 µM, mientras que las células
de cáncer de mama, pulmón, melanoma y ovario se inhibieron con
concentraciones de 0.1 µM.10 Respecto de xenoinjertos
tumorales humanos, la elinafida mostró efecto curativo en modelos
de cáncer de mama precoz y avanzado (MX-1) y melanoma (LOX).6
LLamativamente, se obtuvieron regresiones parciales y
ocasionalmente curación en el modelo de carcinoma pulmonar menos
sensible (LX-1)6 Ocasionalmente, en modelos de
carcinoma de colon (CX-1, DLD-1) se comprobaron regresiones
parciales y en la mayoría de los tumores se constató un retardo
en el crecimiento del tumor.6 La administración en
forma diaria durante 5 días, dos veces por semana o semanalmente
fue más eficaz que un único tratamiento.6 Los
estudios de toxicidad en ratas, ratones y perros mostraron efectos
en tejidos con rápida proliferación, como el hematopoyético, el
linfoide y los órganos gastrointestinales. Las dosis letales o
casi letales evidenciaron degeneración del músculo cardíaco y
del músculo esquelético en estudios posmortem de roedores y
perros. Otro efecto relacionado con la droga, cuando se utilizaron
dosis más altas, fue la inflamación en el sitio de la inyección
y cambios inflamatorios en nefronas e intersticio del riñón que
no revirtieron por completo.6
ESTUDIOS CLINICOS
La marcada actividad antitumoral en estudios in vivo e in
vitro, incluso en neoplasias resistentes a múltiples fármacos,
y las ventajas metabólicas en comparación con amonafida,
motivaron que la elinafida se estudiara en el hombre. Los ensayos
de seguridad se realizaron simultáneamente con una variedad de
esquemas diseñados para determinar la máxima dosis tolerada y la
relación entre el esquema empleado, la toxicidad y metabolismo.
En la tabla 1 se resume la toxicidad en relación con el aumento
gradual de la dosis, tal como se registró en dichos estudios.
La primera investigación evaluó elinafida administrada una
vez cada 21 días en pacientes con tumores sólidos.11
Con dosis de inicio de 10 mg/m2, la primera manifestación
de toxicidad fue inflamación en el sitio de la inyección. A
causa de la flebitis química, se empleó un catéter venoso
central en los enfermos que debían recibir 100 mg/m2 o
más por infusión. En forma global, 50 pacientes con cáncer de
pulmón, colorrectal, de páncreas y de mama recibieron 120 ciclos
de quimioterapia, en promedio dos ciclos por enfermo. La dosis
recomendada en este estudio se definió en 100 mg/m2/ciclo
cuando la elinafida se administró cada tres semanas. La
mielosupresión y un síndrome neuromuscular lentamente reversible
fueron las toxicidades limitantes de dosis a 120 mg/m2/ciclo.
Tres de seis pacientes tratados con dicha dosis presentaron
neutropenia y trombocitopenia grado 3 o 4 y síntomas
neuromusculares grado 3.
El estudio fue luego realizado con un nuevo esquema de
dosificación, en el cual la elinafida se repitió cada 6
semanas;11 como pareció tolerarse, se administraron dosis de
hasta 160 mg/m2. Sin embargo, 8 de 9 enfermos tratados
con este esquema tuvieron progresión de la enfermedad antes de
que pudiera repetirse el segundo ciclo, lo cual limitó la
posibilidad de evaluar la toxicidad acumulada. Cabe mencionar que
un paciente que recibió 70 mg/m2 de elinafida cada
tres semanas desarrolló descenso asintomático en la fracción de
eyección del ventrículo izquierdo de 63% antes del tratamiento a
43% 15 días después del segundo ciclo de elinafida. Se
registraron dos respuestas parciales, una en un enfermo con un
mesotelioma y otra en un paciente con cáncer de páncreas.11
La segunda investigación evaluó elinafida administrada
semanalmente durante tres semanas consecutivas, cada cuatro
semanas. En 27 individuos pudo determinarse la toxicidad12
El incremento consistió en 5 a 35 mg/m2 por semana sin
toxicidad mayor. En dosis de 45 mg/m2 por semana se notó
debilidad muscular proximal en extremidades inferiores en 3 de los
6 enfermos tratados. Esta toxicidad grado 2 fue reversible en
todos los casos. Sin embargo, cuando la dosis se elevó a 60 mg/m2
por semana, 4 de 6 sujetos experimentaron debilidad muscular grave
y uno de ellos falleció por parálisis bulbar y aspiración.12
Un enfermo desarrolló miocardiopatía dilatada y su fracción de
eyección descendió de 65% a 35% con dosis de elinafida de 60
mg/m2.12 La evaluación posmortem reveló
miocardiopatía que simuló cardiotoxicidad por antraciclina (M.
Martín, comunicación personal).
La creatinquinasa se elevó en el 50% de los enfermos del
estudio; las biopsias musculares practicadas en cuatro de ellos
mostraron compromiso miopático con fibras necróticas y depósitos
granulares eosinofílicos. Además, se obsevó mielosupresión en
relación con dosis de 60 mg/m2 por semana, con
neutropenia grado 4 en 3 de 6 pacientes y un episodio de sepsis
neutropénica y muerte. Un hombre con cáncer de mama refractario
a antraciclina tuvo una respuesta parcial en una metástasis
pleural y un enfermo con melanoma metastásico tuvo 50% o más de
reducción en el tamaño y número de los nódulos pulmonares
metastásicos aunque simultáneamente aparecieron lesiones en el
sistema nervioso central.12 Finalmente, con un esquema
diario durante 5 días cada tres semanas, 30 enfermos con tumores
sólidos avanzados recibieron 105 cursos de elinafida en dosis que
osciló de 2 a 24 mg/m2/día administrados en 30
minutos a 3 horas.13 El principal efecto adverso no
hematológico de este esquema fue la miopatía proximal acumulada,
que imposibilitó la repetición del tratamiento en dosis
superiores a los 18 mg/m2 por día. Un hombre desarrolló
miopatía proximal grave y disfunción eréctil además de
neutropenia breve grado 4 luego del tercer curso de elinafida en
dosis de 24 mg/m2/día. En otro enfermo se vio disfunción
eréctil grave, miopatía proximal moderada y neutropenia breve
grado 4 luego del tercer curso con el mismo nivel de dosis. La
creatinquinasa sérica se elevó en estos individuos y la
electromiografía demostró actividad espontánea y de inserción
con potenciales miopáticos pequeños de unidades motoras con
reclutamiento precoz. La biopsia muscular de ambos pacientes reveló
depósitos de material granular fino azul verdoso e inclusiones
citoplasmáticas pleomórficas (figura 2).


Figura 2.
Cortes
tisulares representativos de biopsia muscular en un paciente con
miopatía clínica13. (Izquierda) Coloración tricrómica
Gomori (x 440). (Derecha) Microscopia electrónica (x 2 900). Las
flechas indican inclusiones citoplasmáticas. Fuente:
Villalona-Calero MA, et al: "Phase I and Pharmacokinetic
Study of LU79553, a DNA Intercalating Bisnaphthalimide, in
Patients With Solid Malignancies", J Clin Oncol
19(3):857-869, 2001.
Reimpreso con autorización de la American Society of Clinical
Oncology.
La evaluación muscular ultraestructural con microscopía
electrónica mostró alteración miofibrilar grave y cuerpos
citoplasmáticos semejantes a los que se observan en la miopatía
miofibrilar. A diferencia de los otros dos estudios en los cuales
uno de los enfermos presentó cierta toxicidad cardiológica, la
función cardíaca no se alteró en forma sustancial en esta
investigación. La fracción de eyección ventricular izquierda
según el MUGA (multiple gated acquisition) estuvo dentro
de los parámetros normales y no hubo diferencias entre los
valores pretratamiento y postratamiento. En forma similar a las
investigaciones previas, fue necesaria la infusión por un acceso
venoso central por la flebitis química en el sitio de infusión.
La enfermedad se mantuvo estable durante 7 a 10 meses en dos
pacientes con cáncer pulmonar no a células pequeñas que habían
tenido progresión durante la quimioterapia basada en platino.13
Además, se comprobó respuesta parcial en una mujer con carcinoma
seroso papilar del peritoneo luego de recibier 6 cursos de
elinafida en dosis de 14 mg/m2/día. Su enfermedad había
progresado en forma rápida luego de quimioterapia conque incluyó
carboplatino/ciclofosfamida y paclitaxel/cisplatino antes de
recibir elinafida. En forma llamativa, la respuesta parcial en
esta enferma persistió aún después de completar 20 cursos
totales y en el momento de comenzar un nuevo regimen de
quimioterapia 22 meses después del inicio de la elinafida. Aunque
no se registró toxicidad que limitara la dosis durante el primer
curso en ninguna de las dosis analizadas, debido a la toxicidad
acumulada observada, los autores recomendaron dosis de 18 mg/m2/día.
FARMACOCINETICA
El estudio farmacocinético permitió la evaluación del
comportamiento farmacológico de la elinafida en diferentes
esquemas de administración. En forma global, el fármaco tiene
una vida media prolongada (50 a 80 horas) y luego de la
administración repetida se acumula moderadamente en plasma.11-13
La farmacocinética de la elinafida no fue dosis dependiente; la
exposición sistémica aumentó en forma lineal con el aumento de
la dosis en los tres estudios. La fracción de droga intacta
excretada por orina fue baja, inferior al 5% de la dosis y no
dependió de ella13 El modelo de tres compartimientos
fue el que mejor describió la relación plasmática entre
concentración y tiempo. El volumen de distribución en el estado
de equilibrio determinado mediante este modelo fue amplio,
aproximadamente 100 veces mayor que el volumen del compartimiento
central, lo cual indicó rápida distribución en los tejidos
periféricos seguida de dos fases más lentas de disponibilidad.
Debido a que el estudio farmacocinético se realizó durante el
primer ciclo, y en virtud de que la toxicidad apareció luego de
dos o tres ciclos de terapia, es difícil determinar la relación
entre la concentración plasmática y la toxicidad. Sin embargo,
en el estudio de cinco administraciones diarias, los valores del
área bajo la curva de concentración vs. tiempo (ABC)
fueron superiores en pacientes que presentaron miopatía grado 2 o
mayor o neutropenia grado 4 en comparación con los pacientes que
no tuvieron estas manifestaciones.13
DISCUSION
La capacidad única de intercalarse en el ADN y el modo de
interacción con la topoisomerasa II, en combinación con su
potencia, amplio espectro y actividad frente a tumores
refractarios hacen que elinafida sea un agente muy interesante
desde el punto de vista antitumoral. Su exclusivo mecanismo de
acción depende de dos grupos cromóforos ligados por una unión
alquilamino. Los grupos cromóforos se intercalan en el surco
mayor de la hélice de ADN, con lo cual se altera su síntesis y
transcripción.
En virtud de los resultados de los estudios preclínicos, las
investigaciones revelaron un patrón único de toxicidad y de
actividad en enfermedades malignas refractarias.
Los hallazgos clínicos, de laboratorio y electrofisiológicos
en los estudios clínicos realizados hasta la fecha indican que la
elinafida induce un proceso miopático primario.
Este fenómeno se confirmó mediante estudios
ultraestructurales en biopsias de músculo de los pacientes
afectados. Asimismo, en dos de tres investigaciones se comprobó
el compromiso del músculo cardíaco.
Los mecanismos por los cuales el fármaco es tóxico a nivel
muscular periférico y cardíaco se desconocen. En sujetos que
ingirieron grandes cantidades de clorhidrato de emetina por
infección crónica por Entamoeba histolytica se describió
una miopatía proximal similar. Lo mismo ocurrió en personas con
trastornos de la alimentación y abuso de jarabe de ipecacuana,
como inductor de emesis, cuyo principal componente es el
clorhidrato de emetina.14,15 Las manifestaciones
neuromusculares del clorhidrato de emetina son debilidad, dolor,
dolor a la palpación y rigidez de los músculos esqueléticos
especialmente en el cuello y en las extremidades proximales. La
debilidad y malestar en los músculos proximales remiten luego de
la interrupción del tratamiento con clorhidrato de emetina. Las
aminotrasferasas séricas, la creatinquinasa y la aldolasa se
elevan en forma moderada. La electromiografía revela aumento de
la actividad de inserción, fibrilaciones y potenciales de
unidades motoras miopáticas en la musculatura comprometida. La
velocidad de conducción motriz y sensitiva no muestra
alteraciones remarcables. En estos enfermos también puede
sobrevenir dolor torácico, taquicardia, disnea, hipotensión y
alteraciones electrocardiográficas. Es de notar que la
miocardiopatía dilatada asociada con insuficiencia cardíaca
congestiva, arritmia y muerte súbita también ha sido descripta
en pacientes que abusan de jarabe de ipecacuana.14,15
Aunque el mecanismo de toxicidad de la emetina se desconoce, el
miocardio de ratas tratadas con este agente y con el antitumoral
cicloheximida, que comparte con elinafida el mismo anillo
glutarimida, tiene menor incorporación de leucina en la
actomiosina, necesaria para la contracción.16 En forma
llamativa, el anillo de glutarimida de la elinafida parece ser
responsable de su mayor eficacia en comparación con otras
binaftalimidas.
CONSIDERACIONES PARA EL DESARROLLO FUTURO
La eficacia antitumoral de la elinafida, tal como quedó
ejemplificada en un paciente con carcinoma papilar peritoneal
resistente al platino y al taxano (una neoplasia histológicamente
semejante al cáncer de ovario), justifica la adopción de
diversas estrategias que puedan asociarse con menor toxicidad sin
pérdida de la eficacia antitumoral.
Tal como se muestra en la tabla 1, los datos clínicos sugieren
que existe un umbral de dosis por encima del cual es probable que
aparezcan toxicidad hematológica y toxicidad neuromuscular. Los
resultados de estudios en fase I indican que la dosis única y la
dosis total acumulada pueden ser determinantes clave de toxicidad.
El modelo de tres compartimientos con amplio volumen de distribución
según los datos farmacocinéticos sugiere distribución amplia y
preferencial en el músculo esquelético y cardíaco,
probablemente en relación con el elevado metabolismo de la droga
en estos tejidos.
Un abordaje posible para eliminar la toxicidad podría ser
aumentar el intervalo de administración y dejar tiempo suficiente
para la depuración de la elinafida o sus metabolitos del músculo
esquelético o cardíaco. Esta estrategia no se asoció con
diferencias significativas en la intensidad de la dosis cuando el
intervalo de administración de una única dosis se aumentó de 3
a 6 semanas (dosis limitante de toxicidad de 120 mg/m2
cada 3 semanas y 160 mg/m2 cada 6 semanas).11
Esto puede tener consecuencias en relación con la actividad
antitumoral del fármaco. Además, en caso de que la toxicidad en
músculo esquelético y cardíaco refleje lesión progresiva por
acumulación de la droga en los tejidos a lo largo del tiempo, un
mayor período entre las exposiciones no sería capaz de reducir
la incidencia y gravedad de la toxicidad sin comprometer la dosis
total administrada. Este fenómeno ha sido documentado en el caso
de la cardiotoxicidad relacionada con doxorrubicina.17-19
La naturaleza acumulativa de la toxicidad por elinafida
probablemente represente mayor nivel tisular del fármaco en
comparación con la concentración en plasma.
En el caso de que exista un umbral pico de concentración por
encima del cual elinafida se distribuye preferentemente en tejido
muscular, no alcanzar ese umbral sería una forma posible de
reducir la incidencia y gravedad de la toxicidad sin afectar la
intensidad de la dosis. Este abordaje sólo sería de valor en
caso de que la exposición del tejido tumoral a la droga ocurra en
concentraciones por debajo del umbral muscular. Si se tiene en
cuenta que cuando un fármaco se administra en forma repetida a
intervalos regulares, la concentración en plasma aumenta hasta
que la eliminación y la administración se igualan, el uso de
dosis más pequeñas a intervalos más cortos reduciría las
oscilaciones en la concentración de la droga. La actividad
antitumoral observada en un paciente que recibió 14 mg/m2
diarios durante 5 días hace pensar que la concentración pico
alta no es necesaria en la eficacia antineoplásica.13
El concepto discutido previamente alienta la evaluación de
esquemas de infusión continua, con los cuales se evitan las
concentraciones pico altas.
En resumen, la elinafida es eficaz contra neoplasias sólidas
malignas refractarias. La dosis única y la acumulación de dosis
son hechos importantes en la toxicidad. Se requiere más
investigación para comprender mejor el mecanismo de acción de
este agente así como su perfil de toxicidad. Los resultados de
estas investigaciones aumentarán el conocimiento acerca de la
droga y brindarán nuevas posibilidades de uso como un agente
antitumoral.
BIBLIOGRAFIA
- Brana MF, Castellano JM, Roldan
CM, Santos A, Vazquez D, Jimenez A. Synthesis and mode(s) of
action of a new series of imide derivatives of 3-nitro- 1,8
naphthalic acid. Cancer Chemother Pharmacol. 1980;4:61-66.
- Brana MF, Castellano JM, Moran
M, Perez de Vega MJ, Perron D, Conlon D, Bousquet PF,
Romerdahl CA, Robinson SP. Bis-naphthalimides 3: synthesis and
antitumour activity of N,N'-bis[2-(1,8-naphthalimido)-ethyl]
alkanediamines. Anticancer Drug Des. 1996;11:297-309.
- Brana MF, Castellano JM, Perron
D, Maher C, Conlon D, Bousquet PF, George J, Qian XD, Robinson
SP. Chromophore-modified bis-naphthalimides: synthesis and
antitumor activity of bis-dibenz[de,h]isoquinoline-1,3-diones.
J Med Chem. 1997;40:449- 454.
- Brana MF, Castellano JM, Moran
M, Perez de Vega MJ, Romerdahl CR, Qian XD, Bousquet P, Emling
F, Schlick E, Keilhauer G. Bis-naphthalimides: a new class of
antitumor agents. Anticancer Drug Des. 1993;8:257-268.
- Brana M, Castellano J, Moran M,
et al. Bisnaphthalimides, synthesis and biological activity of
5,6 acenaphthalimido alkyl-1,8-naphthalimidoalkyl-amines. Eur
J Med Chem. 1995;30:235-239.
- Bousquet PF, Brana MF, Conlon D,
Fitzgerald KM, Perron D, Cocchiaro C, Miller R, Moran M,
George J, Qian X-D, Keilhaur G, Romerdahl CA. Preclinical
evaluation of LU 79553: a novel bis-naphthalimide with potent
antitumor activity. 1995;55:1176-1180.
- Bailley C, Brana M, Waring MJ.
Sequence-selective intercalation of antitumour bis-
naphthalimides into DNA. Evidence for an approach via the
major groove. Eur J Biochem. 1996;240:195-208.
- Romerdahl C, Brana M.
Bisnaphthalimides, synthesis and pre-clinical evaluation, in
Teicher B (ed). Cancer Therapeutic: Experimental and Clinical
Agents. Totowa, NJ, Humana Press Inc, 1997.
- Gallego J, Reid BR. Solution
structure and dynamics of a complex between DNA and the
antitumor bisnaphthalimide LU-79553: intercalated ring
flipping on the millisecond time scale. Biochemistry.
1999;38:15104-15115.
- Villalona-Calero M, Degen D,
Bousquet P, Von Hoff D. LU 79553: evaluation by human tumor
clonogenic assay of a novel naphthalimide. Proc Am Assoc
Cancer Res. 1996;37:398.
- Hanauske A-R, Awada A, Thödtmann
R, Höppener F, Wanders J, von Broen I-M, Piccart MJ. A phase
I study of LU 79553 administered every 21 days in patients
(pts) with solid tumors: and EORTC/ECSG study. Proc Am Soc
Clin Oncol. 1998;17:234a.
- Martín M, Casado A, Benavides
A, Alonso JL, Garcia-Carbonero I, Sastre J, Moreno E, Díaz-Rubio
E. Phase I study of elinafide in solid tumors. Ann Oncol.
1998;9(suppl2):63.
- Villalona-Calero MA, Eder JP,
Toppmeyer DL, Allen LF, Fram R, Velagapudi R, Myers M, Amato
A, Kagen-Hallet K, Razvillas B, Kufe DW, Von Hoff DD, Rowinsky
EK. Phase I and pharmacokinetic study of LU79553, a DNA
intercalating bisnaphthalimide, in patients with solid
malignancies. J Clin Oncol. 2001;19:857-869.
- Palmer EP, Guay AT. Reversible
myopathy secondary to abuse of ipecac in patients with major
eating disorders. N Eng J Med. 1985;313:1457-1459
- Adler AG, Walinsky P, Krall RA,
Cho SY. Death resulting from ipecac syrup poisoning. J Am Med
Assoc. 1980;243:1927-1928.
- Beller BM. Observations on the
mechanism of emetine poisoning of myocardial tissue. Circ Res.
1968;22:501-505.
- Von Hoff DD, Laynard MW, Basa P,
Davis HL Jr, Von Hoff AL, Rozencweig M, Muggia FM. Risk
factors for doxorubicin-induced congestive heart failure. Ann
Intern Med. 1979;91:710-717
- Stewart DJ, Grewaal D, Green RM,
Mikhael N, Goel R, Montpetit VA, Redmond MD. Concentrations of
doxorubicin and its metabolites in human autopsy heart and
other tissues. Anticancer Res. 1993;13:1945-1952.
- Legha SS, Benjamin RS, Mackay B,
Ewer M, Wallace S, Valdivieso M, Rasmussen SL, Blumenschein
GR, Freireich EJ. Reduction of doxorubicin cardiotoxicity by
prolonged continuous intravenous infusion. Ann Intern Med.
1982;96:133-139
|
 RIESGO DE
LINFOMA NO HODGKIN ASOCIADO CON LA ENFERMEDAD CELIACA RIESGO DE
LINFOMA NO HODGKIN ASOCIADO CON LA ENFERMEDAD CELIACA
|
|

|
Dr.
Carlo Catassi
Investigador del Center for Celiac Research, University of
Maryland. Profesor del Departamento de Pediatría, Universitá
di Ancona.
Ultimo trabajo publicado: Risk of non-Hodgkin lymphoma in
celiac disease, JAMA 287(11):1413-1419, 2002 |
|
Baltimore, EE.UU. (especial
para SIIC)
El doctor Carlo Catassi
respondió a las preguntas del Columnista Experto de SIIC, doctor
William Dickey, sobre su trabajo acerca del riesgo de linfoma
asociado con la enfermedad celíaca. El doctor Dickey es
Consultor en Gastroenterología del Altnagelvin Hospital, en
Londonderry, Irlanda del Norte, y autor del trabajo ”Identificación
de la enfermedad celíaca en la atención primaria, <
http://www.siicsalud.com/dato/dat013/99d09026.htm>.
Las investigaciones conducidas por el doctor Catassi
demostraron que la enfermedad celíaca se asocia con un riesgo
aumentando de padecer linfoma no-Hodgkin, especialmente afectando
a linfocitos T, y en el tracto intestinal.
Según explicó a SIIC, estas conclusiones fueron
obtenidas en un estudio de casos y controles realizado entre 1996
y 1999 en varios centros de investigación italianos. Los casos
fueron más de 650 pacientes mayores de 20 años con linfoma
no-Hogkin en cualquier localización primaria y de cualquier tipo
histológico. Los controles, más de 5 000 hombres y mujeres
sanos.
Todos los participantes fueron sometidos a pruebas de detección
de anticuerpos antiendomisio de tipo A, a partir de las cuales se
diagnosticó la enfermedad celíaca.
El doctor Catassi observó que el 0.92% de los pacientes
con linfoma padecía además enfermedad celíaca, en comparación
con el 0.42% de los controles. Entre los primeros, además,
predominaron los tumores a células T, y los localizados en el
intestino.
El experto, quien ha publicado trabajos en las revistas Journal
of the American Medical Association y European Journal of
Gastroenterology and Hepatology, destaca que esta asociación, si
bien es significativa, no tiene la importancia suficiente como
para justificar el rastreo masivo de la enfermedad celíaca en los
pacientes con linfoma.
SIIC: Su definición de enfermedad celíaca no tratada se
basó en un resultado positivo en la prueba de detección de
anticuerpos antiendomisio (EmA). Se ha sugerido que hasta el 20%
de los pacientes con enfermedad celíaca no presenta estos
anticuerpos. ¿La exclusión de los pacientes EmA negativos podría
haber afectado sus resultados?
Dr. Carlo Catassi: Soy consciente de la posibilidad de que haya
pacientes con enfermedad celíaca que no presentan anticuerpos
antiendomisio, aún si la frecuencia de esta situación no está
muy clara todavía (en mi experiencia, es mucho menor del 20%).
Sin embargo, no creo que esta posibilidad pueda haber afectado
nuestros resultados, ya que los casos y los controles fueron
incluidos de manera simétrica de acuerdo con este potencial
factor de selección. En otras palabras, la estimación del riesgo
de padecer linfoma no-Hodgkin no está sesgada, ya que el
porcentaje de pacientes celíacos EmA negativos es el mismo en la
población general (grupo control) como en los pacientes con
linfoma no-Hodgkin inicialmente (grupo de casos). La bibliografía
disponible, por cierto, no indica que exista una respuesta anormal
en los anticuerpos antiendomisio en los pacientes con diagnóstico
reciente de linfoma no-Hodgkin.
SIIC: ¿Cuántos de los pacientes con linfomas
intestinales pequeños exhibían atrofia vellosa, o exceso de
linfocitos intraepiteliales indicadores de enteropatía
relacionada con el gluten, aún en ausencia de anticuerpos
antiendomisio?
C.C.: Esta es una pregunta muy interesante. Lamentablemente no
puedo responderla, ya que el protocolo de nuestro estudio no
requería el control de las biopsias intestinales de los pacientes
con resultados negativos para los anticuerpos antiendomisio, a
menos que el diagnóstico de enfermedad celíaca se hubiese
realizado antes de la aparición del linfoma no-Hodgkin.
SIIC: El linfoma a menudo tiene un pronóstico
desfavorable. Usted ha sugerido que la detección de la enfermedad
celíaca y su tratamiento podrían ser beneficiosos para estos
pacientes, a pesar de que el hecho de seguir una dieta libre de
gluten es difícil. ¿Qué pacientes verían una mejora más
importante en su calidad de vida con esta medida?
C.C.: Yo considero que la calidad de vida podría mejorarse en
los pacientes con linfoma no- Hodgkin en cualquier localización
primaria y de cualquier tipo histológico, tratando la enfermedad
celíaca asociada. La absorción de drogas que requieren un
transporte a través de la mucosa del intestino delgado puede
mejorarse en los pacientes con linfoma no-Hodgkin y enfermedad celíaca
activa, mediante una dieta libre de gluten.
Desde la perspectiva de la salud pública, sin embargo, nuestro
estudio sugiere que el rastreo en todos los pacientes con linfoma
no-Hodgkin en el momento del diagnóstico probablemente no tenga
una buena relación entre el costo y la eficacia, ya que el riesgo
de que haya enfermedad celíaca asociada es bastante bajo.
Por otro lado, sería definitivamente recomendable realizar el
rastreo de la enfermedad celíaca en los pacientes con linfoma a células
T o linfoma intestinal (incluyendo el de células B), ya que este
subgrupo de pacientes con linfoma no-Hodgkin muestra un riesgo
elevado de padecer enfermedad celíaca asociada.
SIIC: ¿Cree que debemos mencionar el riesgo de este tipo
de enfermedad maligna a los pacientes celíacos recientemente
diagnosticados, algunos de los cuales se niegan a seguir una dieta
libre de gluten, en especial si sus síntomas son leves?
C.C.: Dado que el riesgo de linfoma es al parecer bastante
bajo, creo que es éticamente apropiado mencionarlo sin asustar al
paciente remarcando excesivamente este evento poco probable. Yo
acostumbro a discutir la necesidad de la dieta libre de gluten,
informando al paciente que este tipo de alimentación en general
mejora el bienestar psicofísico en los afectados por la
enfermedad celíaca (aún en la llamada forma silenciosa), y que
puede, en cierta medida, prevenir la mayoría de las
complicaciones a largo plazo, especialmente la osteoporosis, la
anemia y la infertilidad.
SIIC: ¿Planean realizar nuevas investigaciones sobre
este tema?
C.C.: No. Por otra parte, mis colegas y yo estamos participando
en un estudio europeo cuyo objetivo es verificar nuestros
resultados, en una muestra más numerosa de pacientes. Este
estudio, que es realizado con fondos aportados por la Unión
Europea, ha completado recientemente la etapa de reclutamiento de
pacientes y controles.
Los resultados de la investigación del doctor Catassi
muestran que existe una relación entre el linfoma no Hodgkin y la
enfermedad celíaca, si bien por el momento no se justifica el
rastreo de los pacientes con ambos cuadros
 INVESTIGAN LAS MUTACIONES GENETICAS ASOCIADAS CON EL
CANCER DE MAMA Y OVARIO
INVESTIGAN LAS MUTACIONES GENETICAS ASOCIADAS CON EL
CANCER DE MAMA Y OVARIO
|
|

|
Dr. John
O. Schorge
Profesor Asistente, División de Oncología Ginecológica,
University of Texas Southwestern Medical Center.
Ultimo trabajo publicado: Germline BRCA1-2 mutations in
non-Ashkenazi families with double primary breast and
ovarian cancer Gynecologic Oncology 83(2):383-387,
2001.
|
Dallas, EE.UU. (especial
para SIIC)
En una entrevista concedida al doctor
Mariano Martín-Loeches de la Lastra, el doctor John
Schorge presentó los resultados de su estudio sobre las
mutaciones genéticas en pacientes con cáncer primario doble de
mama y ovario. El doctor Martín-Loeches de la Lastra es
Facultativo Especialista en Obstetricia y Ginecología del
Hospital «Marina Alta» de Denia, Alicante, y de la Sección de
Ginecología Oncológica del Hospital Universitario «La Fe», en
Valencia, España. Ha publicado diversos trabajos como Columnista
Experto de SIIC, entre ellos “Síndrome antifosfolipídico
primario y gestación. Protocolos de actuación del Servicio de
Obstetricia del Hospital «Marina Alta» de Denia (Alicante)” (http://www.siicsalud.com/dato/dat022/01228000.htm).
El doctor Schorge estudió la incidencia de las mutaciones
en los genes BRCA1 y BRCA2, en mujeres con cáncer primario de
mama y de ovario. La relación entre estas alteraciones genéticas
y la presencia de esta patología doble se había observado
previamente en mujeres de ascendencia judía ashkenazi.
El trabajo, explicó el investigador, se realizó entre
pacientes pertenecientes al University of Texas Southwestern
Familial Cancer Registry, que fueron sometidas a un análisis genético
completo.
Según concluyó el experto, el 62% de las familias con al
menos un miembro afectado por la patología doble presentaba
alguna mutación en los genes estudiados.
El doctor Schorge comentó sus conclusiones en su diálogo
con SIIC. Sus trabajos científicos anteriores fueron
publicados en revistas como Gynecologic Oncology, Journal of
Reproductive Medicine y Cancer Research, entre otras.
SIIC: Doctor Schorge, ¿qué hallazgos previos a su
estudio existían sobre la relación entre las mutaciones de los
genes BRCA1 y 2 y el cáncer de mama y ovario, en mujeres
ashkenazi?
Dr. John Schorge: Las mujeres de la población judía ashkenazi
que desarrollan cáncer primario tanto en la mama como en el
ovario tienen una elevada prevalencia (del 57%) de mutaciones de
la línea germinal en los genes BRCA1 (185delAG, 5382insC) y BRCA2
(6174delT)1. Sin embargo, el 62% de las mujeres ashkenazi que
desarrollan solamente cáncer ovárico, y el 30% de las que
padecen solamente cáncer de mama de aparición temprana (antes de
los 40 años) son también portadoras de una mutación2.
En la población ashkenazi, aquellas mujeres que desarrollan cáncer
de mama o de ovario tienen una elevada probabilidad de ser
portadoras de mutaciones en los genes BRCA1 y BRCA2,
independientemente de si son diagnosticadas con la enfermedad
primaria doble.
SIIC: ¿Cuál es la relación entre la prevalencia de las
mutaciones de los genes BRCA1 y 2 y el cáncer primario doble de
mama y ovario en la población que usted estudió, y en otros
grupos investigados?
J.S.: La mayoría de las mujeres que viven en los Estados
Unidos no es descendiente de la población ashkenazi. En nuestro
estudio de personas de otros orígenes étnicos, seis de cada
siete mujeres sometidas a una prueba genética (el 86%), que padecían
cáncer primario doble de mama y ovario, eran portadoras de
mutaciones en los genes BRCA1 y BRCA23. Es interesante destacar
que estas mutaciones ocurrían en ambos genes, lo cual enfatiza la
necesidad de realizar una secuenciación completa en esta población.
El doctor Shih y sus colaboradores informaron que 27 de 32
familias con un miembro con cáncer primario doble de mama y
ovario (el 84%) tenían una mutación en el gen BRCA1 o BRCA2,
pero no estratificaron sus resultados de acuerdo con el origen étnico4.
SIIC: Ustedes concluyeron que estas mutaciones son
frecuentes en mujeres con al menos una familiar con cáncer
primario doble de mama y ovario. ¿Este hallazgo justifica el
rastreo de la mutación en todas las mujeres de la familia?
J.S.: Se debería ofrecer un asesoramiento a las pacientes
afectadas y a sus familias, para estimar su riesgo de ser
portadoras de las mutaciones en estos genes. Las mujeres de
ascendencia no ashkenazi que deseen someterse a las pruebas genéticas
deberían poder acceder a una secuenciación completa, porque es
poco probable que sean portadoras de una de las tres mutaciones
fundadoras judías.
A pesar de que la realización de las pruebas en las mujeres
que ya han desarrollado la patología primaria doble puede no
tener una influencia directa sobre su manejo clínico, la
identificación de la alteración genética brinda información
muy valiosa en cuanto a la evaluación del riesgo de sus
familiares. Si se identifica la mutación, las familiares de
primero y segundo grado pueden someterse a pruebas de elevada
exactitud. Las pacientes con mutaciones de las líneas germinales
del BRCA1 y BRCA2 deben ser asesoradas individualmente sobre la
iniciación de un protocolo de rastreo para la detección temprana
del cáncer de mama u ovario, o sobre la realización de cirugías
profilácticas.
SIIC: El 7% de las familias de este estudio tenía al
menos un miembro con cáncer primario doble de mama y ovario. ¿Este
porcentaje es similar al observado en la población general de los
Estados Unidos y de otros países?
J.S.: El porcentaje de familias con un miembro, por lo menos,
con cáncer primario doble de mama y ovario depende de la población
que se estudie. En nuestra investigación, 62 familias (el 7%) tenían
un miembro con esta patología doble. Sin embargo, las 900
familias que se inscribieron en el University of Texas
Southwestern Familial Cancer Registry entre 1992 y 2000
presentaban ya un riesgo aumentado de padecer cáncer, a partir de
los antecedentes familiares3.
Este porcentaje representa a un grupo de muy alto riesgo, y es
de esperarse que sea mucho más bajo en la población general.
Lamentablemente, existen pocos datos disponibles sobre la
frecuencia del cáncer primario doble de mama y ovario en la
población general de los Estados Unidos o de cualquier otro país.
SIIC: ¿Qué porcentaje de las portadoras de estas
mutaciones tenían dos o tres miembros de su familia afectadas por
esta patología doble?
J.S.: Tres de las 13 familias con resultados positivos en las
pruebas de detección de las mutaciones de los genes BRCA (el 23%)
tenían dos miembros con la patología doble. Otras tres familias
con dos miembros afectados no se sometieron a las pruebas genéticas.
A pesar de que no identificamos a ninguna de ellas, las
investigaciones futuras deberán determinar si ciertas mutaciones
de los genes BRCA1 y BRCA2 predisponen a las mujeres a padecer cáncer
primario doble. La mayoría de las pacientes de ascendencia no
ashkenazi con patología doble de nuestro estudio (el 57%) había
padecido cáncer de mama precediendo al de ovario, más de 1 año
antes (el intervalo promedio fue de 9.5 años).
Basándonos en nuestros resultados, el diagnóstico de cáncer
de mama debería llevar a los médicos a evaluar la historia
familiar de la paciente, y a realizar la derivación apropiada
para aquellas que estén en riesgo de ser portadoras de mutaciones
en los genes BRCA1 y BRCA2. Se debería ofrecer un asesoramiento
genético a las sobrevivientes de cáncer de mama de ascendencia
no ashkenazi con una familiar con cáncer primario doble. En la
mayoría de las circunstancias existe un lapso de tiempo amplio
para iniciar una intervención profiláctica eficaz3.
SIIC: De acuerdo con sus resultados, las mutaciones del
gen BRCA1 son más frecuentes que las del BRCA2 en esta población.
¿Se observa esta misma relación en la población general?
J.S.: Nosotros observamos que las mutaciones del BRCA1 se
presentaban con una frecuencia más de cinco veces superior a las
del BRCA2 en nuestro estudio3. El doctor Shih y su equipo
informaron un aumento de la frecuencia de ocho veces en pacientes
con cáncer primario doble de mama y ovario4. Los estudios
realizados en los Estados Unidos5 y en otros países6,7 han
informado en forma coincidente una mayor incidencia de las
mutaciones de la línea germinal en el gen BRCA1 que en el BRCA2,
en investigaciones basadas en poblaciones.
SIIC: Usted mencionó una mutación que “se encuentra más
allá de la región del ‘cluster’ del cáncer de ovario”. ¿Podría
describir esta región, y la importancia de esta mutación
adicional?
J.S.: Las mutaciones heredadas del gen BRCA2 contribuyen al cáncer
de ovario con una menor importancia en general que las del BRCA1.
Una familia en nuestro estudio tenía la mutación 6985delCT del
gen BRCA2. Esta se encuentra más allá de la región de 3.3
kilobases considerada como “cluster del cáncer de
ovario”, en el exón 11 del gen BRCA2. El área está delimitada
por los nucleótidos 3035 y 6629, y se ha informado previamente
que predispone a las pacientes al mayor riesgo de cáncer de
ovario relacionado con el cáncer de mama8. Nuestros hallazgos
indican que el riesgo de desarrollar cáncer de ovario puede ser
menor, pero no estar ausente, cuando las mutaciones ocurren fuera
de esta región del gen BRCA2.
Las observaciones del doctor Schorge indican que las
mutaciones de los genes BRCA1 y BRCA2 predisponen a las mujeres a
padecer cáncer primario doble de mama y ovario. Como destaca el
investigador, este hecho debería servir para identificar a las
pacientes en riesgo, e iniciar una profilaxis eficaz.
Referencias:
1. Fishman A, Dekel E,
Chetrit A, et al. Patients with double primary tumors in the
breast and ovary- -clinical characteristics and BRCA1-2 mutations
status. Gynecol Oncol 2000;79:74-8.
2. Abeliovich D, Kaduri L, Lerer I,
et al. The founder mutations 185delAG and 5382insC in BRCA1 and
6174delT in BRCA2 appear in 60% of ovarian cancer and 30% of
early-onset breast cancer patients among Ashkenazi women. Am J
Human Genet 1997;60:505-14.
3. Schorge JO, Mahoney NM, Miller
DS, et al. Germline BRCA1-2 mutations in non-Ashkenazi families
with double primary breast and ovarian cancer. Gynecol Oncol
2001;83:383-7.
4. Shih HA, Nathanson KL, Seal S,
et al. BRCA1 and BRCA2 mutations in breast cancer families with
multiple primary cancers. Clin Cancer Res 2000;6:4259-64.
5. Shih HA, Couch FJ, Nathanson KL,
et al. BRCA1 and BRCA2 mutation frequency in women evaluated in a
breast cancer risk evaluation clinic. J Clin Oncol 2002;20:994-9.
6. Loman N, Johannsson O,
Kristoffersson U, et al. Family history of breast and ovarian
cancers and BRCA1 and BRCA2 mutations in a population-based series
of early-onset breast cancer. J Natl Cancer Instit
2001;93:1215-23.
7. Meindl A; German Consortium for
Hereditary Breast and Ovarian Cancer. Comprehensive analysis of
989 patients with breast or ovarian cancer provides BRCA1 and
BRCA2 mutation profiles and frequencies for the German population.
Int J Cancer 2002;97:472-80.
8. Gayther SA, Mangion J, Russell
P, et al. Variation of risks of breast and ovarian cancer
associated with different germline mutations of the BRCA2 gene.
Nat Genet 1997;15:103-5.
|
|
Trabajos Distinguidos,
Serie Oncología, integra el Programa
SIIC-ASARCA de Educación Médica Continuada
|
|

