INTRODUCCIÓN
El cáncer prostático es una enfermedad maligna frecuente en hombres de más de 50 años. Los estudios por autopsia han demostrado que entre el 65% y el 85% de los pacientes con cáncer prostático en estadios avanzados tienen metástasis óseas [1]. El dolor por metástasis óseas es un problema serio para la calidad de vida y requiere un tratamiento eficaz. La radioterapia con rayo externo es adecuada para el tratamiento de metástasis óseas únicas bien definidas.
Aunque la radiación de medio cuerpo puede ser útil en pacientes con recurrencias difusas o rápidas del dolor, esta terapia se acompaña de efectos colaterales serios. La terapia sistémica con radionúclidos emisores beta parece ser una mejor estrategia para la eliminación o alivio del dolor por metástasis múltiples. Entre los radiofármacos utilizados para el tratamiento paliativo de las metástasis óseas se incluyen 89SrCl3, Na2H32PO4, 131I- BDP3, 90Y, 186Re-HEDP y 153Sm-EDTMP [2-7]. Más recientemente se ha informado que el 85SrCl3, 117mSn-DTPA, 188Re-HEDP y el 188Re-DMSA son eficaces para aliviar el dolor [8-11].
Actualmente, el 89Sr y el 186Re-HEDP son los radiofármacos más utilizados en Europa con este propósito. El 89Sr, un análogo del calcio, es un emisor beta puro con una energía máxima de 1.49 MeV y una vida media física de 50.5 días. El estroncio reemplaza al calcio en la matriz inorgánica del hueso y se acumula en forma proporcional a la formación de hueso. El 186Re es un emisor beta con una energía máxima de 1.07 MeV y una emisión gamma de 137 keV. Su vida media física es de 89.3 horas. El renio es complejado con hidroxietiliden difosfonato (HEDP), el cual se localiza en el hueso por la formación de puentes en la hidroxiapatita. Por su parte, el 188Re-HEDP es un radionúclido nuevo en el área terapéutica, con una vida media física de 16.9 horas, una energía beta máxima de 2.1 MeV y un 15% de componente gamma de 155 keV. Por ser un productor del generador 188W/188Re, tiene una relación costo-beneficio favorable y es una herramienta conveniente para el uso clínico. La corta vida media del 188Re-HEDP permite aplicar dosis de mayor actividad que la utilizada con radion{uclidos de mayor vida media [9].
MÉTODOS
En este estudio se evaluó la influencia del 89Sr, 186Re-HEDP y 188Re-HEDP sobre el alivio del dolor (medido con escala visual analógica [EVA] de 5 segmentos: 0% = sin dolor, 25% = dolor leve, 50% = moderado, 75% = grave, 100% = insoportable), la reducción de la dosis de analgésicos, y los cambios en la calidad de vida (índice de desempeño de Karnofsky [IK]). Antes del tratamiento y a las 4, 8 y 12 semanas postratamiento se realizaron entrevistas con un cuestionario estándar. En los pacientes tratados con 188Re-HEDP la entrevista se realizó también en las semanas 1, 2, 3, 5, 6, 7 y 10 postratamiento. Se consideró que el alivio del dolor era significativo cuando la reducción del índice de dolor era de al menos un 25% sin variación o reducción en el uso de analgésicos.
Entre las semanas 6 y 12 se tomaron semanalmente muestras de sangre para evaluar mediante estudios hematológicos el deterioro de la función de la médula ósea. Los criterios de inclusión en el estudio fueron una imagen positiva por 99mTc-HMDP que mostrara al menos 3 metástasis, dolor óseo refractario a toda otra terapia analgésica y función suficiente de la médula ósea con recuento plaquetario de al menos 105/µl, recuento leucocitario igual o mayor a 3.0 x 103/µl y hemoglobina de al menos 6.0 mmol/l. La quimioterapia y el tratamiento con bisfosfonatos fueron interrumpidos 6 semanas antes de la inyección del radiofármaco. No se incluyeron en el estudios pacientes con dolor por fracturas óseas patológicas, compresión de la médula espinal, columna vertebral inestable, tumores de tejidos blandos que comprimieran los nervios, o cuya expectativa de vida no superara los 4 meses. Se trataron en total 49 pacientes de entre 45 y 87 años (media 61 años) con metástasis óseas diseminadas a partir de una cáncer prostático. Se utilizó 188Re-HEDP (3 034 ± 402 MBq) en 24 casos, 186Re-HEDP (1 366 ± 156 MBq) en 12 casos y 89Sr (151 ± 18 MBq) en 13 casos. Para la terapia con 186Re-HEDP y 188Re-HEDP los pacientes fueron hospitalizados por 2 días debido a las normas sobre protección radiactiva vigentes en Alemania. La terapia con 89Sr se realizó en consultorios externos. Los participantes fueron sometidos a imagenología con 99mTc-HMDP dentro de las 5 semanas previas al estudio y también a las 3 semanas postratamiento para evaluar posibles reducciones en la masa de las metástasis óseas. En cumplimiento con la declaración de Helsinki, todos los pacientes fueron exhaustivamente informados acerca del estudio y los posibles efectos secundarios, y proveyeron consentimiento escrito. El comité local de ética aprobó el estudio. El 188Re-HEDP fue obtenido a partir de un generador 188W/188Re-HEDP basado en alúmina, tal como fue descripto previamente [12]. El 89Sr y el 186Re-HEDP son radiofármacos disponibles comercialmente. La significación de la mejoría en el IK y en la trombocitopenia y la leucopenia fue calculada con una prueba t apareada con un valor alfa de 0.01.
RESULTADOS
En total, 39 de los 49 pacientes (80%) informaron alivio del dolor. Tal alivio se registró en 20 (83%) de los pacientes tratados con 188Re-HEDP, 9 (75%) de los tratados con 186Re-HEDP y 10 (77%) de los tratados con 89Sr. Ninguno de los enfermos con alivio del dolor requirió un aumento en la dosis de analgésicos. Ocho pacientes (16%) pudieron abandonar por completo el uso de analgésicos y se hallaban libres de dolor (4 tratados con 188Re-HEDP, 2 con 186Re-HEDP y 2 con 89Sr). En promedio, los síntomas dolorosos medidos por EVA pasaron del 50% al 25% al cabo de 12 semanas de tratamiento.

Como se muestra en la tabla 1, al cabo de 12 semanas el IK se incrementó un 12% luego de la terapia con 188Re-HEDP, un 8% luego del 186Re-HEDP y un 9% luego del 89Sr. Sin embargo, la diferencia sólo fue significativa para la terapia con 188Re-HEDP. En cuanto a la toxicidad hematológica, la trombocitopenia limitó la dosis aplicada. El hemograma reveló una recuperación lenta, pero no siempre completa, al cabo de 12 semanas en todos los pacientes. Ningún participante tuvo una reducción del recuento leucocitario por debajo de 3.0 x 103/µl. Sólo 5 enfermos sufrieron una reducción del recuento plaquetario por debajo de 105/µl (trombocitopenia grado 1 o grado 2 según la OMS [13]). Tal grado de reducción se registró en 3 pacientes tratados con 89Sr, uno tratado con 188Re-HEDP (figura 1) y uno tratado con 186Re-HEDP.
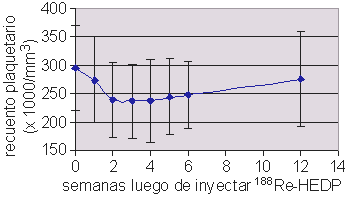
Figura 1.
Deterioro de la médula ósea por la terapia con 188Re-HEDP por alrededor de 6 semanas, expresado como declinación del recuento plaquetario en muestras seriadas de sangre.
El nadir del recuento plaquetario se registró a las 2.9 ± 0.7 semanas del tratamiento con 188Re-HEDP, a las 3.6 ± 1.0 semanas de la terapia con 186Re-HEDP y a las 4.4 ± 1.0 semanas del tratamiento con 89Sr (tabla 2).

Las diferencias máximas entre los recuentos plaquetarios antes y después de la terapia no fueron estadísticamente significativas (p = 0.021 y p = 0.094). Las imágenes óseas con 99mTc-HMDP no mostraron reducciones obvias de las metástasis óseas al cabo de 12 semanas de tratamiento en comparación con las imágenes obtenidas antes de la terapia. Sin embargo, un paciente tratado con 186Re-HEDP tuvo una disminución en el número de metástasis un año después del tratamiento (figuras 2 y 3). El paciente relató un alivio significativo del dolor e interrumpió el consumo de analgésicos 5 semanas después del tratamiento. El IK aumentó de 63% a 75% en 12 semanas. Durante un seguimiento de aproximadamente 2 años el paciente se hallaba libre de dolor.
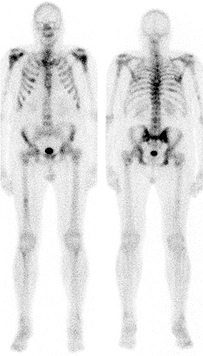
Figura 2.
Imagen de 99mTc de un hombre de 59 años con cáncer prostático, 5 semanas antes de iniciarse el tratamiento con 186Re-HEDP (metástasis óseas múltiples en costillas, esternón, columna vertebral, pelvis, hombros y fémures).
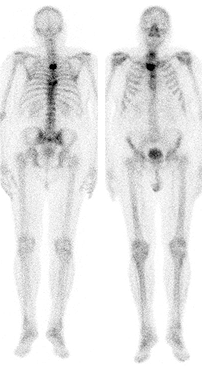
Figura 3.
Imagen de 99mTc del mismo paciente un año después de la terapia con 186Re-HEDP (reducción del número de metástasis óseas en costillas, columna, pelvis, hombros y fémures e incremento en el esternón).
DISCUSIÓN
Existen muchos informes acerca de los efectos terapéuticos de distintos radiofármacos sobre el hueso, con alivio del dolor en el 70% al 85% de los casos [7,10,14-18]. Los informes son escasos sólo en el caso del 188Re-HEDP. Nuestros datos muestran que el 188Re-HEDP, el 186Re-HEDP y el 89Sr tienen una tasa de respuesta comparable que promedia el 80%. Se ha descripto un alivio total del dolor en el 18% al 26% de los pacientes tratados con 186Re-HEDP o 89Sr [18,19]. En este estudio se observó una tasa levemente inferior de ausencia de dolor (16%). Por ser un producto de generador, existe buena disponibilidad de 188Re-HEDP, lo cual permite la marcación in situ de manera similar a lo que ocurre con el generador de 99mTc. En un estudio con dosis incrementales de 188Re-HEDP [10] se observó una tasa de respuesta del 60% con dosis de entre 1 300 y 4 000 MBq y del 66% con una dosis de 3 300 MBq, pero el número de pacientes por grupo de tratamiento era reducido. En 24 enfermos bajo tratamiento con 188Re-HEDP nosotros observamos una tasa de respuesta mayor (83%). En cuanto al IK, sólo los pacientes tratados con 188Re-HEDP tuvieron un aumento estadísticamente significativo de este índice. La trombocitopenia constituyó el efecto tóxico limitante, mientras que la leucopenia tuvo un papel menor [19]. No se observaron efectos secundarios graves relacionados con la toxicidad de la médula ósea, ningún paciente tuvo una disminución de plaquetas a menos de 50000/µl, y sólo uno tuvo menos de 75000/µl. Se ha descripto una declinación reversible en el recuento plaquetario total, con un nadir típicamente entre la cuarta y la sexta semana [19]. En nuestro estudio el nadir se registró entre la segunda y la sexta semana, con una nadir más temprano para el 188Re-HEDP (con una vida media más breve) y un nadir más tardío para el 89Sr (con una vida media más prolongada). Esta diferencia tampoco tuvo significación estadística (p = 0.083 a 0.142). En la literatura se han descripto solamente casos individuales de reducción de las metástasis óseas luego del tratamiento con radionúclidos [15,20]. En nuestro estudio un paciente tratado con 186Re-HEDP tuvo una disminución de metástasis óseas en las imágenes postratamiento obtenidas al cabo de 1 año. La razón de esta reducción puede ser un efecto sinérgico entre las terapias con hormona y con radionúclido. No obstante, estos son sólo casos individuales y el objetivo básico del tratamiento es paliativo.
CONCLUSIÓN
Todos los radiofármacos evaluados fueron eficaces para aliviar el dolor, sin inducir efectos colaterales serios. El IK luego de la terapia con 188Re-HEDP fue estadísticamente superior al alcanzado con los otros radiofármacos.
BIBLIOGRAFIA
- Koslowski JM, Ellis WJ and Grayhack JT: Advanced prostatic carcinoma- early versus late endocrine therapy, Clin North Am 1991; 18:509-524 2.
- Pecher P. Biological investigation with radioactive calcium and strontium. Preliminary report on the use of radioactive strontium in the treatment of metastatic bone cancer, University of California Publications in Pharmacology 1942; 2:117-149 3.
- Friedell HL, Storaassli JP: The use of radioactive phosphorus in the treatment of carcinoma of the breast with widespread metastasis in bone, AJR 1950; 64:559-575 4.
- Eisenhut M, Fritz P, Kimmig B, Wingen F, Krempen B: Iodine-131-labeled diphosphonate for the palliative treatment of bone metastases, Appl Radiat Isot 1986; 37:741-747 5.
- Kutzner J, Hahn K, Grimm W, Brod K, Rösler HP: Treatment of bone metastases of the prostate with yttrium isotope, In Limouris G, Shukla SK(ed.) Radionuclides for prostatic gland. Rome 1991:171-183 6.
- Maxon HR, Schroder L, Thomas SR: Re-186(Sn)HEDP for treatment of painful osseous metastases: initial clinical experience in 20 patients with hormone-resistant prostate cancer, Radiology 1990; 176:155-159 7.
- Collins C, Eary JF, Donaldson G, Vernon C, Bush N, Petersdorf S, Livingston RB, Gordon EE, Chapman CR, Appelbaum FR: Samarium-153-EDTMP in bone metastases of hormon refractory prostate carcinoma, J Nucl Med 1993; 34:1839-1844 8.
- Giammarile F, Mognetti T, Blondet C, Desuzinges C, Chauvot P. Bone pain palliation with 85Sr therapy, J Nucl Med 1999; 40:585-590 9.
- Atkins HL, Mausner LF, Srivastava SC, Meiken GE, Cabahug CJ, D`Alessandro T: Tin- 117m(+4)-DTPA für palliation of pain from osseous metastases: a pilot study, J Nucl Med 1995; 36:725-729 10.
- Palmedo H, Guhlke S, Bender H, Sartor J, Schoeneich G, Risse J, Grünwald F, F.F. [Russ] Knapp Jr, Boersack HJ: Dose escalation study with rhenium-188 hydroxyethylidene diphosphonate in prostate cancer patients with osseous metastases, Eur J Nucl Med 2000; 27:123-130 11.
- Blower PJ, Lam AS, O'Doherty MJ, Kettle AG, Coakley AJ, Knapp FF Jr.. Pentavalent rhenium-188 dimercaptosuccinic acid for targeted radiotherapy synthesis and preliminary animal and human studies, Eur J Nucl Med 1998 Jun; 25(6):613-21.
- Callahan AP, Rice D, Knapp FF jr. Rhenium-188 for therapeutic application from an alumina based tungsten-188/Re-188 radionuclide generator, Am Commun Nucl Med 20:3- 6; 1989 13.
- World Health Organization. WHO Handbook for Reporting Results of Cancer Treatment; Geneve, Switzerland: World Health Organization; 1979: Offset publication 48 14.
- Laing A.H., Ackery D., Bayly J., McEwan A. Strontium-89 chloride for pain palliation in prostatic skeletal malignancy, Brit. J Radiol 1991; 64:816-822 15.
- Robinson R., Blake G., Preston D., McEwan A., Spicer J., Martin N., Wegst A., Ackery D. Strontium-89 Treatment results and kinetics in patients with painful metastatic prostate and breast cancer in bone, Radiographics 1989; 9:271-281 16.
- Maxon H, Schroder L, Hertzberg V, Thomas S, Englaro E. Rhenium-186 HEDP for treatment of painful metastases: Results of a double blind crossover comparison with placebo J Nucl Med 1991; 32:1877-1881 17.
- Palmedo H, Bender H, Schomberg A, Grünwald F, Schöneich G, Zamorra P, Reichmann K, Dierke-Dzierzon C, Mallmann P, Biersack HJ. Schmerztherapie mit Rhenium-186 HEDP bei multiplen Knochenmetastasen. Nuklearmedizin 1996; 35:63-67 18.
- Dafermou A, Colamussi P, Giganti M, Bestagno M, Piffanelli A. A multicentre observational study of radionuclide therapy in patients with painful bone metastases of prostate cancer. Eur J Nucl Med 2001; 28:788-798 19.
- de Klerk J, Zonnenberg B, Schip A, Dijk A, Han S: Dose escalation study of Rhenium- 186 HEDP in patients with metastatic prostata cancer, Eur J Nucl Med 1994; 21:1113- 1110 20.
- Mertens
WC, Porter AT, Reid RH, Powe JE. Strontium-89 and low dose infusion cisplatin
for patients with hormone refractory prostate carcinoma metastatic to bone: a
preliminary report. J Nucl Med 1992; 33:1437-1443

|
Trabajos Distinguidos, Serie Oncología,
integra el Programa SIIC-ASARCA de Educación Médica
Continuad
|
|




![]()