

Volumen 15, Número 6, Agosto 2004
![]()
Asociación
Argentina
del Cáncer
![]()
|
|
|
|
|
|
||
|
Expertos Invitados |
|
|
|
|
 |
Columnista
Experto de SIIC Dr. Alfredo Ribeiro-Silva Médico Assistente. Campo de especialização.Patologia Ginecológica e Mamária. |
|
|
|
|
 |
Columnista
Experto de SIIC Dr. Nobuyuki Tanaka Research Associate. Chest Radiology. |
Introducción Figura 1. Una paciente de 24 años con leucemia mielocítica aguda. La TC de alta resolución a nivel del pulmón medio derecho mostró engrosamiento de los paquetes broncovasculares y de las arterias pulmonares periféricas. La opacidad en vidrio esmerilado está distribuida a lo largo de los paquetes broncovasculares engrosados. 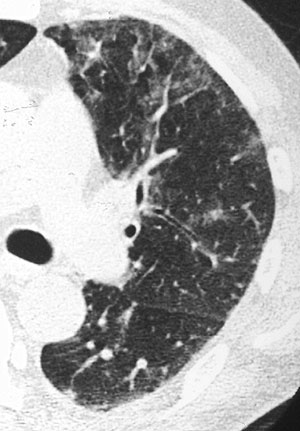 Figura 2. Un paciente de 43 años con leucemia mielocítica aguda. La TC de alta resolución 2 cm por debajo de la carina muestra opacidades en vidrio esmerilado distribuidas a lo largo de los paquetes broncovasculares engrosados y de las arterias pulmonares periféricas acentuadas. 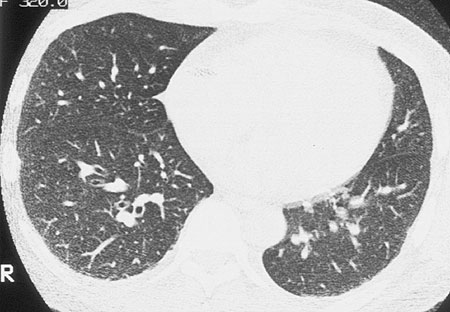 Figura 3. Un paciente de 50 años con leucemia mielocítica crónica. La TC de alta resolución a nivel del bronquio basal no muestra hallazgos anormales excepto por la prominencia leve de las arterias pulmonares periféricas. Este paciente presentó disnea e hipoxia (PaO2 55 mm Hg) cuando su recuento de glóbulos blancos alcanzó 54 000 x 108/l. Luego de comenzada la quimioterapia, el recuento de leucocitos disminuyó y la disnea desapareció. Se pensó que este paciente padecía de leucostasis.Resultados Con respecto a los hallazgos clínicos, con frecuencia se observaron disnea, hipoxia, pirexia y tos. Sorprendentemente, seis de nueve pacientes presentaron hipoxia. El recuento de glóbulos blancos y el porcentaje de blastos fue de 1 100 a 347 500 (promedio 107 778x108/l) y de 0 a 98% (promedio 31%), respectivamente. Los hallazgos individuales de la tomografía computada de alta resolución (TCAR) se muestran en la Tabla 2, y la frecuencias de estos hallazgos en los 11 pacientes previos y en los 9 adicionales se reproducen en la Tabla 3. Se observó que la mayoría de los hallazgos en los 9 pacientes adicionales tuvieron casi la misma frecuencia que en los 11 pacientes previos. En total, el engrosamiento del PBV, la PAP y la OVE no segmentaria se observaron con frecuencia en el 70%, 80% y 85%, respectivamente. Tabla 2 Tabla 3 En esta serie, tres pacientes (los casos 2, 5 y 7) mostraron hallazgos tomográficos leves que no se correspondieron con síntomas pulmonares graves, incluyendo disnea. Estos pacientes podrían haber sido clasificados como casos de "leucostasis". En total, esta condición se evidenció en cuatro casos (uno perteneciente al estudio previo y tres en el estudio presente). Discusión Se piensa que la infiltración pulmonar leucémica clínicamente significativa es rara a pesar del hecho de que la demostración leucémica mediante anatomía patológica en especímenes de autopsias fue relativamente frecuente en informes anteriores.4-7 Al igual que en nuestro trabajo previo,2 la mayoría de los casos en este estudio también presentaron síntomas pulmonares graves. Recientemente, Potenza y col.3 informaron cuatro casos de infiltración pulmonar confirmados por histopatología. Los cuatro pacientes presentaron fiebre, disnea, tos e hipoxia y fallecieron a causa de insuficiencia respiratoria. Debería hacerse hincapié en la posibilidad de una infiltración pulmonar en pacientes con leucemia que presentan síntomas pulmonares graves. Más aun, en dos de cuatro pacientes en el estudio de Potenza no se demostró hiperleucocitosis. Este hecho mostró la posibilidad de una infiltración leucémica en pacientes sin hiperleucocitosis. Los hallazgos tomográficos más frecuentes de la infiltración leucémica en los nueve pacientes incluidos en esta serie fueron el engrosamiento del PBV (82%), PAP (82%) y OVE no segmentaria o no lobulillar (91%), que casi se correspondieron con los resultados de nuestro estudio previo. Por lo tanto, estos resultados sugirieron los conceptos vertidos en nuestra evaluación previa y en el informe de Heyneman y colaboradores.1,2 Las características patológicas de la infiltración pulmonar leucémica han sido descritas en la literatura.5-8 Las células leucémicas infiltran a través de las vías linfáticas que rodean las regiones peribronquiales y perivasculares. Estos cambios patológicos se corresponden con el engrosamiento de los PBV y de la PAP porque los conductos linfáticos se localizan a lo largo de las arterias pulmonares desde el hilio hacia la periferia pulmonar así como de las venas pulmonares. Aunque la correlación entre la TC y los hallazgos patológicos no se mostró en nuestro estudio actual, nuestro informe previo sugirió este concepto de correlación en siete pacientes.2 Una vez más, el hallazgo tomográfico característico de la infiltración leucémica es el engrosamiento en serie del intersticio peribroncovascular desde el hilio hacia las regiones periféricas. La OVE no lobulillar o no segmentaria también se observó con frecuencia en este estudio. Este hallazgo tomográfico se correspondió con los hallazgos patológicos de la infiltración de células leucémicas dentro de los espacios alveolares y los tabiques adyacentes a las arterias pulmonares y los bronquios observado en nuestro estudio previo. Sin embargo, debería señalarse que la OVE a veces se correlacionó con hemorragia, infarto hemorrágico, edema pulmonar y daño alveolar difuso asociado o no con émbolos intravasculares de células leucémicas, que también fueron observados en nuestro estudio previo. Debido a la naturaleza obstructiva de los infiltrados masivos de las células leucémicas dentro de la vasculatura pulmonar, los conglomerados crean posiblemente infartos pulmonares, edema hemorrágico o daño alveolar difuso.4-7,9-12 Esta característica de las células leucémicas también puede causar leucostasis.9,13-16 La disnea grave o la hipoxia podrían ser causadas por émbolos pulmonares en la microvasculatura, aun cuando no se hallen presentes infartos pulmonares, edema o daño alveolar difuso. Más probablemente, las anormalidades tomográficas serán mínimas. La leucostasis ha sido informada como una complicación rara de los pacientes con leucemia. En la evaluación de nuestras dos series, la actual y el anterior, esta entidad se encontró en cuatro de veinte pacientes, por lo que parece ser una condición relativamente frecuente en personas leucémicas. Esta entidad puede considerarse cuando encontramos pacientes leucémicos con síntomas pulmonares graves pero con hallazgos tomográficos con anormalidades mínimas. Existe una limitación en el presente estudio. Se diagnosticó infiltración leucémica en los nueve pacientes adicionales incluidos por sus hallazgos clínicos y de laboratorio sin comprobación histopatológica. Es posible que otras patologías superpuestas se hallan solapado. Sin embargo, creemos que esas otras patologías podrían excluirse mediante la evaluación meticulosa y cuidadosa de los resultados de estudios bacteriológicos y serológicos de los pacientes y por la respuesta a la terapéutica. En conclusión, el engrosamiento de PBV, la PAP y las OVE no lobulillar o no segmentaria fueron los hallazgos tomográficos característicos de la infiltración pulmonar leucémica, los que fueron confirmados por la adición de nueve pacientes al presente estudio. La leucostasis es una entidad relativamente frecuente y debería ser considerada en pacientes con leucemia sin hallazgos tomográficos extensos y con síntomas pulmonares graves. Los hallazgos tomográficos podrían ser indicadores útiles de infiltración pulmonar leucémica. Los autores no manifiestan conflictos.
|
|
|
|
Trabajos Distinguidos, Oncología , integra el Programa SIIC-ASARCA de Educación Médica Continuada |
Bienvenidos
a siicsalud
Acerca de SIIC
Estructura de SIIC
Sociedad Iberoamericana de Información
Científica (SIIC)
Av. Belgrano 430, (C1092AAR), Buenos Aires, Argentina
atencionallector@siicsalud.com;
Tel: +54 11 4342 4901; Fax: +54 11 4331 3305.
Casilla de Correo 2568, (C1000WAZ) Correo Central, Buenos
Aires.
Copyright siicsalud© 1997- 2004, Sociedad Iberoamericana de Información Científica (SIIC)