Introducción
Las imágenes por resonancia magnética (IRM) se utilizan cada vez con mayor frecuencia en pacientes en quienes se sospechan neoplasias hepáticas primarias o secundarias. El tamaño, el número y el compromiso estructural del hígado en las metástasis hepáticas se consideran factores pronósticos principales para la supervivencia. La estadificación precisa del tumor hepático es de fundamental importancia debido a que se puede lograr supervivencia a largo plazo ya que los conceptos de terapéuticas multimodales mejoran de manera continua.
En pacientes con cirrosis, se apoya a las IRM como el método de elección para la evaluación del hígado. Aunque se han descrito características clásicas de las IRM del carcinoma hepatocelular (CHC), las pertenecientes a las imágenes de tumores benignos –como los nódulos displásicos– se solapan con aquellas de tumores malignos. En consecuencia, es importante descartar la presencia del CHC para determinar la elegibilidad de los candidatos a trasplante del órgano.1
Con el progreso permanente de los programas de computación y del equipamiento necesario para la adquisición de imágenes, y la implementación de imágenes paralelas y de las mediadas por la respiración, se pueden lograr barridos tomográficos con cortes múltiples y con gran resolución espacial y temporal durante las imágenes secuenciales obtenidas con contención de la respiración.
Las secuencias en pulsos ponderadas en T2 aportan información sobre el contenido líquido (reflejado por una elevada intensidad de señal elevada) y el contenido de hierro (reflejado por una baja intensidad de señal) y se las utiliza para mejorar la sensibilidad y especificidad, en especial luego de la administración de partículas de hierro oxidadas del sistema retículoendotelial TOPIC. Sin embargo, no es aconsejable confiar solamente en las imágenes ponderadas en T2, ya que algunas metástasis hepáticas que son quísticas (como las del cáncer de ovario) o hipervasculares (como las de los tumores de las células de los islotes pancreáticos) tienen un contenido líquido elevado y, en consecuencia, presentan una elevada intensidad de señal en estas imágenes ponderadas.
El excelente contraste intrínseco que produce el tejido en las IRM no realzadas puede aumentarse aun más mediante el empleo de medios de contraste tisulares específicos y no específicos.
Según el medio de contraste (MC), se aplican protocolos optimizados para detectar las propiedades fisicoquímicas y la biodistribución de los agentes. Las imágenes ponderadas en T1 dinámicas y de fases múltiples se utilizan como protocolo para la detecció n y caracterización de la sospecha de lesiones hepáticas focales con una resolución espacial que resulta comparable a la tomografía computarizada (TC) moderna con detectores múltiples.
Con énfasis sobre las metástasis y el CHC, se pueden diferenciar distintos grupos de MC de acuerdo con sus efectos de contraste, biodistribución y propiedades fisoquímicas.2,3
Medios de contraste para las imágenes del hígado
- MC no específico, extracelular, distribuido dentro del espacio extracelular (EEC).
- MC específicos de tejido (o compartimentos), que evalúan y analizan los hepatocitos, el sistema retículo-endotelial (principalmente las células de Kupffer del hígado, los ganglios linfáticos y el bazo) y el conjunto (pool) sanguíneo (bajo investigación).
MC no específicos, extracelulares
Preparaciones
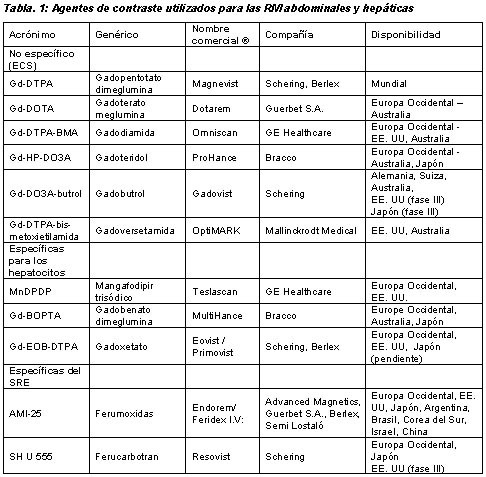
La unión del gadolinio a los complejos hidrofílicos de quelatos evita que el gadolinio forme partículas coloidales que serían fagocitadas por el sistema retículo-endotelial y detiene la toxicidad del gadolinio libre. Aparte del Gd-DTPA (gadopentotato de dimeglumina), un compuesto iónico que se halla disponible desde hace más de diez años, se encuentran en el mercado diversas preparaciones más nuevas como Gd-DOTA (gadoterato meglumina), Gd-DTPA-DMA (gadodiamida), Gd-HP-DO3A (gadoteriol), Gd-DO3 A-but rol (gadobutrol) y Gd-DTPA-bis-metoxietilamida (gadoversetamida) [tabla 1]. Las cuatro últimas no son compuestos iónicos. Sin embargo, en comparación con los MC basados en rayos X, no existen diferencias significativas entre los MC iónicos y no iónicos p ara las IRM en cuanto a la seguridad y tolerabilidad (tasa global de efectos colaterales < 2% con inclusión de todos los efectos indeseables). A pesar de la aprobación y disponibilidad limitadas de algunos de estos MC, se los emplea frecuentemente emplea dos debido a su practicidad.
Biodistribución
Luego de la inyección por vía intravenosa, el MC se distribuye rápidamente dentro del espacio intersticial. Las imágenes dinámicas rápidas ponderadas en T1 bidimensionales y tridimensionales (multifásicas) permiten la visualización de estructuras vasculares y parenquimatosas, delineando diferencias en la vacularización, las diferentes fases en la perfusión de los órganos, y de la tasa de distribución del MC entre el espacio intersticial normal y el tejido patológico.
Características de las imágenes
Las imágenes de fases múltiples aportan patrones de realce que ayudan a la detección y caracterización de lesiones hepáticas focales:
A) La fase dominante de la arteria hepática es el conjunto de datos más importante cuando se emplea un quelante del gadolinio extracelular y no específico. Es crucial capturar el primer pasaje o el realce del lecho capilar de los tejidos durante esta fas e. La demostración de gadolinio en las arterias hepáticas y en las venas porta, y su ausencia en las venas hepáticas son puntos o marcas fidedignos. Esto resulta de importancia debido a que muchas de las lesiones focales, en especial las metástasis y el CHC son perfundidas principalmente por las arterias hepáticas. En el hígado, la obtención de imágenes tempranas en la etapa de “arterias hepáticas solas” disminuye la capacidad de reconocer los patrones distintivos de las metástasis y del CHC. En las imágenes ponderadas en T1 durante la fase dominante de la arteria hepática se pueden observan patrones típicos de realce en diversos tipos de lesiones: los quistes no presentan realce, los hemangiomas muestran con frecuencia realce periférico de tipo nodular en forma de anillo discontinuo, los adenomas no hemorrágicos y la hiperplasia nodular focal presentan un realce intenso y uniforme, en las metástasis se observa realce en anillo, y los CHC muestran un realce difuso y heterogéneo. La capacidad de utilizar esta información para definir lesiones tan pequeñas como de 1 cm puede ser única para las IRM. Las metástasis hepáticas han sido clasificadas como hipovasculares (como por ejemplo, las del cáncer de colon o del carcinoma de células transicionales), hipervasculares (tumores de las células de los islotes, cáncer de mama y carcinoma de células renales), o cercanas a la isointensidad (en referencia a la lesión cuyo realce que es muy semejante al del parénquima hepático). En raras ocasiones las metástasis hepáticas pueden pertenecer a esta última categoría en las imágenes ponderadas en T1 con MC o sin él y en las imágenes con ponderación en T2, por lo que pueden escapar a la detección.
b) Fase correspondiente a la vena porta, adquirida entre los 45 y 60 segundos posteriores al inicio de la inyección de gadolinio. En esta fase se obtiene el realce máximo del parénquima del hígado, por lo cual las lesiones hipovasculares como los quistes , las metástasis hipovasculares y el tejido cicatrizal, se observan con mayor claridad como regiones con un menor refuerzo o realce.
C) La fase venosa hepática o intersticial puede adquirirse entre 90 segundos y 5 minutos luego de la administración del MC. Las características de realce tardío de las lesiones hepáticas focales pueden ayudar en la definición, como el lavado periférico o heterogéneo del contraste en las metástasis hepáticas o el refuerzo de las cicatrices centrales de la hiperplasia nodular focal, así como el llenado sucesivo de los hemangiomas. El realce central tardío aporta información más precisa sobre el grado de necrosis en comparación con las imágenes ponderadas en T2 y las ponderadas en T1 de multifase temprana. El uso simultáneo de técnicas que permiten la supresión del tejido graso es esencial para mejorar la demostración de estos hallazgos.
MC específicos para los hepatocitos
Existen dos tipos diferentes de MC que tienen como blanco los hepatocitos.
Preparaciones
El gadobenato dimeglumina (Gd-BOPTA) y el gadoxetato dimeglumina (GD-EOB-DTPA) son derivados químicos de Gd-DTPA en los cuales el grupo carboxilo está reemplazado por una rama lipofílica. Esto permite que los compuestos sean reconocibles en la membrana plasmática del hepatocito.
Un compuesto con características farmacocinéticas diferentes es el mangafodipir trisódico (Mn-DPDP).
Biodistribución de los derivados del gadolinio
Existen mecanismos de transporte específicos para la captación de este MC hacia el interior de los hepatocitos. Mediante transportadores de aniones orgánicos (TAO), los MC son trasladados hacia el espacio intracelular, donde son metabolizados y excretado s en la bilis (del 2% al 10% para Gd-BOPTA; del 45% al 55%, en el caso de Gd-EOB-DTPA), o eliminados a través de la filtración glomerular. En consecuencia, estos MC podrían describirse como “trifásicos”, con una fase de distribución intravascular, una hepatocitaria (de almacenamiento hepatocelular) y una de eliminación biliar o renal. Además, la inyección rápida permite la realización de estudios comparables a los efectuados con quelatos de Gd.
Biodistribución del manganeso
Se cree que el complejo MnDPDP es transportado hacia el hepatocito y degradado en el plasma. Se presume además que el manganeso libre es transportado, de manera selectiva, hacia el interior del hepatocito. Se puede observar captación en el páncreas, corazón y en otros órganos. El manganeso libre intracelular y plasmático se elimina tanto por vía biliar (50%) como renal, pancreática y por la mucosa gástrica. Este agente se administra en forma de infusión intravenosa lenta, de un minuto de duración.
Características de las imágenes
Por lo general, el mejor contraste entre el parénquima hepático y la lesión se observa durante la fase de almacenamiento en el hígado (aproximadamente entre 20 y 120 minutos posteriores a la inyección). Debido a la falta de hepatocitos, las metástasis presentan, de manera característica, ausencia de realce, mientras que se observa realce en los tumores hepatocelulares benignos o malignos. Esta característica depende del grado de diferenciación del tumor. Los nódulos regenerativos en la cirrosis pueden tener un realce variable, lo que puede obstaculizar la diferenciación entre lesiones benignas y potencialmente malignas. La distinción entre las lesiones que contienen hepatocitos y las que no los contienen podría tener una importancia limitada, debido a que la diferenciación entre lesiones benignas y malignas es crucial.
MC específicos del sistema retículo-endotelial
Preparaciones
Los disponibles en el mercado son el ferucarbotran y las ferumoxidas. En ambas preparaciones, el núcleo de óxido de hierro cristalino (con un diámetro de entre 4 a 5 nm) está cubierto por dextrán (en el caso de las ferumoxidas) o de carbodextrán (para el ferucarbotran), con un tamaño resultante de entre 50 a 150 nm y de 40 a 80 nm, respectivamente.
Biodistribución
Luego de la administración (en el caso de las ferumoxidas, se infunden en un período de 30 minutos mientras que el ferucarbotran puede emplearse en bolo), las partículas son fagocitadas en 8 a 15 minutos por el sistema retículo-endotelial del hígado (80% ), bazo (12%), ganglios linfáticos y médula ósea. Estas partículas se agrupan en los lisosomas del sistema retículo-endotelial. La elevada concentración resultante de partículas superparamagnéticas conduce a los diferentes efectos de sensibilidad responsables de la pérdida significativa de intensidad de señal en las imágenes ponderadas en T1 y T2. Luego de algunos días, en los cuales el efecto de realce puede seguir observándose, las partículas se degradan y el núcleo de hierro ingresa en la vía metabólica normal de este elemento.
Características de las imágenes
La principal característica de las imágenes de las partículas de óxido de hierro superparamagnético (SPIO, por sus siglas en inglés) es el acortamiento considerable y marcado de los tiempos de relajación de T1 y T2, lo que provoca una pérdida sustancial de intensidad de señal en ambas ponderaciones. En imágenes por gradiente de eco ponderadas en T1, puede observarse un incremento temporario en las intensidades de las señales, de un grado comparable a los MC extracelulares no específicos de tipo gadolinio. La explicación de este efecto es la presencia de una baja concentración de partículas circulantes dentro de los vasos y de una fracción de SPIO más pequeñas, llamadas USPIO (ultrasmall SPIO = partículas SPIO ultrapequeñas).3,4
En el hígado normal y en el tejido tumoral que contiene células de Kupffer (adenoma hepatocelular, hiperplasia nodular focal, carcinoma hepatocelular bien diferenciado) existe una pérdida más o menos fuerte de la intensidad de señal luego de la administración de SPIO. Por el contrario, la intensidad de señal de las lesiones que no contienen células de Kupffer no se altera. Sin embargo, se puede observar un realce positivo debido al efecto T1 durante la obtención de imágenes dinámicas en lesiones hipervascularizadas (por ejemplo, hemangiomas, metástasis hipervascularizadas).
Detección y caracterización del CHC y de las metástasis
A pesar de la publicación de diversos informes, todavía resulta contradictorio si las IRM realzadas con ferumoxida o con Gd-DTPA son óptimas para la detección de metástasis o de CHC, en especial en pacientes con cirrosis.
Carlos y col. (2002)5 documentaron que las IRM dinámicas logradas con la administración de gadolinio y con la presentación de un tiempo de lavado venoso es el predictor más significativo de malignidad en comparación con el valor de alfa-fetoproteína (odds ratio [OR]; 9.2 contra 3.2, respectivamente), y del número de lesiones presentes (OR, 1.5). Este dato fue similar al informado por Ito y col. (2004),6 quienes informaron que la presencia de un lavado central rápido luego de l refuerzo temprano de la lesión con Gd-DTPA y que el realce coronal alrededor de la lesión son altamente específicos y que constituyen hallazgos diagnósticos de los CHC hipervasculares.
Shimizu y col. (2003)7 evaluaron lesiones hepáticas pequeñas con IRM dinámicas y reforzadas con Gd en pacientes con cirrosis y detectaron que hasta el 72% de estas lesiones pequeñas con refuerzo inicial fueron consideradas como seudolesiones definitivas debido a la presencia de derivaciones (shunting) o de nódulos displásicos.
Con el empleo de ferumoxidas, la elevada intensidad de señal de las estructuras vasculares en relación con la intensidad de la señal del hígado puede provocar resultados falsamente positivos. Durante la evolución de los CHC a partir de los nódulos displásicos, la pérdida del número y de la función de las células de Kupffer dentro de la lesión se produce en forma gradual. Así, los CHC bien diferenciados pueden contener un número similar de estas células al presente en el parénquima hepático normal. En consecuencia, en estas lesiones se puede observar una captación similar de ferumoxidas. Por otro lado, la captación de estas últimas en el parénquima hepático no maligno puede verse alterada de manera considerable en la fibrocirrosis difusa y confluente.8
La precisión de las IRM reforzadas con gadolinio y de alta resolución espacial, dinámicas y tridimensionales para las metástasis hepáticas demostró ser semejante a las imágenes reforzadas con SPIO. Ambas técnicas superaron el desempeño de la tomografía computarizada dinámica con cortes finos y múltiples.10
Una técnica con doble contraste podría mejorar la sensibilidad de las IRM para la detección de CHC. De esta manera, el incremento en el contraste entre el hígado normal y el parénquima tumoral observado en las imágenes ponderadas en T2 luego de la administración de SPIO puede continuarse con IRM dinámicas y reforzadas con gadolinio, para provocar un aumento en la intensidad de la señal y en el contraste entre el hígado y la lesión de aquellas anormalidades hipervasculares observadas en las imágenes ponderadas en T1. Sin embargo, la sensibilidad de las imágenes con doble contraste para la detección del CHC menor de 1 cm es, hasta el momento, decepcionante.11
Mientras que las imágenes dinámicas ponderadas en T1 obtenidas luego de la administración de ferucarbotran –en lugar de las imágenes más tardías que se logran con ferumoxidas– ayudan para la definición de las lesiones hepáticas focales, dichas imágenes provocan un incremento menor en la intensidad de la señal en comparación con las imágenes reforzadas con Gd-DTPA y por lo general no permiten la reconstrucción de los vasos a partir de la obtención de datos para imágenes tridimensionales.12
Los quelatados del gadolinio específicos para los hepatocitos (Gd-BOPTA y Gd-EOB-DTPA) posibilitan la diferenciación entre lesiones hepáticas y no hepáticas, y de una mayor tasa de detección de lesiones malignas de pequeño tamaño durante la fase de distribución intravascular y la fase de almacenamiento hepatocelular. Durante la fase de eliminación biliar, las imágenes tridimensionales con cortes finos y con ponderación en T1 aportan información funcional acerca de la excreción biliar y exceden el valor de la colangiorresonancia realizada con imágenes ponderadas en T2 sensibles a los líquidos.13 Durante la fase de perfusión (entre 60 a 90 segundos luego de la inyección del material de contraste), se espera que las características de realce dinámico observadas luego de la inyección de Gd-EOB-DTPA sean similares a las halladas con Gd-DPTA. En la etapa hepatobiliar (de 1.5 minutos a 4 horas luego de la inyección), las imágenes realzadas con Gd-EOB-DTPA producen una mejoría dependiente de la dos is en la tasa de detección de metástasis, CHC y hemangiomas en comparación con las imágenes no reforzadas y las realzadas con Gd-DTPA (p < 0.05).14
Para la detección de CHC pequeños, los estudios efectuados con imágenes reforzadas con Gd-BOPTA mostraron un mejor desempeño diagnóstico que las obtenidas con ferumoxidas, mientras que la administración de estas últimas provocó un aumento en la sensibilidad para la detección de metástasis hepáticas en comparación con las imágenes obtenidas con la administración de Gd-BOPTA.15,16 El valor diagnóstico de Mn-DPDP para la detección y definición de las imágenes hepáticas focales es polémico. Los e studios que informan acerca de la superioridad de este tipo de imágenes en comparación con la tomografía helicoidal y las IRM no contrastadas se contradicen con los trabajos que informaron equivalencia entre las imágenes obtenidas con Mn-DPDP y tomografía helicoidal.17 Estudios propios no hallaron cambios significativos del contraste entre el hígado y la lesión antes y después del empleo de Mn-DPDP para la definición de lesiones hepáticas focales.18
Sinopsis
Según la necesidad de detección, localización y caracterización de las lesiones hepáticas focales en pacientes con cirrosis o sin ella, se establecieron diferentes vías diagnósticas para el seguimiento de las imágenes hepáticas por medio de la resonancia magnética. En este sentido, el empleo de gadolinio continúa desempeñando el papel principal en las IRM contrastadas de primera elección para el hígado, y es muy probable que este tipo de imágenes aporte un resultado casi integral para la planificación d e terapéuticas multimodales más complejas. La validación, localización y extensión de una imagen neoplásica sospechosa son fundamentales. Si la lesión es de origen hepático o no, tiene, habitualmente, una importancia limitada. Por este motivo, se elabora ron diferentes MC para abarcar esta cuestión y para el recuento preciso de las lesiones, sin perder la detección de CHC y metástasis pequeñas. La exclusión o la definición de imágenes malignas pequeñas en la cirrosis, donde las seudolesiones podrían semejar neoplasias es otra de las áreas sobre MC específicos en las IRM.
Nuestro abordaje institucional y las vías diagnósticas evolucionaron junto con el advenimiento de nuevos medios contrastados. Su biodistribución y sus propiedades fisicoquímicas se resumen en la figura 1.

BIBLIOGRAFÍA
1. Teefey SA,
Hildeboldt CC, Dehdashti F et al.
Detection of primary hepatic
malignancy in liver transplant candidates: prospective comparison of CT, MR
imaging, US, and PET. Radiology (2003) 226:533-542
2. Helmberger T, Semelka RC. New contrast agents for imaging of the liver. Magn Reson Imaging Clin N Am (2003) 9:745-66.
3. Helmberger TK. Contrast agents for body MRI. Syllabus 13th scientific meeting Int´l society for magnetic resonance in medicine (2005), Mira Digital Publishing.
4. Gellissen J, Axmann C, Prescher A et al. Extra- and intracellular accumulation of ultrasmall superparamagnetic iron oxides (USPIO) in experimentally induced abscesses of the peripheral soft tissues and theit effects on magnetic resonance imaging. Magn
Reson Imaging (1999) 17 (4):557-567.
5. Carlos RC, Kim HM, Hussain HK et al. Developing a prediction rule to assess hepatic malignancy in patients with cirrhosis. AJR (2002) 180:893-900.
6. Ito K, Fujita T, Shimizu A et al. Multiarterial phase dynamic MRI of small early enhancing hepatic lesions in cirrhosis or chronic hepatitis. AJR (2004) 183:699-705.
7. Shimizu A, Ito K, Koike S et al. Cirrhosis or chronic hepatitis: Evaluation of small (<2-cm) early-enhancing hepatic lesions with serial contrast-enhanced dynamic MR imaging. Radiology (2003) 226:550-555.
8. Mori K, Scheidler J, Helmberger T et al. Detection of malignant hepatic lesions before orthotopic liver transplantation: accuracy of ferumoxides-enhanced MR imaging. AJR (2002) 179(4):1045-51.
9. Simon G, Link TM, Wörtler K et al. Detection of hepatocellular carcinoma: comparison of Gd-DTPA and ferumoxides-enhanced MR imaging. Eur Radiol (2005) 15:895-903.
10. Ward J, Robinson PJ, Guthrie JA et al. Liver metastases in candidates for hepatic resection: Comparison of helical CT and gadolinium- and SPIO-enhanced MR imaging. Radiology (2005) 26: [Epub ahead of print].
11. Bhartia B, Ward J, Guthrie JA et al. Hepatocellular carcinoma in cirrhotic livers: double-contrast thin-section MR imaging with pathologic correlation of explanted tissue. AJR (2003) 180(3):577-84.
12. Reimer P, Balzer T. Ferucarbotran (Resovist): a new clinically approved RES-specific contrast agent for contrast enhanced MRI of the liver: properties, clinical development, and applications. Eur Radiol (2002) 13:1266-1276.
13. Stroszczynski C, Gaffke G, Gnauck M et al. Current status of MRI diagnostics with liver-specific contrast agents. Gd-EOB-DTPA and Gd-BOPTA. Radiologe (2004) 44:1185-1191.
14. Vogl TJ, Schwarz W, Blume S et al. Preoperative evaluation of malignant liver tumors: comparison of unenhanced and SPIO (Resovist)-enhanced MR imaging with biphasic CTAP and intraoperative US. Eur Radiol (2003) 13:262-272.
15. Kim YK, Lee JM, Kim CS. Gadobenate dimeglumine-enhanced liver MR imaging: value of dynamic and delayed imaging for the characterization and detection of focal liver lesions. EurRadiol (2004) 14:5-13.
16. Del Frate C, Bazzocchi M, Mortele KJ et al. Detection of liver metastases: comparison of gadobenetate dimeglumine-enhanced and ferumoxides-enhanced MR imaging examinations. Radiology (2002) 225 (3):766-772.
17. Bartolozzi C, Donati F, Cioni D et al. Detection of colorectal liver metastases: a propective multicenter trial comparino unenhanced MRI, MnDPDP-enhanced MRI, and spiral CT. Eur Radiol (2004) 14:14-20.
18. Helmberger TK, Laubenberger J, Rummeny E et al. MRI characteristics in focal hepatic disease before and after administration of MnDPDP: discriminant analysis as a diagnostic tool. Eur Radiol (2002) 12(1):62-70.
|


![]()
![]()

