 CONSUMO
DE ALIMENTOS E INDICE DE DIVERSIDAD DE LA DIETA EN
ESCOLARES DE BAJA CALIFORNIA, MEXICO
CONSUMO
DE ALIMENTOS E INDICE DE DIVERSIDAD DE LA DIETA EN
ESCOLARES DE BAJA CALIFORNIA, MEXICO
|

|
|
Dr. Arturo
Jiménez-Cruz
Columnista Experto de SIIC
Institucion:
Facultad de Medicina, Universidad Autónoma de Baja
California (UABC), Tijuana, Baja California, México |
Introducción
Las dietas altas en
frutas y verduras han sido relacionadas con disminución
en riesgo de diversas patologías, entre ellas algunos
tipos de cáncer, enfermedades cardiovasculares,
diabetes, obesidad y accidente cardiovascular.1-7 Por
esta razón, para la eficaz prevención de las
enfermedades crónicas, diversas asociaciones
recomiendan el consumo de cinco o más frutas y verduras
diarias. En Baja California, el Instituto de Nutrición
de Baja California difundió una guía llamada La
Manzana de la Salud ,10 que recomienda para niños
de 6 a 12 años el consumo diario de dos a tres raciones
de frutas, tres a cinco raciones de verduras, seis a
doce raciones de granos y harinas, tres raciones de lácteos
y dos raciones de carnes (figura 1). La comprensión y
aceptación de La Manzana de la Salud fue evaluada en
mujeres de diferentes niveles socioeconómicos,11 en
diabéticos,12 en niños de escuelas para niños indígenas13
y no indígenas.14 Diversos estudios han demostrado que
la comida chatarra y el consumo alto de grasas tienen
efectos negativos sobre la salud.15-17 Las ventas de
refrescos carbonatados en México demuestran alto
consumo,18 que lo ubican como segundo país entre los de
mayor consumo de refrescos en el mundo.15

En EE.UU., los escolares
méxico-americanos constituyen el grupo étnico con
menor consumo de frutas y verduras,19 y solamente 6.8%
de los niños de origen latino de cuatro a cinco años
de edad ingería 5 raciones de frutas y verduras al día.20
El objetivo de este estudio fue valorar el consumo de
alimentos en niños que asisten a la escuela primaria y
secundaria y comparar la composición de la ingesta con
las recomendaciones de La Manzana de la Salud .
Métodos
• Características de la población.
Baja California (México) es un estado localizado al
noroeste del país, que tiene frontera con el estado de
California en los EE.UU. De acuerdo con el censo de
1992,21 Baja California (BC) tenía aproximadamente 2
millones de residentes. La edad del 34% de la población
total es inferior a 15 años21 y tiene tres subsistemas
de educación:
1. Subsistema administrado por el
gobierno del estado.
2. Subsistema administrado por el
gobierno federal.
3. Subsistema privado.
Los programas escolarizados se dividen en educación
primaria (primero a sexto año, de 6 a 12 años de
edad), educación secundaria (primero a tercer año, de
12 a 15 años) y preparatoria (primero a tercer año, de
15 a 18 años). Durante el período 1996-1997, el número
de estudiantes inscritos en el sistema de educación
primaria fue de 38 877 niños y 38 472 niñas, y en
secundaria, 13 648 niños y 13 374 niñas.22 Las
escuelas estaban localizadas en zonas rurales y urbanas
de los cinco municipios de BC: Tijuana, Mexicali,
Tecate, Ensenada y Rosarito.
• Sujetos.
En el período
1996-1997, 16 625 niños se inscribieron en quinto de
primaria y 8 676 en tercero de secundaria.
• Muestra.
Se seleccionaron
25 escuelas por cada nivel educativo y de 20 grupos en
cada nivel y municipio mediante un muestreo aleatorio
bi- etápico. En Rosarito, se seleccionaron tres de
siete primarias y dos de las cuatro secundarias.23
• Obtención
de información. Se
entrenó a todos los entrevistadores, estudiantes de la
Maestría en Nutrición, para que leyeran y revisaran la
información. Se les dio un curso de 40 horas sobre
consumo de alimentos. Además, se realizó un
entrenamiento específico de 6 horas para la
administración del cuestionario de frecuencia de
consumo. El cuestionario se aplicó entre las 10 y 12 de
la mañana. El entrevistador leía las preguntas,
explicaba el tamaño de las porciones y consignaba las
respuestas.
• Estudio
piloto. El
cuestionario final se realizó después de la valoración
de nueve cuestionarios diferentes. Se realizó la prueba
de test-retest y se analizó mediante la correlación de
Spearman (r = 0.79; p = 0.001); el período entre el
test-retest fue de dos semanas. La alpha de Chronbach
fue de 0.80 (p = 0.01). Se realizó la validación del
cuestionario con recordatorio de siete días, la
correlación de Spearman fue de (r = 0.9).
• Cuestionario
de frecuencia de alimentos.
El cuestionario
definitivo incluía 36 alimentos de consumo usual en BC.
Los alimentos se agruparon de acuerdo con los grupos
establecidos en La Manzana de la Salud.
• Carta
de consentimiento. El
proyecto fue aprobado por el Comité de Posgrado de
Nutrición y los padres de los estudiantes firmaron una
carta de consentimiento.
• Análisis estadístico:
Los alimentos
fueron agrupados en los cinco principales grupos,
adicionalmente a refrescos, dulces y frituras. Los
resultados se compararon con los estándares de
referencia de La Manzana de la Salud . Se elaboraron
tres índices de diversidad, uno que evaluaba la
suficiencia y variedad con escala de 1 a 10; otro que
evaluaba suficiencia, variedad y moderación, con escala
de 0 a 10, que incluía las grasas, y uno de 0 a 5.24 En
el primer índice se asignó una unidad al consumo de
cada uno de los cinco grupos de alimentos y una unidad más
para quien consumía la cantidad recomendada por La
Manzana de la Salud . En el segundo índice, se sustraía
una unidad a quien consumiera más de cinco raciones de
grasa por día (cada ración era de 5 g). En el tercer
índice se la asignó una unidad por cada grupo de
alimentos que se consumía en la cantidad recomendada
por La Manzana de la Salud . Los resultados se
calcularon por género, lugar de residencia (urbana o
rural), ocupación del padre. La asociación entre el
consumo de grupos de alimentos por lugar de residencia,
nivel de educación y ocupación de los padres se realizó
mediante χ2.
Resultados
El cuestionario fue
realizado por 3 325 estudiantes, 51% niños y 49% niñas.
La ingesta diaria de frutas fue de 1.5 ± 1.7 porciones
en niños de quinto de primaria, y 1.5 ± 1.5 en
adolescentes de tercero de secundaria; la ingesta diaria
de verduras fue de 2.5 ± 2.4 en niños de quinto, y 2.7
± 2.3 en adolescentes; la ingesta de harinas y granos
fue de 8.0 ± 5.6 en niños y 7.4 ± 7.3 en
adolescentes; la ingesta del grupo de las carnes y
sustitutos (incluyendo frijoles) fue de 5.4 ± 5.6 en niños
y de 6.7 ± 7.7 en adolescentes; y la ingesta de lácteos
fue de 2.7 ± 2.4 en niños y 2.7 ± 2.3 en
adolescentes. El porcentaje de niños y adolescentes de
escuelas rurales y urbanas que consumían las
recomendaciones mínimas de fruta fue de 38% y 43%; de
verduras, 31% y 46%; de harinas y granos, 63% y 68%; de
carnes (incluyendo frijoles), 87% y 88%; de carnes, sin
incluir frijoles, 67% y 77%, y de lácteos, 31% y 42%,
respectivamente.
El consumo diario de
refrescos carbonatados lo reportaron 92% de niños de
primaria y 93% de los adolescentes; el consumo de
frituras fue de 85% en niños de primaria y 88% en
adolescentes y el consumo diario de dulces fue descrito
en 86% de niños y 88% de adolescentes. De acuerdo con
la ocupación del padre, se observaron diferencias estadísticamente
significativas en el consumo de las raciones mínimas de
frutas (p = 0.02), de verduras (p = 0.01) y refrescos (p
= 0.004).
De acuerdo con el primer
índice de diversidad, 61% de escolares de zonas rurales
y 68% de zonas urbanas tuvieron valores de 7 a 10 (p
< 0.001); de acuerdo con el segundo índice, 53% de
niños de zonas rurales y 68% de zonas urbanas
presentaron cifras de 7- 10; y de acuerdo con el tercer
índice, 9% de niños en zonas rurales y 16% de niños
en zonas urbanas se ubicaron en la categoría de bueno
(p < 0.000), es decir consumo adecuado de todos los
grupos de alimentos.
Discusión
En el estudio se
observó alto porcentaje (31% - 88%) de niños y
adolescentes que no cumplían con las recomendaciones mínimas
de todos los grupos de alimentos.
Solamente 9% de niños en
zonas rurales y 16 % en zonas urbanas cumplían con las
raciones recomendadas de todos los grupos. Por otro
lado, estos niños tenían un alto consumo de refrescos,
dulces y frituras. No hemos encontrado publicado otros
estudios que presenten el consumo de alimentos en
escolares en diferentes regiones de Latinoamérica.23
Los resultados son similares a los observados en la
tercera encuesta nacional de nutrición (HANES III) de
EE.UU.25 El consumo de verduras fue mayor en
adolescentes que en niños, lo que concuerda con otros
estudios.25-27 Además, los hijos de padres de zonas
rurales cumplían menos las recomendaciones que los
hijos de padres con otras ocupaciones. Esto parece
indicar que los niños de zonas rurales están en mayor
riesgo de enfermedades crónico- degenerativas como
resultado del bajo consumo de frutas y verduras.1-7
Estas enfermedades han aumentado considerablemente en México.
Por otro lado, los escolares indígenas que asisten a
escuelas públicas de Tijuana tienen la más alta
prevalencia de riesgo de sobrepeso y obesidad en el país.
Esta obesidad coexiste con desnutrición, alta
prevalencia de inseguridad alimentaria y bajo
cumplimiento en el consumo de alimentos.13 Además, el
exceso en el consumo de refrescos está asociado con
diversos problemas de salud, incluyendo la obesidad,
cariogenicidad, piedras urinarias recurrentes, dispepsia
e hipocalcemia.16-18,29-31 Estos problemas adquieren
relevancia, teniendo en cuenta que los programas más
efectivos en el largo plazo para la reducción y control
de la obesidad son los que se implementan en niños.32 A
pesar de ello, pocos esfuerzos sistemáticos se han
realizado para reducir la ingesta de refrescos y comida
chatarra en México. Los resultados de este estudio
dieron lugar a diversas propuestas ante legisladores
mexicanos33-36 y al desarrollo de programas de evaluación
e intervención específicos en escuelas indígenas y no
indígenas. En el Foro Nacional de Salud Pública,
realizado por la Comisión de Salud de la Cámara de
Diputados de México, se propuso reformar la ley de
salud para que se transfieran responsabilidades a los
estados y municipios (la idea es que se diseñen
instrumentos de educación validados a nivel local o
regional33), así como prohibir la venta de refrescos,
frituras, dulces y chocolates en las tiendas
escolares,34 garantizar el consumo de cinco grupos de
alimentos en la población mexicana35 y que el gobierno
asuma la responsabilidad de distribuir desayunos
escolares en todas las escuelas rurales y en las áreas
marginadas de las escuelas urbanas.36 Además se han
realizado estudios de prevalencia de desnutrición y
obesidad en escuelas indígenas13 y programas de
intervención para el control y prevención de la
obesidad y desnutrición (datos no publicados).
Sin embargo, se requieren
más esfuerzos en diversos niveles o contingencias para
que la relevancia de estos resultados pueda verse
reflejada en medidas de intervención masiva y
eficiente. El modelo ecológico de conducta propuesto
por Hovell es una estrategia que debe explorarse.37
BIBLIOGRAFIA
- Healthy People 2000:
National Health promotion and Disease Prevention
Objectives. Washington, DC: US Dept of Health and
Human Services; 1990.DHSS publication PHS- 50212.
- Steinmetz KA, Potter
JD.Vegetables, fruit, and cancer. I.Epidemiology.
Cancer causes control 1991; 2:325-357.
- Block G, Patterson
B, Subar A. Fruit, vegetables, and cancer
prevention: a review of the epidemiologic evidence.
Nutr Cancer 1992; 18:1-29.
- Rogers AE,
Longnecker MP. Biology of disease: dietary and
nutritional influences on cancer. Lab Invest 1988;
59:729-759.
- Henderson BE, Ross
RU, Pike MC. Toward the primary prevention of
cancer. Science 1991; 254:1131-1138.
- Steinmetz KA, Potter
JD. Vegetables, fruit, and cancer prevention. J Am
Diet Assoc 1996;96:1027-1039.
- Quan Tu, Salomón J,
Nitzke S, Ricks M. Behaviors of low-income mothers
related to fruit and vegetable consumption. J Am
Diet Assoc 2000; 100: 567-570.
- Food Guide Pyramid:
A guide to daily food choices. Washington, DC: US
Dept of Agriculture, Human Nutrition Information
Services; 1992. Home and Garden Bulletin No. 232.
- 5-A-DAY for better
health. Bethesda, Md: National Cancer Institute
1992.RFA No. CA- 92-17.
- Jiménez-Cruz A,
Jones E, Bacardí Gascón M. La Manzana de la Salud.
Divulgare 1996; 14:12-15.
- Bacardí Gascón M.,
Jiménez-Cruz A., Jones E. An evaluation of two
Mexican Food Guides. Int J Food Sci Nutr
2002;53(2):163-169.
- Jiménez-Cruz A,
Bacardí M, et al. Motivating behavioral change in a
Mexican diabetic population: The Si Se Puede
intervention program. Revista Biomédica (En
prensa).
- Jimenez Cruz A,
Bacardi-Gascon M, Spindler A. Obesity and hunger
among Mexican- Indian children on the US-Mexico
border. Int J Obesity (En Prensa).
- Bacardí M, Jimenez
A, Sanchez C., et al. Evaluación cuantitativa de
las guías alimentarias mexicanas en niños. I
Congreso de la Asociación de
Dietistas-Nutricionistas. Barcelona, España.
10/18/02.
- Mazariegos-Ramos E,
Rodriguez-Morán M, Guerrero-Romero JF, Paniagua R.
Amato D. Alteraciones en el metabolismo del calcio y
fosfatos secundarias a la ingestión de refrescos
fosorados. Bol Med Hosp Infant Mex 1995; 52:5-9.
- Mazariegos-Ramos E,
Guerrero-Romero F, Rodríguez-Román M,
Lazcano-Burciaga G, Paniagua R, Amato D. Consumption
of soft drinks with phosphoric acid as a risk factor
for the development of hypocalcemia in children: A
case-control study. The Journal of Pediatrics 1995;
126 (6):940-942.
- Shuster J, Jenkns A,
Logan C. Soft drinks consumption and urinary stone
recurrence: a randomized prevention trial. J Clin
Epidemiol 1992; 45:911-6.
- Maupomé-Carvantes
G, Sánchez-Reyes V, Laguna-Ortega S,
Andrade-Delgado LC, Diez de Bonilla-Calderón. Patrón
de consumo de refrescos en una población Mexicana.
Salud Publica Mex 1995; 37:323-328.
- Murphy SP, Castillo
RO, Mendoza FS. An evaluation of food group intakes
by Mexican-American children. J Am Diet Assoc 1990;
90:388-393.
- Basch CE, Zybert P,
Shea S. 5-A-Day: dietary behavior and the fruit and
vegetable intake of Latino children. Am J Public
Health 1994; 84:814-818.
- Secretaría General
de Gobierno. Consejo Estatal de Población.Baja
California.Información General, cifras y datos.
Gobierno del Estado de Baja California, 2nd Ed.
Mexicali, B.C.1995
- Secretaría de
Educación Pública del estado de Baja
California.Mexicali, B.C.1997.
- Jiménez Cruz A.,
Bacardí Gascón M., Jones E. Fruit, vegetable, soft
drink, and high- fat containing snack consumption
among Mexican Children. Arch Med Res 2002;33:74- 80.
- Schuette LK, Song
WO, y Hoerr SL. Quantitative use of the Food Guide
Pyramid to evaluate dietary intake of college
students. J Am Diet Assoc 1996;96:453-457.
- Third Report on
Nutrition Monitoring in the United States. US
Department of Agriculture. Washington, DC.1995.
- Patterson BH, Block
G, Rosenberger WF, Pee D, Kahle LL. Fruit and
vegetables in the American diet: data from the
NHANES II survey. Am J Public Health 1990;
80:1443-1449.
- Serdula MK, Coates
RJ, Byers T, Simoes E, Mokdad AH, Subar AF. Fruit
and vegetable intake among adults in 16 states:
results of a brief telephone survey. Am J Public
Health 1995; 85:236-239.
- Baranowski T, Smith
M, Baranowski J, Wang DT, Colleen D, Lin LS, Hearn
MD, Resnicow K. Low validity of a seven-item fruit
and vegetable food frequency questionnaire among
third-grade students. J Am Diet Assoc 1997;97
(1):66-68.
- Guenther PM.
Beverages in the diets of American teenagers. J Am
Diet Assoc 1986; 86(4): 493-499.
- Meurman JH, Frank
RM. Progression and surface ultrastructure of
invitro caused erosive lesions in human and bovine
enamel. Caries Res 1991; 25:81-87.
- Holcombe C, Kaluba
J, Lucas SB. Non-ulcer dyspepsia in Nigeria: a case
control study. Trans R Soc Trop Med Hyg 1991;
85:553-555.
- Epstein LH, Voloski
A, Wing RR, McCurley J. Ten-year follow-up of
behavioral, family- based treatment for obese
children. JAMA 1990; 264 (19):2519-2523.
- Jiménez-Cruz A. La
nutrición en México. Foro Nacional de Consulta Pública
"La Salud de los Mexicanos", Comision de
Salud. H. Congreso de la Unión. pp 22-27. México,
Julio 2000.
- Bacardí-Gascón M.
Propuesta para prohibir la venta de refrescos,
fritos, dulces y chocolates en las tiendas
escolares. Foro Nacional de Consulta Pública
"La Salud de los Mexicanos", Comision de
Salud. H. Congreso de la Unión. pp 46-47. México,
Julio 2000.
- Bacardí-Gascón M y
Jiménez-Cruz A. Propuesta para que se garantice el
consumo de cinco grupos de alimentos en la población
mexicana. Foro Nacional de Consulta Pública
"La Salud de los Mexicanos", Comision de
Salud. H. Congreso de la Unión. pp 51-52. México,
Julio 2000.
- Bacardi-Gascón y
Jiménez-Cruz A. Propuesta para que el gobierno
distribuya desayunos escolares en todas las escuelas
públicas rurales y de manera selectiva, en escuelas
rurales. Foro Nacional de Consulta Pública "La
Salud de los Mexicanos", Comision de Salud. H.
Congreso de la Unión. pp 67. México, Julio 2000.
- Hovell MF, Wahlgren
DR, Gehrman C. The Behavioral Ecological Model:
Integrating public health and behavioral science.
In: DiClemente RJ, Crosby R, Kegler M, (eds.). New
and Emerging Models and Theories in Health Promotion
and Health Education. Josey- Bass Inc., San
Francisco, California, 2002.
|
 VALOR
PRONOSTICO DE LA EXPRESION DE P53 Y MDM2 EN LA LEUCEMIA VALOR
PRONOSTICO DE LA EXPRESION DE P53 Y MDM2 EN LA LEUCEMIA
|

|
Britt
Gustafsson, MD, PhD
Columnista Experta de SIIC
Institucion:
Department of Paediatrics, Huddinge University Hospital,
Karolinska Institutet, Estocolmo, Suecia |
Introducción
La alteración del gen supresor
de tumor TP53 y la mayor expresión de la proteína codificada por
él, p53, se asocian con interrupción del ciclo normal de
proliferación celular y apoptosis.1-3 Es la mutación más común
en cáncer humano.1,2 De hecho, las mutaciones en la p53 se han
involucrado en la etiología de varios tipos de tumores sólidos y
podrían tener significado pronóstico en neoplasias hematológicas
del adulto.4,5 En las leucemias agudas infantiles, las mutaciones
de p53 son infrecuentes en el momento del diagnóstico de la
patología pero tienden a conferir un pronóstico
desfavorable.6-16 Uno de los mecanismos propuestos en la
inactivación de la p53 tipo natural es la interacción con MDM2,
una proteína de tumor que anula la función supresora de tumores
de p53, con lo cual se forma un circuito de autorregulación.17-19
En algunos casos de neoplasias hematológicas malignas del adulto
se observa mayor expresión de MDM2 y este fenómeno se asocia con
pronóstico adverso.20 Marks y colaboradores refirieron que la
expresión anormal de p53/MDM2 en el momento del diagnóstico era
un hallazgo más frecuente en la LLA con falta de respuesta
temprana al tratamiento que en niños con remisión prolongada.
Asimismo, encontraron que 3 de 10 pacientes con LLA de pronóstico
desfavorable tenían mutaciones en el gen de la p53 y otros cuatro
expresaban en exceso la proteína MDM2. En dos de estos cuatro
enfermos, el nivel de ARN mensajero (ARNm) de MDM2 era normal. Los
autores pusieron énfasis en la importancia de la medición de
dicha proteína y en un posible mecanismo nuevo de regulación
postranscripcional en el nivel de la proteína MDM2.21-22 Zhout y
colegas refirieron la expresión exagerada de ARNm de MDM2 en
algunos casos pediátricos de LLA con células que expresaban el
tipo salvaje de la p53.
También constataron que la mayor
expresión de MDM2 en niños con LLA se correlacionaba en forma
significativa con resistencia a la doxorrubicina y con
recidiva.23-24 El objetivo del estudio fue evaluar la expresión
de p53 y de MDM2 en células leucémicas de niños con LLA en
remisión sostenida y comparar los hallazgos con los de pacientes
con LLA internados para trasplante de médula ósea como
consecuencia de hallazgos indicadores de pronóstico desfavorable,
esencialmente recidiva.
Material y métodos
Pacientes
Se revisaron muestras de médula
ósea obtenidas en el momento del diagnóstico de LLA en 30 niños
que habían permanecido más de 5 años sin recidiva. Además se
estudiaron 15 pacientes internados para ser sometidos a trasplante
de médula ósea (TMO), quienes representaron el grupo de pronóstico
desfavorable. En 7 de ellos se dispuso de muestra de médula ósea
en el momento del diagnóstico inicial. Como controles se
evaluaron biopsias medulares de 11 pacientes sin patología neoplásica.
En todos los casos se dispuso de
muestras de médula ósea embebidas en parafina.
Métodos
Las muestras de médula ósea
se analizaron con inmunohistoquímica para determinar la expresión
de p53 y MDM2. La presencia de células leucémicas se estableció
morfológicamente y con el uso de marcadores inmunológicos CD3 y
CD79a.
Se utilizaron los anticuerpos
primarios anti-p53, clon DO-7, un anticuerpo murino monoclonal que
reconoce los aminoácidos 17 a 29 de la región aminoterminal de
la proteína humana p53 (Dakopatts) y el anti-MDM2, clon SMP14, un
anticuerpo monoclonal murino contra la secuencia de aminoácidos
154-167 de la proteína MDM2 humana (Santa Cruz Biochemistry). La
marcación se efectuó en TechMateTM 500, Dakopatts según
procedimientos estandarizados.
La fijación de los anticuerpos se
visualizó mediante reacción enzimática con diaminobenzidina-peróxido.
Las muestras se tiñeron débilmente con hematoxilina y se
prepararon controles negativos con la omisión del anticuerpo
primario. Se incluyeron controles positivos -muestras de amígdalas
embebidas en parafina- con expresión conocida de p53 y MDM2
(figura 1). Con la finalidad de optimizar el procedimiento de
detección de MDM2, se utilizó la línea celular C6 con expresión
exagerada inducida de MDM2.
Figura 1.
Detección
por inmunohistoquímica de p53 en amígdala
normal.
En cada preparado se contaron 500 células
y se determinó la frecuencia de células mononucleares con
expresión de p53 y MDM2. Las muestras con menos de un 10% de células
positivas se consideraron negativas. La intensidad de la
positividad para p53 y MDM2 se estableció como leve (+),
intermedia (++) o intensa (+++). Las diferencias estadísticas
entre los grupos se calcularon con la prueba de Chi cuadrado con
corrección de Yates. El protocolo de estudio fue aprobado por el
comité de ética médica del Instituto Karolinska.
Resultados y discusión
Un estudio anterior analizó la
expresión de p53 y MDM2 por inmunohistoquímica en muestras de médula
ósea de 23 niños con LLA.25 En un caso se constató mayor
expresión de la proteína p53 mientras que en 5 enfermos hubo
expresión exagerada de MDM2. Estos 6 pacientes con expresión
excesiva de MDM2/p53 pertenecían a un grupo con hallazgos
compatibles con pronóstico adverso en el momento del diagnóstico.
Con la finalidad de comprender mejor el valor pronóstico de la
expresión de p53/MDM2, estudiamos muestras de médula ósea de niños
con LLA en recaída, internados para estudio pretrasplante de médula
ósea. Encontramos elevada incidencia de expresión aumentada de
las proteínas p53 y MDM2 en comparación con los controles sin
leucemia.26 El objetivo del tercer estudio fue poner estas
observaciones en perspectiva mediante el análisis de la expresión
de p53/MDM2 en un grupo de niños con LLA que sobrevivieron más
de 5 años luego del diagnóstico.
Además, se volvieron a estudiar
las muestras de médula ósea originales y las obtenidas durante
la recaída en el grupo con evolución desfavorable.
Sólo 4 de los 30 niños con LLA en
remisión prolongada expresaban p53 mientras que este fenómeno se
observó en 8 de 15 enfermos con recidiva (p = 0.01). Cuatro
pacientes con remisión prolongada también expresaron MDM2 versus
10 de los 15 niños con recaída leucémica (p = 0.0007). En las
muestras originales de médula ósea, la expresión exagerada de
MDM2 fue más común en el grupo que presentó recidiva que en el
grupo con remisión a largo plazo (p = 0.002). Lo mismo ocurrió
con la expresión simultánea de ambas proteínas (p = 0.028). En
el grupo control, hubo expresión de MDM2 en sólo un niño con
enfermedad por depósito de lípidos (figuras 2, 3 y 4).
Figura 2. Detección
por inmunohistoquímica de p53 en células de médula ósea en el
momento del diagnóstico de leucemia linfoblástica aguda.
Figura 3.
Detección
por inmunohistoquímica de MDM2 en células de médula ósea en el
momento del diagnóstico de leucemia linfoblástica aguda.
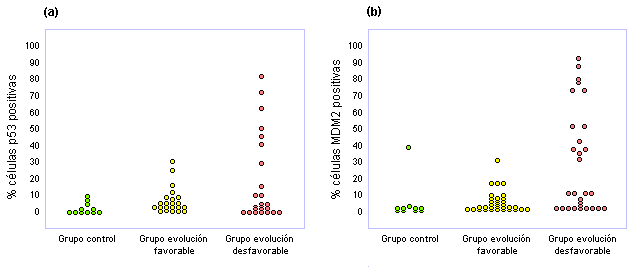
Figura 4. (a) expresión
de p53 y (b) expresión
de MDM2 en células leucémicas en 30 pacientes con leucemia
linfoblástica aguda con sobrevida prolongada (buena evolución) y
en 15 enfermos con patología avanzada (evolución desfavorab le).
En el grupo control está compuesto por 11 pacientes con
trastornos no malignos.
Estos hallazgos coinciden con
estudios moleculares en cuanto a que la alteración en la expresión
de las proteínas p53 y MDM2 en el momento del diagnóstico era más
frecuente en leucemias infantiles asociadas con fracaso terapéutico
que en el grupo de enfermos con remisión prolongada.6-16 En la
mayoría de las investigaciones anteriores, la expresión de p53 y
MDM2 se evaluó a nivel del ADN y ARN sin descripción de la
expresión proteica. Algunos autores, por ello, enfatizaron la
importancia de analizar las proteínas ya que p53/MDM2 pueden
detectarse sin amplificación genética.21-23 Un estudio reciente
también reveló que el análisis genómico de tejidos
conservados, fijados en formalina, se relaciona con el hallazgo de
mutaciones artificiales.25 Se requieren estudios prospectivos para
conocer si las alteraciones de p53/MDM2 en el momento de la
recidiva representan modificaciones secundarias de aparición
durante la enfermedad o si en caso de estar presentes en el
momento del diagnóstico constituyen marcadores de evolución
desfavorable.
BIBLIOGRAFIA
- Holstein M, Sidransky D,
Vogelstein B, Harris C. p53 mutations in human cancers.
Science. 1991; 253:49-53.
- Levine J,Momand J, Finlay CA.
The p53 tumour suppressor gene. Nature. 1991; 351-453.
- Lane D P. p53, guardian of the
genome. Nature. 1992; 358:15-16.
- Sugimoto K, Toyoshima H, Sakai
R et al: Mutations of the p53 gene in lymphoid leukemia. Blood
1991; 77: 1153-1156.
- Sugimoto K, Hirano N,
Toyoshima H et al: Mutations of the p53 gene in
myelodysplastic syndrome (MDS) and MDS-derived leukemia. Blood
1993; 81: 3022- 3026.
- Felix CA, Nau MM, Takahashi T
et al: Hereditary and Acquired p53 Gene mutations in Childhood
ALL. J.Clin.Invest 1992; 89: 640-647.
- Wada M, Bartram CR, Nakamura H
et al: Analysis of p53 mutations in a Large Series of Lymphoid
Hematologic Malignancies of Childhood. Blood 1993; 82: 3163-
3169.
- Blau O, Avigad S, Stark B et
al: Exon 5 mutations in the p53 gene in relapsed childhood
ALL. Leuk Res 1997; 21: 721-729.
- Kawamura M, Ohnishi H, Guo SX
et al. Alterations of the p53, p21, p16, p15 and RAS genes in
childhood T cell ALL. Leuk Res 1999; 23: 115-126.
- Lam V, Mc Pherson P, Salmena L
et al. p53 gene status and chemosensitivity of childhood acute
lymphoblastic leukaemia cells to adriamycin. Leuk Res 1999;
23: 871- 880.
- Felix CA, D'Amico D, Mitsudomi
T, et al. Absence of hereditary p53 mutations in 10 familial
leukemia pedigrees. J Clin Invest 1992;90(2):653-8.
- Kawamura M, Kikuchi A,
Kobayashi S, et al. Mutations of the p53 and ras genes in
childhood t(1;19)-acute lymphoblastic leukemia. Blood
1995;85(9):2546-52.
- Findley HW, Gu L, Yeager AM et
al.Expression of Bcl-2, Bcl-xl and Bax correlate with p53
status and sensitivity to apoptosis in childhood acute
lymphoblastic leukemia. Blood.1997 Apr 15;89(8):2986-93.
- Gump J, McGavran L, Wei Q et
al.Analysis of TP53 mutations in relapsed childhood acute
lymphoblastic leukemia.J Pediatr Hematol Oncol.2001 Oct
23(7):416-419.
- Lam V, Mc Pherson JP, Salmena
L et al.p53 gene status and chemosensitivity of childhood
acute lymphoblastic leukemia cells to adriamycin. Leuke
Res.1999 Oct;23(10):871-80.
- Diccianni MB, Yu J, Hsiao M,
Mukherjee S, Shao LE, Yu AL. Clinical significance of p53
mutations in relapsed T-cell acute lymphoblastic leukemia.
Blood 1994;84(9):3105- 12.
- Meltzer PS. MDM2 and p53: a
question of balance [editorial; comment]. J Natl Cancer Inst
1994;86(17):1265-6.
- Oliner JD, Pietenpol JA,
Thiagalingam S, Gyuris J, Kinzler KW, Vogelstein B.
Oncoprotein MDM2 conceals the activation domain of tumour
suppressor p53. Nature 1993;362(6423):857-60.
- Freedman DA,Wu I and Levine
AJ.Functions of the MDM2 oncoprotein.Cell.Mol.Life
Sci.1999;55:96-107.
- Oliner JD, Kinzler KW, Meltzer
PS, George DL, Vogelstein B. Amplification of a gene encoding
a p53-associated protein in human sarcomas [see comments].
Nature 1992;358(6381):80-3.
- Marks DI, Kurz BW, Link MP, et
al. Altered expression of p53 and mdm-2 proteins at diagnosis
is associated with early treatment failure in childhood acute
lymphoblastic leukemia. J Clin Oncol 1997;15(3):1158-62.
- Marks DI, Kurz BW, Link MP, et
al. High incidence of potential p53 inactivation in poor
outcome childhood acute lymphoblastic leukemia at diagnosis.
Blood poor outcome childhood acute lymphoblastic leukemia at
diagnosis. Blood 1996;87(3):1155- 61.
- Zhou M, Yeager AM, Smith SD,
Findley HW. Overexpression of the MDM2 gene by childhood acute
lymphoblastic leukemia cells expressing the wild-type p53
gene. Blood 1995;85(6):1608-14.
- Zhou M, Gu L, Abshire TC et
al. Incidence and prognostic significance of MDM2 oncoprotein
overexpression in relapsed childhood acute lymphoblastic
leukaemia. Leukemia 2000; 14: 61-67.
- Williams C, Ponten F, Moberg C
et al. A high frequency of sequence alterations is due to
formalin fixation of archival speciemen. Am J Pathol 1999;
155: 1467-1471.
|
 EL
RITONAVIR SE ASOCIA CON ALTERACIONES DEL CRECIMIENTO EN NIÑOS
AFECTADOS POR EL HIV
EL
RITONAVIR SE ASOCIA CON ALTERACIONES DEL CRECIMIENTO EN NIÑOS
AFECTADOS POR EL HIV
|

|
Dra.
Sharon A. Nachman
Investigadora del Departamento de Pediatría.
Directora de Enfermedades Infecciosas Pediátricas.
Stony Brook University Hospital.
|
|
Stony Brook, EE.UU. (especial para SIIC)
La doctora Sharon Nachman
observó que, a pesar de alcanzar un control adecuado de la
replicación viral, los niños infectados por el HIV y
tratados con ciertos antirretrovirales experimentan
alteraciones del crecimiento. La investigadora explicó a SIIC,
en una entrevista exclusiva, que los niños estudiados ”tuvieron
una cierta recuperación de peso y altura inicialmente,
cuando se redujo su carga viral. Sin embargo, en el
seguimiento a largo plazo, no hubo una recuperación de los
valores normales”.
La doctora Nachman ha publicado numerosos trabajos
científicos en revistas como Archives of Pediatrics and
Adolescent Medicine, Journal of the American Medical
Association y Pediatric Infectious Diseases Journal, entre
otras. Actualmente está investigando los efectos de la
terapia antirretroviral en los niños infectados por el HIV.
En un grupo de más de 330 niños de 2 a 17 años, la
experta y sus colaboradores evaluaron los efectos de estos fármacos
en el crecimiento. Los resultados del seguimiento mostraron
que, a pesar de la reducción significativa de la carga
viral, los niños tratados con ritonavir experimentaban
alteraciones del crecimiento. La doctora Nachman
explicó estos resultados en un diálogo exclusivo con SIIC.
SIIC: Doctora Nachman, ¿cuáles son las
principales preocupaciones con respecto a los efectos
adversos de la terapia antirretroviral en los niños?
Dra. Sharon Nachman: Existen varios temas de preocupación
en relación con los efectos adversos de la terapia
antirretroviral. Las preocupaciones iniciales son aquellas
que atañen a la toxicidad aguda a corto plazo de los
medicamentos. Aquí se incluyen anomalías en el examen físico
y en los parámetros de laboratorio. Entre las alteraciones
en el examen físico, se pueden observar vómitos, diarrea y
molestias gastrointestinales. Estas aparecen con mayor
frecuencia con los inhibidores de la proteasa. Otras
alteraciones físicas son las erupciones y las neuropatías
periféricas, que se ven con el uso de fármacos análogos o
no análogos de nucleósidos.
Las alteraciones de laboratorio se ven con todos los
antirretrovirales. Entre los efectos tóxicos de los nucleósidos,
se observan tanto anemia como neutropenia y trombocitopenia,
así como indicadores de aumento de la función hepática.
Con los inhibidores de la proteasa se observan anomalías de
la función hepática y del metabolismo de la glucosa,
aumento de la lipasa, y alteraciones del colesterol y los
triglicéridos.
La toxicidad a largo plazo, o efectos colaterales de las
terapias antirretrovirales, incluye la posibilidad de
lipodistrofia, alteraciones en el metabolismo óseo, y
fallas del crecimiento.
Lamentablemente, sabemos muy poco sobre los efectos tóxicos
a muy largo plazo de estos medicamentos.
SIIC: ¿Cómo afecta la infección por el HIV al
crecimiento infantil?
S.N.: Creemos que la carga viral elevada afecta
adversamente el crecimiento de los niños. Existen datos
significativos en la bibliografía que muestran que los niños
con enfermedad avanzada o con sida tienen deficiencias de
crecimiento. Sin embargo, se creyó en el pasado que la
corrección de la viremia elevada permitiría alcanzar un
crecimiento normal.
Un estudio cuyos resultados publicamos en la revista Archives
of Pediatric and Adolescent Medicine en 2002, con un
grupo de niños seguidos en el ACTG Clinical Trial Protocol
338, reveló informaciones sorprendentes. En este estudio,
los niños que estaban asignados a recibir un régimen
antirretroviral altamente activo conteniendo ritonavir, y
que alcanzaron cargas virales indetectables en las semanas
48 y 96 de la terapia, de hecho no mostraron una recuperación
del crecimiento.
Ha habido una extensa discusión en la bibliografía
acerca del crecimiento en los niños infectados por el HIV.
Nuestro equipo ha postulado que pueden existir otros
cofactores involucrados en el crecimiento, al igual que la
terapia que incluye un inhibidor de la proteasa, que pueden
haber afectado negativamente la evolución. Los próximos
estudios deberán evaluar las secuelas a largo plazo de las
terapias que incluyen inhibidores de la proteasa, para
determinar si éste efecto se ve con el ritonavir solamente,
o con otros fármacos de la misma familia.
SIIC: ¿Podría describir el protocolo de ensayo
mencionado? ¿Qué características presentaban los
participantes?
S.N.: El ACTG Protocol 338 fue el primer estudio grande
que evaluó a niños infectados por el HIV que estaban
recibiendo una terapia antirretroviral estable, pero que tenían
niveles de viremia detectables; y que posteriormente fueron
asignados a cambiar la terapia. Entonces, los niños
incluidos en el trabajo que estaban recibiendo una terapia
con inhibidores nucleosídicos solamente, cambiaron por una
terapia con un nucleósido y un inhibidor de la proteasa. El
informe inicial describiendo a esta cohorte, así como los
resultados obtenidos, fue publicado en la revista Journal
of the American Medical Association en 2001.
Lo significativo de este grupo de niños es que, aunque
se observaron diferencias en los niños que alcanzaron
niveles indetectables de carga viral entre los grupos
tratados con d4T y ritonavir o AZT, 3TC y ritonavir, no se
observaron diferencias en el número o el porcentaje de niños
que alcanzaron niveles de menos de 10 000 copias del virus.
Ambos grupos presentaron reacciones de toxicidad
relacionadas con la medicación, sin embargo fueron las
esperadas e inevitables. Los grupos estaban bien emparejados
en lo que respecta a la edad, las características demográficas
el recuento de linfocitos CD4+ y la carga viral.
SIIC: Usted informó que los niños tratados con
ritonavir tenían alteraciones del crecimiento.¿Qué otros
fármacos estaba recibiendo? ¿Podrían éstos haber
influido en el resultado?
S.N.: Todos los niños en este trabajo estaban recibiendo
una terapia con al menos un nucleósido, y un inhibidor de
la proteasa. Así, la mitad estaba tratado con AZT, 3TC y
ritonavir, mientras que la otra mitad recibía d4T y
ritonavir.
No tenemos datos que indiquen que existe una relación
entre las terapias con nucleósidos y las alteraciones del
crecimiento. De hecho, entre los trabajos iniciales que
evaluaban el tratamiento de los niños infectados por el HIV
con nucleósidos, se ha demostrado una recuperación del
crecimiento entre aquellos con retrasos más significativos
en el desarrollo del peso y la altura con estos fármacos
solamente.
Nuestro equipo concluyó que la terapia con inhibidores
de la proteasa que recibían estos niños de alguna manera
puede haber alterado su crecimiento. El mecanismo que
subyace esta asociación aún es desconocido. Otros estudios
en los cuales se utilizaron otros regímenes de terapia
antirretroviral altamente activa (con otros inhibidores de
la proteasa) no han mostrado este retraso en el crecimiento.
Sin embargo, estos trabajos a menudo no tuvieron el poder
suficiente como para comparar diferentes inhibidores de la
proteasa, ni tampoco fueron estudios de cohortes grandes
seguidas durante más de 96 semanas.
Debemos notar que los niños con mayores retrasos del
crecimiento en peso tuvieron una cierta recuperación de
peso y altura inicialmente, cuando se redujo su carga viral.
Sin embargo, en el seguimiento a largo plazo, no hubo una
recuperación de los valores normales.
SIIC: ¿Existen evidencias previas de cambios metabólicos
o nutricionales en adultos tratados con ritonavir, que
pudiesen explicar estos resultados?
S.N.: En mi conocimiento, no hay evidencias actuales que
indiquen una relación entre el ritonavir y el retraso del
crecimiento en adultos. Existen muchas evidencias en este
momento que vinculan a todos los inhibidores de la proteasa
con cambios tanto metabólicos como nutricionales. Sin
embargo, no es seguro cuáles son estos desarreglos metabólicos,
o cuál es la mejor manera de tratarlos.
De hecho, el síndrome completo de lipodistrofia asociada
con la terapia con inhibidores de la proteasa está
actualmente bajo investigación intensiva. Aparentemente hay
cambios en el metabolismo del colesterol y los triglicéridos,
en el de la glucosa, y en el metabolismo óseo. En este
trabajo (el ACTG 338) no se observaron diferencias en cuanto
a la toxicidad entre los niños que presentaban cargas
virales menores a las 10 000 copias y los que presentaban
cargas indetectables, en cuanto a la intolerancia
gastrointestinal a la medicación. Por ende, la suposición
de que los niños con cargas virales indetectables debido al
ritonavir tenían más vómitos y por tanto una mayor
deficiencia del crecimiento es infundada.
SIIC: ¿Considera que esta droga debería evitarse
en el tratamiento de los niños con HIV?
S.N.: Creo que el ritonavir debería seguir formando
parte de las terapias antirretrovirales altamente activas
para los niños infectados por el HIV. Esta droga funciona
extremadamente bien en lo que respecta a la reducción de la
carga viral. Las combinaciones recientemente lanzadas al
mercado (como la de lopinavir con ritonavir), con una dosis
menor de este fármaco, podrían de hecho ser mejores para
los pacientes con HIV, en comparación con el ritonavir
solo. Creo que es muy pronto para decir qué significan
estos datos, y cómo van a poder utilizarse en el
tratamiento de los niños infectados.
Sería importante considerar el uso de ritonavir cuando
los niños llegan a la evaluación con alta carga viral, con
la advertencia de que el equipo de atención médica
controle el crecimiento, y que si parece haber
lipodistrofia, alteraciones del metabolismo de la glucosa o
retrasos en la normalización del crecimiento, se considere
el uso otros inhibidores de la proteasa.
SIIC: ¿Qué apoyo nutricional u hormonal debería
evaluarse en este tratamiento?
S.N.: Nuestro grupo actualmente está investigando este
tema. Existen muchos datos interesantes en la bibliografía
acerca del uso de la hormona del crecimiento o de esteroides
anabólicos en los adultos, sin embargo aún es prematuro
considerar el uso de una terapia con hormona del crecimiento
en estos niños.
En cuanto al apoyo nutricional, creemos que se debería
recomendar que si el niño que no está manteniendo una
ingesta adecuada de calorías, reciba un suplemento
alimentario rico en energía.
Sin embargo, el uso de estos suplementos alimentarios
como rutina no está recomendado por el momento.
La terapia con ritonavir en los niños infectados por
el HIV, si bien es eficaz, podría asociarse con
alteraciones en el crecimiento. La doctora Nachman destaca
la necesidad de controlar estrechamente a los pacientes pediátricos
que reciben este medicamento.
 INVESTIGAN LOS FACTORES ASOCIADOS CON LA OBESIDAD
PEDIATRICA
INVESTIGAN LOS FACTORES ASOCIADOS CON LA OBESIDAD
PEDIATRICA
|
| |

|
Dra.
Arline D. Salbe
Investigadora en Nutrición. National
Institute of Diabetes and Digestive and
Kidney Diseases; National Institutes of
Health.
|
|
Phoenix, EE.UU. (especial para SIIC)
En una entrevista concedida al doctor
Angelo Pietrobelli, la doctora Arline Salbe
comentó los resultados de sus investigaciones sobre los
factores asociados con la obesidad infantil. El doctor
Pietrobelli es Pediatra Endocrinólogo, Especialista en
Obesidad Pediátrica, de la Unidad de Pediatría,
Universidad de Verona. Además se desempeña como Consultor
en Composición Corporal Pediátrica en el New York Obesity
Research Center de la Columbia University, y es Columnista
Experto de SIIC. Ha publicado, entre otros, el
trabajo “Prevención de la Obesidad Pediátrica”,
<
http://www.siicsalud.com/dato/dat026/01n15014.htm>.
La doctora Salbe ha publicado trabajos de investigación
en las revistas Journal of Pediatrics, Journal of Clinical
Investigations y Diabetologia, entre otras. En su trabajo más
reciente, evaluó los factores asociados con el sobrepeso y
la obesidad en un grupo de niños pertenecientes a la etnia
de los Pima, un grupo aborigen norteamericano.
El trabajo incluyó a 65 varones y 73 niñas, que fueron
evaluados entre 1992 y 1995, a la edad de cinco años. En
ese momento, se obtuvieron los datos de la altura, el peso,
la composición corporal, la obesidad en los padres, y las
concentraciones plasmáticas de insulina, glucosa y leptina.
Además, se estimó el nivel de actividad física y el
gasto energético. Estas mismas determinaciones se
repitieron luego de cinco años.
Los resultados del trabajo, explicó la doctora Salbe,
mostraron que, si bien el índice de masa corporal de los
padres y los factores metabólicos se asocian con la
obesidad y la adiposidad a los 10 años de edad, el
principal factor predictor de las mismas es el peso a los
cinco años. Por otra parte, la obesidad a los cinco años
no se relaciona estadísticamente con el nivel de actividad
física, peso sí lo hace a los diez años; este hecho
sugiere que el sedentarismo es consecuencia de la obesidad,
y que no la precede, en este grupo etario.
La doctora Salbe comentó estas observaciones en
un diálogo con SIIC, en el cual destacó la
importancia de la prevención del sobrepeso y la obesidad en
los niños.
SIIC: Doctora Salbe, ¿podría explicarnos la aproximación
utilizada en esta investigación, para el estudio de la
obesidad infantil?
Dra. Arline Salbe: Los indios Pima de Arizona son una
población con una muy alta prevalencia de obesidad, y con
la mayor prevalencia de diabetes informada en el mundo.
Previamente, hemos identificado varias características
metabólicas como factores de riesgo para la obesidad en los
indios Pima adultos. Entre estos factores se cuentan una
relativamente baja tasa metabólica en reposo, un elevado
cociente respiratorio (que indica un bajo nivel de oxidación
de las grasas), una reducida actividad física, y una baja
sensibilidad a la insulina. Este estudio en niños fue diseñado
para determinar si algunas de estas mismas características
son factores de riesgo para la obesidad en este grupo.
Decidimos estudiar a niños pertenecientes a esta población
a los 5 años, ya que un trabajo anterior realizado con
indios Pima de 7 a 10 años mostró que, para esa edad, los
niños de este origen son ya más pesados y más gordos que
los niños caucásicos de similar edad. Aunque habíamos
esperado que no hubiesen diferencias en cuanto a peso y
adiposidad en los niños Pima de 5 años en comparación con
sus pares caucásicos, demostramos que esto no es así, y
que de hecho a esta edad ya tienen sobrepeso.
Sin embargo, realizamos una serie de evaluaciones en
estos niños de 5 años, y luego realizamos las mismas
pruebas en los mismos individuos, a los 10 años. De esta
manera, pudimos determinar si alguna de las características
que determinamos a los 5 años predecía el desarrollo de
obesidad posteriormente.
Utilizamos los valores estándar del US National Center
for Health Statistics, para definir el sobrepeso. El índice
de masa corporal ajustado por la edad y el sexo, mayor o
igual al del percentilo 85 pero menor al del percentilo 95,
se considera indicador de riesgo de sobrepeso, mientras que
un índice superior al del percentilo 95 es considerado
marcador de sobrepeso.
SIIC: ¿Podría detallar los principales hallazgos
de este trabajo sobre los factores de riesgo metabólicos
para la obesidad infantil?
A.S.: Nosotros demostramos que el peso a la edad de 5 años
predice el peso a los 10 años; de hecho, el 72%de la
variación en el peso a los 10 años fue atribuido al peso a
los 5 años. El mismo hecho se verificó para la adiposidad:
el 45% de la masa grasa corporal a los 10 años se atribuyó
al porcentaje de masa grasa a los 5 años.
Esto no deja demasiado espacio para que otros factores
tengan una gran influencia en la variación.
Aún así, observamos que la adiposidad materna (evaluada
mediante el índice de masa corporal) era un factor
significativo en la determinación de la variación tanto
del peso como de la adiposidad a los 10 años; cuanto mayor
peso tenía la madre, más pesado era su hijo, y con más
adiposidad.
Además, las concentraciones plasmáticas de insulina en
ayunas medidas a los 5 años se asociaron negativamente,
mientras que las concentraciones de leptina se asociaron en
forma directa, con el peso y la adiposidad a los 10 años.
Estos resultados indican que en los niños Pima, la
sensibilidad a la insulina predice la obesidad, igual que en
los adultos. A pesar de que el índice de masa corporal de
la madre, la insulina y la leptina contribuyeron en una
pequeña medida a la variación en peso y adiposidad a los
10 años, fueron cofactores de importancia significativa.
SIIC: Una de sus conclusiones fue que las medidas
para prevenir la obesidad infantil deben iniciarse a edad
muy temprana. ¿Podría comentar esta idea?
A.S.: Nosotros observamos que a los 5 años, el índice
de masa corporal promedio de estos niños Pima correspondía
al del percentilo 95 de la población de los Estados Unidos
de la misma edad y el mismo sexo. A los 10 años, el índice
de masa corporal promedio equivalía al del percentilo 97.
Por otra parte, en una publicación reciente, el doctor
Lindsey y sus colaboradores mostraron que los niños Pima
tiene un incremento marcado en el peso, en relación con la
población de referencia, en etapas tan tempranas como los
seis meses de vida, que se hace muy significativo entre los
2 y los 11 años.
Los esfuerzos para promover la reducción del peso
dirigidos a los niños probablemente no tengan mucho más éxito
que los dirigidos a los adultos, los cuales han tenido tasas
de éxito notoriamente bajas; por lo tanto, tiene mucho más
sentido prevenir la obesidad que tratarla. Es mejor que las
medidas para prevenir la obesidad, como la alimentación
saludable y los hábitos de ejercicio, se inicien a edades
tempranas. Muchos investigadores han demostrado que estos hábitos
en etapas tempranas pueden mantenerse durante toda la vida,
y son más fáciles de mantener que de iniciar.
Un niño que aprende a amar la participación en los
deportes cuando es pequeño tiene más probabilidades de
disfrutar las actividades atléticas en etapas posteriores
de la vida.
SIIC: ¿Cuál es la influencia de los padres en el
desarrollo de la obesidad pediátrica, de acuerdo con los
resultados de esta investigación?
A.S.: Observamos que existe una correlación positiva
significativa entre el índice de masa corporal paterno y
materno, y el peso y la adiposidad en los niños. Esto, por
supuesto, significa que cuanto mayores son el peso y la
adiposidad de los padres, mayores son estas variables en los
niños.
También observamos que el índice de masa corporal de la
madre medido cuando el niño tenía 5 años predecía el
aumento de peso y de adiposidad de éste a los 10 años.
Si esta influencia es genética o ambiental, no es
posible saberlo a partir de este estudio. Sabemos que existe
probablemente un componente genético en la obesidad, y que
los niños de esta población tienen un riesgo mayor de
desarrollar obesidad en la edad adulta como resultado del
mismo. Sin embargo, no tenemos evaluaciones de la ingesta de
alimentos, que nos permitirían determinar cuánto de la
influencia familiar proviene de los hábitos de alimentación
similares.
SIIC: En la segunda parte de este estudio, ustedes
evaluaron los efectos del gasto de energía en el desarrollo
de la obesidad en esta cohorte de niños. ¿Podría comentar
los resultados?
A.S.: Nosotros evaluamos el gasto energético a partir de
la tasa de metabolismo en reposo (medida por calorimetría
indirecta), el gasto energético total (TEE, por su sigla en
inglés; medido con el método del agua con doble marca), el
gasto energético de las actividades (AEE), y el nivel de
actividad física.
Nuestra hipótesis era que el TEE bajo, y en especial el
AEE bajo, medidos a los 5 años, podrían predecir el
desarrollo de la obesidad a los 10 años. Esto no fue así
en el grupo completo de niños.
De hecho, encontramos una correlación positiva entre el
TEE a los 5 años y el peso a los 10 años.
Sin embargo, observamos que aquellos niños que ganaron más
peso, y que pasaron de pertenecer a percentilos por debajo
del 85 para el peso a los cinco años, a percentilos
superiores al 95 a los 10, eran niños que no aumentaron su
AEE y nivel de actividad física junto con la ganancia de
peso.
SIIC: ¿Cuáles serían sus recomendaciones para
aumentar el gasto de energía en los niños obesos o con
sobrepeso?
A.S.: Una manera excelente de incrementar el gasto de
energía en los niños con sobrepeso es la actividad
habitual, no competitiva y progresiva, que combine
ejercicios aeróbicos y de tonicidad muscular. A menudo los
niños obesos no sienten que puedan competir en actividades
deportivas.
Sin embargo, otras actividades, como la caminata, la
natación, la equitación y el ejercicio con pesas, son
actividades individuales, que no tiene necesariamente un
componente de competición.
Una vez que el niño a alcanzado un mejor estado físico,
los deportes de competición pueden aumentar su autoestima y
su disfrute del ejercicio.
Las personas pueden ser extremadamente sedentarias e
inactivas, especialmente cuando miran televisión o se
entretienen con juegos de video. Limitar el tiempo en que se
mira televisión, y sustituir esta actividad por pasatiempos
como dibujar, ayudar con las tareas del hogar o cuidar el
jardín, pueden tener un efecto significativo en el nivel de
inactividad, y por lo tanto en el gasto de energía.
SIIC: ¿Cuál es su opinión sobre los programas
escolares dirigidos a prevenir el desarrollo de la obesidad
pediátrica?
A.S.: Las escuelas pueden hacer muchas cosas diferentes
para prevenir la obesidad, especialmente en el área de la
promoción de una alimentación saludable y en el fomento de
la actividad física. Los programas de desayunos y almuerzos
en las escuelas deben brindar menúes pobres en grasas,
llenos de sabor y de variedad, de bajo costo y saludables.
Esto puede parecer mucho pedir para estos programas, pero
por cierto no es mucho más de lo que son capaces de lograr.
Además, las escuelas deberían brindar al menos una hora
de actividad física organizada por día, y se debería
fomentar en los niños la participación en muchos tipos de
actividades diferentes. Los programas de actividades
extraescolares, que ofrecen la participación en deportes
competitivos de equipos, deben promoverse.
Por último, y comenzando desde los primeros grados, las
escuelas deberían brindar información sobre una alimentación
saludable, un peso saludable, y sobre la necesidad de la
actividad física, en las clases de educación para la
salud.
Deberíamos poder hacer un trabajo tan bueno educando a
nuestros niños sobre los estilos de vida saludables, como
el que hacen las industrias de comidas rápidas para
promover sus productos. En los Estados Unidos, el consumo de
comidas rápidas es extremadamente popular, y para combatir
los resultados negativos de la ingesta excesiva de alimentos
necesitaremos creatividad y diligencia, por parte de
nuestros sistemas educativos.
Las observaciones de la doctora Salbe indican que el
sobrepeso y la obesidad deben ser prevenidos desde edades
tempranas, fomentando en los niños un estilo de vida
saludable
|
|
|

|
Trabajos Distinguidos, Serie Pediatría, integra
el Programa SIIC de Educación Médica Continuada
|



