El paso transplacentario de hematíes fetales a la circulación materna puede ser causa de aloinmunización materna contra cualquier antígeno (Ag) fetal heredado del padre y ausente en los hematíes de la madre. La isoinmunización Rh(D) es aún la causa más grave de enfermedad hemolítica del recién nacido (EHRN); los casos de sensibilización a otros Ag eritrocitarios que requieren intervención médica antes del parto son escasísimos.
En las 2 últimas décadas ha disminuido mucho la incidencia de EHRN por isoinmunización Rh(D) gracias al uso generalizado de inmunoprofilaxis con gammaglobulina anti D. Los casos residuales se atribuyen a: no administración de gammaglobulina; administración de dosis insuficiente; inmunización anterior a las 28 semanas de edad gestacional (fecha habitual de administración de la 1ª dosis de inmunoprofilaxis); o transfusión previa a una mujer Rh(D) negativo, en edad fértil, de sangre Rh(D) positiva.1 Las dosis recomendadas de gammaglobulina anti-D son diferentes en distintos países, y van desde 100 µg a 300 µg. En Europa, la pauta más extendida es la administración de una única dosis de 200-300 µg sin realizar cuantificación del volumen de la hemorragia feto- materna (HFM), a pesar de que se prevé que con esta pauta 0.3% de madres Rh(D) negativo se sensibilizarán al Ag D.2 En algunos países, como Inglaterra, se administra una dosis de 100 µg que elimina 4 ml de hematíes fetales D positivo y se realiza sistemáticamente el test de Kleihauer para valorar la necesidad de dosis adicionales para prevenir inmunización. En España, la dosis habitual es de 300 µg, que resulta insuficiente para casos con un volumen de HFM superior a 15 ml y, por otro lado, excesiva en la mayoría de las pacientes. Esta estrategia supone un gasto innecesario de un producto escaso cuya única fuente de obtención hoy día es la inmunización de donantes Rh(D) negativo con hematíes Rh(D) positivo.
La administración de dosis ajustadas de gammaglobulina anti D se basa en la medición precisa del volumen de HFM, ya que una dosis de 100 µg de gammaglobulina anti D neutraliza 4 ml de hematíes fetales.
Tradicionalmente, se han aplicado diversas técnicas de detección de HFM de volúmenes importantes (superiores a 15 ml) basadas en la marcación del antígeno Rh(D), tales como la técnica de antiglobulina enzimática o el test de formación de rosetas. Estos procedimientos no han tenido un uso generalizado por su laboriosidad técnica.3,4 El test de Kleihauer, que se basa en la tinción de la hemoglobina fetal, resistente al pH ácido en contraposición con la del adulto, sigue siendo el más utilizado a pesar de sus limitaciones. Para obtener resultados fiables se precisa personal de laboratorio correctamente adiestrado y experimentado tanto en la realización de la técnica como en la interpretación de los resultados. Es una técnica difícil de estandarizar, subjetiva, poco reproducible y que proporciona resultados falsos positivos en situaciones que cursan con aumento de hemoglobina fetal, tales como hemoglobinopatías o aumento fisiológico de Hb fetal observado en el embarazo.5-7 Recientemente, también se ha aplicado una técnica semicuantitativa de aglutinación en gel basada en el consumo de reactivo anti D por los hematíes fetales Rh(D) positivo. Esta técnica permite discriminar entre resultados negativos y la presencia de hematíes fetales en proporciones de 0.1%, 0.2% y =0.4%, pero debe complementarse con técnicas más precisas como la citometría de flujo para cuantificar volúmenes > 0.4% de hematíes fetales.8 La frecuencia esperada de hematíes fetales en la circulación materna en el embarazo no complicado es inferior al 0.1%. Para asegurar un conteo exacto a concentraciones tan bajas se precisan técnicas muy sensibles y precisas, que analicen gran número de células. La citometría de flujo es una técnica cuantitativa muy precisa por su capacidad para analizar poblaciones celulares individuales, y detecta poblaciones minoritarias en muestras heterogéneas. Se han descripto muy buenos resultados con diversas técnicas citométricas basadas en la marcación de Ag presentes en los hematíes fetales y ausentes en los hematíes de la madre: Ag D en incompatibilidad Rh(D) o en la marcación de hemoglobina fetal.9-13 La técnica citométrica basada en la tinción de la hemoglobina fetal es algo más laboriosa que la marcación del Ag D, ya que requiere pasos intermedios de fijación y permeabilización antes de la tinción. Permite aplicar la detección de hematíes fetales a diferentes situaciones clínicas y no condiciona su utilización a la incompatibilidad Rh(D). Tiene la ventaja adicional sobre el test de Kleihauer de no sólo detectar la presencia o ausencia de hemoglobina fetal sino cuantificar el contenido de ésta. Por tal razón, la técnica citométrica es capaz de diferenciar los hematíes fetales verdaderos de los hematíes con aumento del contenido en hemoglobina F que se observan en otras patologías como la persistencia hereditaria de hemoglobina fetal o el aumento fisiológico de hemoglobina fetal en los hematíes maternos durante el embarazo. En estos procesos, en los que es menor la concentración eritrocitaria de hemoglobina fetal, la señal de fluorescencia emitida es menos intensa, quedando dicha población claramente diferenciada de la de los hematíes fetales.14-16 La técnica citométrica de tinción del Ag D supone una simplificación metodológica respecto a los tests tradicionales. En el método directo se utiliza un único reactivo anti D conjugado con un fluorocromo, mientras que en el indirecto se realiza una primera incubación de la muestra con reactivo anti D, seguido de la adición de un reactivo anti IgG conjugado con fluorocromo. Se puede aumentar la sensibilidad de la técnica añadiendo biotina-anti IgG humana y posteriormente estreptavidina-conjugada con un fluorocromo.17 El método directo es más sencillo, rápido y barato, si bien en los casos con antecedentes de gammaglobulina anti D, el bloqueo de Ag D por la inmunoglobulina administrada puede condicionar una señal fluorescente débil y dificultar la diferenciación de hematíes Rh(D) positivo y Rh(D) negativo.12,18 La tinción indirecta es más laboriosa, pero produce una señal de fluorescencia más intensa en los hematíes D positivo. La utilización de fragmentos Fab de anti IgG, en vez de la molécula completa, puede eliminar la aglutinación de hematíes D positivo observada en volúmenes importantes de HFM. Las células aglutinadas son detectadas por el citómetro como un único evento, condicionando cierta subestimación en el volumen de la HFM. Con volúmenes pequeños (< 5 ml) no se observan dichos aglutinados.18-20 En el análisis citométrico, la población eritrocitaria a estudio es claramente identificable por la señal de dispersión de luz láser del citómetro. La interferencia en la cuantificación de la HFM por otras células (leucocitos o plaquetas) no es significativa. Por lo tanto, no es necesaria la selección positiva de los hematíes marcando Ag adicionales como glicoforina A, que encarece y hace más laboriosa la técnica. Por otro lado, la adquisición en escala logarítmica para la señal de dispersión de luz frontal (forward scatter) y lateral (side scatter) permite excluir los detritus de la ventana de adquisición de los hematíes.
Se recomienda adquirir la señal de un mínimo de 50 000 hematíes para garantizar la cuantificación precisa en el rango de los volúmenes esperados.21 En nuestro laboratorio hemos aplicado varias técnicas citométricas para la cuantificación de la HFM.22 En cada tanda de trabajo se incluyen muestras como control negativo, y positivos en una proporción del 100%, 3% y 0.3% de hematíes fetales para ajustar los dinteles de identificación de éstos.
Inicialmente, en 85 muestras aplicamos la técnica de tinción de hemoglobina fetal y en 35 de ellas con incompatibilidad Rh(D) se realizó además inmunofluorescencia indirecta para la marcación del Ag D. En 5 pacientes se detectó 0.1% de hematíes fetales (1.8 ml) y en otros 5 pacientes, 0.2% (3.6 ml), mientras que en las restantes no se detectó HFM. En las 35 muestras analizadas en paralelo, se obtuvo concordancia de los resultados de los dos procedimientos en todas la muestras: 2 presentaron volúmenes de 0.1% de hematíes fetales, 1 paciente presentó un volumen de 0.2% y en las muestras restantes no se detectó HFM.
Posteriormente hemos aplicado la técnica de inmunofluorescencia directa de marcación del Ag D presente en los hematíes fetales D positivo y ausente en los hematíes de la madre Rh(D) negativo en muestras de puérperas con incompatibilidad Rh(D). Para ello hemos utilizado un conjugado FITC-BRAD-3.
De 274 muestras analizadas, en 255 (93%) el volumen de HFM fue muy pequeño, inferior a 4 ml; en 5 (1.8%) se detectaron volúmenes de 8 ml; y una paciente presentó un volumen de 17 ml.
Nuestros resultados concuerdan con los de otras series, que dan una frecuencia estimada de hematíes fetales en la circulación materna por debajo de 0.1% en el embarazo no complicado.
La señal fluorescente de la población minoritaria de hematíes fetales es claramente discriminatoria de la población no fluorescente de hematíes del adulto; no fue necesaria la amplificación de la señal con un anticuerpo secundario, puesto que no hubo ninguna interpretación que resultara dudosa.
La técnica de inmunofluorescencia directa de tinción del Ag D es la que hemos adaptado para ser empleada de forma rutinaria por ser una técnica sencilla, precisa y rápida, que permite su aplicación para la profilaxis con dosis ajustadas de gammaglobulina anti D. En nuestra serie, la administración de una dosis de 100 µg para proteger, frente a una hemorragia feto-materna de 4 ml, habría resultado suficiente en el 97% de los casos; ello supone un ahorro importante en el consumo de gammaglobulina anti D. Solamente un caso presentó un volumen de hemorragia de 17 ml y precisó una dosis adicional de gammaglobulina anti D.
BIBLIOGRAFIA
- Bowman J.M., Pollock J.M.
Failures of intravenous Rh immune globulin prophylaxis: An
analysis of the reasons for such failures. Transfus Med Rev,
1987; 1: 101-102
- Committee for Proprietary
Medicinal Products. Notes for guidance: core summary of
product characteristics for human anti-D immunoglobulin.
Brussels: Commission of European Communities,
1992(111(3463/92-EN)
- Duguid J.K.M. and Bromilow
I.M. Laboratory measurement of feto-maternal haemorrhage and
its clinical relevance. Transfusion Medicine Reviews, 1999;
13: 43-48
- Polesky H.F. and Sebring E.S.
Evaluation of methods for detection and quantitation of foetal
cells and their effect on Rh IgG usage. Am J Clin Pathol,
1981; 76: 525-529
- Duguid J.K.M. et al. Kleihauer
testing and Flow Cytometry. A Comparative study for Assessment
of Feto-Maternal Haemorrhage. Haematology, 1996; 1: 79-83
- Bayliss K.M., Kneck B.D.,
Johnson S.T. et al. Detecting feto-maternal haemorrhage: a
comparison of five methods. Transfusion 1991; 31: 303-7
- Clarke C.A., Prophylaxis of
rhesus iso-immunization. Br Med Bull, 1968; 24: 3-9.
- Salama A., David M., Wittman
G. et al. Use of the gel agglutination technique for
determination of feto-maternal haemorrhage. Transfusion, 1996;
38: 177-180
- Bromilow I.M., Duguid J.K.
Measurement of feto-maternal haemorrhage: a comparative study
of three Kleihauer techniques and two flow cytometry methods.
Clin Lab Haematol, 1997; 19: 137-142
- Lloyd-Evans P, Kumpel B.M.,
Bromilow I. et al. Use of a directly conjugated monoclonal
anti-D (BRAD-3) for quantitation of feto-maternal haemorrhage
by flow cytometry. Transfusion, 1996; 36: 432-437
- Davis B.H., Olsen S., Bigelow
N.C., Chen J.C. Detection of foetal red cells in foeto-
maternal haemorrhage using a foetal haemoglobin monoclonal
antibody by flow cytometry. Transfusion, 1998; 38: 749-756
- Nance S.J., Nelson J.M., Arndt
P.A. et al. Quantitation of foetal-maternal haemorrhage by
flow cytometry. A simple and accurate method. Am J Clin
Pathol, 1989; 91: 288-292
- Fong E. A., Davies J.I., Grey
M.E., Reid P.J., Erber W.N. Detection of massive
transplacental haemorrhage by flow cytometry. Clin Lab Haem,
2000; 22:325-327
- Nelson M., Zarkos K., Popp H.
Et al. A Flow Cytometric equivalent of The Kleihauer test. Vox
Sanguinis, 1998; 75: 234-241
- Weaver D. L., Barthold J.C.,
Hamill B. et al. Hereditary persistence of foetal haemoglobin
presenting as maternal-maternal haemorrhage. Am J Pathol,
1990; 93: 277-80
- Campbell T. A., Ware R.E.,
Nason M. Detection of Hemoglobin variants in erythrocytes by
Flow cytometry. Cytometry, 1999; 35: 242-248
- Cupp J.E., Learn J.F.,
Cernichiari E. et al. Rare-event analysis methods for the
detection of foetal red blood cells in maternal blood.
Cytometry, 1984; 5:138 144
- Kumpel B.M. Labeling D+RBCs
for flow cytometric quantification of fetomaternal hemorrhage
after the RBCs have been coated with anti-D. Transfusion,
2001; 41: 1059- 1063
- Nelson M., Popp H., Horky K.
et al. Development of a flow cytometric test for the detection
of D-positive maternal cells after feto-maternal hemorrhage
and a survey of the prevalence in D negative women.
Inmuno-haematology, 1994; 10: 55-59
- Johnson P.R., Tait R.C.,
Austin E.B., et al. Flow cytometry in diagnosis and management
of large feto-maternal haemorrhage. J Clin Pathol, 1995; 48:
1005-1008
- Kumpel B.M. Analysis of factor
affecting quantification of fetomaternal hemorrhage by flow
cytometry. Transfusion, 2000; 40: 1376-1383
- Gomez-Arbones X. Pinacho A.
Ortiz P. Macia J. Gallart M. Araguas C. Sanchez J.M. Teixido
M. Quantification of foetomaternal haemorrhage. An analysis of
two cytometric techniques and a semiquantitative gel
agglutination test. Clin Lab Haem, 2002; 24: 47- 53
 ASOCIACION ENTRE TABAQUISMO PASIVO Y ASMA BRONQUIAL EN NIÑOS DE 2
A 14 AÑOS
ASOCIACION ENTRE TABAQUISMO PASIVO Y ASMA BRONQUIAL EN NIÑOS DE 2
A 14 AÑOS
 |
|
Autor:
Olimpio Rodríguez Santos
Columnista Experto de SIIC
Especialista de l l Grado en Alergología.
Investigador Agregado. Hospital Pediátrico Provincial
"Eduardo Agramonte Piña", Camagüey, Cuba
Institución:
Hospital Pediátrico Provincial "Eduardo Agramonte Piña",
Camagüey, Cuba |
Introducción
El asma afecta a personas de todas las edades, y la causa
principal es la enfermedad crónica en la infancia.1 Se
ha definido en términos fisiológicos como un estado de
hiperrespuesta de las vías aéreas.2 La hiperrespuesta se
manifiesta como broncoconstricción después del ejercicio y la
exposición natural a olores fuertes o humos irritantes tales como
el dióxido de sulfuro, el humo del tabaco o el aire frío.1.
Entre los diversos factores desencadenantes o agravantes del asma,
el tabaquismo ocupa un lugar preponderante. La aspiración del
humo del cigarro altera los procesos de purificación pulmonar y
provoca cambios de los espacios alveolares así como la destrucción
de los tabiques alveolares. La transformación del epitelio mucoso
(que cubre internamente los bronquios y los bronquiolos y
convierte el teji do de cilindrocelular en planocelular) también
contribuye a la aparición de células bronquiales atípicas,
elevada secreción de flema, inflamación, hipertrofia de la
musculatura lisa, estrechamiento y destrucción de las vías
respiratorias menores, y alteraciones inmunológicos que reducen
las funciones defensivas del organismo.3 Todas las
funciones fisiológicas se encuentran significativamente
disminuidas en los fumadores; su capacidad vital es de 400 a 600
ml menor que la no fumadores.
El asma bronquial aparece entre los fumadores como consecuencia de
sensibilidad aumentada al tabaco, y durante ello desempeña un
papel esencial el espasmo bronquial permanente, que se refuerza
bajo la acción del humo4 El humo puede separarse en
una fase gaseosa y otra sólida o particulada.5 La fase
particulada contiene nicotina, agua y alquitrán y la fase
gaseosa, monóxido de carbono, anhídrido carbónico, óxidos de
nitrógeno, amonía co, nitrosaminas volátiles, cianuro de hidrógeno,
alcoholes, aldehídos y cetonas.
La nicotina es el componente más importante por su gran cantidad
de acciones farmacológicas complejas y marcada toxicidad. Una
fracción significativa de nicotina inhalada es metabolizada en el
pulmón. Los principales metabolitos de la nicotina son la
cotinina y la nicotina-1-N-óxido, que se forman respectivamente
por oxidación del carbono alfa y por N-oxidación del anillo de
pirrolidina. La excreción urinaria de cotinina y la exposición
al humo de tabaco ambiental se asocian con morbilidad pulmonar en
niños con asma.6,7 Las madres que fuman durante el
embarazo incrementan el riesgo de asma en sus hijos8
con significativo aumento de la concentración de IgE sérica en
los recién nacidos.9 Estos niños, si siguen expuestos
al humo del tabaco durante la primera infancia, manifiestan síntomas
de asma en edades tempranas de la vida.
Por otro lado, la eficacia de las intervenciones para evitar el hábito
de fumar durante el embarazo se evidencia en el menor riesgo de
los niños de padecer la en fermedad.10 Los infantes
que viven con padres fumadores presentan crisis recurrentes de
asma con más frecuencia que los que conviven en un ambiente donde
no se practica este hábito.11-17 La cantidad de
cigarrillos crece con el riesgo,18,19 y cuando los
familiares dejan de fumar las crisis de los niños asmáticos que
conviven en esos hogares se hacen menos severas y frecuentes.20
En nuestro municipio, los niños fumadores pasivos conforman un
grupo significati vo. Ello provoca en la población de asmáticos
elevado consumo de medicamentos y asistencia a los servicios de
salud, lo cual constituye un serio problema en atención primaria.
El presente trabajo tiene el objetivo de conocer la eventual
asociación de este factor de riesgo con el asma bronquial.
Material y método
Se realizó un estudio de casos y controles en 200 niños asmáticos
moderados y severos según consenso internacional,21
con edades comprendidas entre 2 y 14 años para un nivel de
confianza del 95%. Eran residentes de la cabe cera municipal de
Camagüey y asistíaan regularmente a la consulta de Alergología
de esta localidad. Se consideraron casos los asmáticos que en el
período de un año habían tenido evolución inestable; y
controles aquellos de evolución estable en el mismo período,
acorde a definiciones operacionales establecidas. La muestra
estuvo representada por 100 casos y 100 controles. Se administró
una encuesta para la recolección de la información en ambos
grupos. La cantidad de cigarrillos que se consumían diariamente
en los hogares de fumadores se determinó según la escala:
- Menos de 20 cigarrillos
- De 20 a 40 cigarrillos
- Más de 40 cigarrillos
El parentesco del fumador activo con el niño asmático quedó
establecido con el método siguiente:
- Madre fumadora
- Padre fumador
- Otro familiar fumador
- Madre y padres fumadores
- Madre, padre y otros familiares fumadores
El número de ingresos hospitalarios durante el año que precedió
a la ejecución del cuestionario fueron recuperados del registro
de admisión y el archivo del hospital.
El consumo de broncodilatadores y esteroides se recogió de la
historia clínica.
Definiciones operacionales
- Inestables (casos) . Asmáticos clasificados
como moderados o severos que presentaron síntomas recurrentes
de asma a pesar de haber cumplido con el tratamiento
intercrisis
- Estables (controles) . Asmáticos clasificados
como moderados o severos que no presentaron síntomas
recurrentes de asma y cumplían el trata miento intercrisis
- Consumo de broncodilatadores. Pacientes que
consumían broncodilatadores de forma permanente y durante 6 o
más meses en el año
- No consumo de broncodilatadores. Pacientes que
consumían broncodilatadores de forma intermitente y durante
menos de 6 meses en el año
- Consumo de esteroides. Pacientes que consumían
corticoste roides sistémicos a diario o más frecuente de lo
estipulado según consenso inter nacional para el tipo de asma
- No consumo de esteroides. Pacientes que no
consumía corti costeroides sistémicos
- Mala calidad de vida. Todo paciente que
presentaba la carac terística siguiente:
• respuesta no óptima a la terapia del
asma
• dificultad para comer, dormir, caminar,
hablar
• usualmente agitado, confundido,
somnoliento o con pérdida de la conciencia
• aumento de la frecuencia respiratoria
por encima de 40 por minuto
• retracciones suprasternales torácico
abdominales y movimiento paradójico por empleo de los músculos
accesorios (escaleno y esternocleidomastoideo)
• presencia de sibilancias o ausencia en
paro respiratorio inminente
• pulso por minuto mayor de 120 o
bradicardia en paro respiratorio inminente
• espiración con los labios fruncidos y
aleteo nasal
• cianosis, miosis, papiledema y
alteraciones sensoriales
- Buena calidad de vida. Paciente activo en el
ejercicio que ob tiene control de los síntomas, puede
prevenir las exacerbaciones, no presenta reacciones adversas
de los medicamentos y es capaz de dormir toda la noche
Resultados
Entre los 200 niños asmáticos había 124 del sexo masculino y 76
del femenino, de edades promedio 9.7 y 8.9 años, respectivamente.
Presentaban asma moderada 154 y severa 46.
El consumo de broncodilatadores fue similar en los expuestos y en
los no expuestos al humo del cigarro (razón de ventajas [RV] =
1.83; intervalo de confianza del 95% [IC 95%], 0.83-4.07). Sin
embargo, el consumo de esteroides fue superior en los expuestos
que en los no expuestos al factor de riesgo (RV = 9.61; IC 95%,
4.80-19.22).
La tabla 1 muestra que 72% de los niños con mala calidad de vida
están expuestos al humo del tabaco ambiental, contra 12% de los
que tienen buena calidad de vida (RV = 18. 86; IC 95%,
8,96-39.70).

Con relación a la asociación del factor de riesgo en los casos y
controles, se observa en la tabla 2 que 72% de los primeros están
expuestos al humo del tabaco contra 16% en los controles (RV =
13.50; IC 95%, 6.77-26.92).

La asociación entre el parentesco, cantidad de cigarrillos que se
fumaban en el hogar durante el día y la exacerbación del asma
bronquial en los niños se expresa en la tabla 3, donde se aprecia
que cuando fumaba la madre, el padre y otro familiar el riesgo de
asma era mayor (RV = 4.50; IC 95%, 2.46-8.23). También fue ma-
yor el riesgo de exacerbación de las crisis en los niños que vivían
en un hogar donde se fumaban más de 40 cigarrillos en el día (RV
= 5.02; IC 95%, 2.72-9.28)

Discusión
Un número cada vez mayor de infantes acude a las consultas por
crisis recurrentes de asma bronquial, sin que los familiares se
percatan de la relación que puede existir entre el tabaquismo del
adulto y la enfermedad del niño. Justamente, la prevención de éste
y otros factores de riesgo constituye la piedra angular del
tratamiento de la enfermedad. Mucho se ha escrito sobre la
influencia de los componentes del tabaco en los fumadores activos
y en los pasivos. Chilmonezy16 comunicó niveles de
cotinina en orina de 5.6 ng en niños que no habían estado
expuestos al humo del cigarro, y de 55.8 ng en los que habían
estado expuestos.
En nuestra investigación se demuestra que los niños expuestos al
humo del tabaco presentan mayor probabilidad de tener crisis de
asma más graves y frecuentes que los no expuestos. Los resultados
son congruentes con los obtenidos en investigaciones realizadas en
la provincia Camagüey18 y con los informes de autores
de otros países, que también encuentran una relación
directamente proporcional entre la cantidad de cigarrillos
consumidos en estos hogares y la mala calidad de vida de los
pacientes.19 La relación se ha puesto de manifiesto,
además, en investigaciones que muestran cómo el contacto directo
de la madre y el niño hace más grave aún la relación entre el
fumador pasivo niño y el fumador activo madre.20 En
conclusión, la cantidad de cigarrillos consumidos en el hogar y
el número de fumadores que conviven con el niño demostraron
guardar relación directa con el riesgo; es decir, su aumento
conlleva incrementos en el riesgo para la salud del niño.
BIBLIOGRAFIA
- Behrman R.E, Kliegman R.M,
Arvin A.M. Tratado de pediatría Nelson 15a edición Vol, 1.
Madrid, Interamericana, 1997: 787 - 802.
- Lawlor GJ, Fischer TJ. Manual
de alergia e inmunolog'ia. Diagnóstico y tratamiento 2da
edición, Barcelona, Salvat, 1990: 139 - 201.
- Buttows. B. Et al:
Quantitative relationships Between Cigarette Smoking and
Ventilatory Funtion. Am Rev. Resp Dis 1977, 115: 195 - 205.
- Doll. R, Hill AB. Lung Cancer
and other causes of death in relation to smoking: A second
report on the mortality of british Doctor. Br Med. J. 1956, 2:
1071 - 81.
- Goodman G.A, Gooman LS, Gilman
A. Las bases farmacológicas de la terapéutica, tomado de la
6ta edición 1980. Ciudad de la Habana, Editorial Científico
Técnica 1984: 554 - 57.
- Chilmonzyk BA. Association
between exposure to environmental tobacco smoke and
exacerbations of asthma in children N Engl. Med. 1993, 328
(23): 1665 - 9.
- Kuehr J, Frischer T, Karmaus
W, Meinert R, Prachtt, Lehnert W. Cotinine excretion as a
predictor of peak flow variability. Am J respir crit care Med.
1998, 158 (1): 60 - 4.
- Hanrahan JP, Halonen M.
Antenatal Interventions in childhood asthma. Evr Respir J
Suppr 1998, 27: 46 - 51.
- Strchan DP, Cook DG, Health
effects of passive smoking. Parental smoking and allergic
sensitization in children. Thorax 1998, 53 (2): 117 - 23.
- Peat J, Bjorksten B. Primary
and secondary prevention of allergic asthman. Evr respir J.
Suppl. 1998, 27: 28 - 34.
- Brigante E, Cirillo G, Aurelio
G, Nocerinog; Carbone MT, de seta L. Recur- rent asthmatic
bronchitis in the first years of life: a 3 year followup
pediatr Med Chir 1998, 20 (3): 205 - 8.
- Lundback B. Epidemiology of
rhinitis and asthma, clin exp allergy 1998, 28 (suppl 2): 3 -
10.
- Saradar Y, Sekerel BE,
Kalaycio, cetinkaya F, Adalioglu G, Tuncer A, Tezcans.
Prevalence of asthma symptoms in school children in Ankara,
Turkey. Respir Med 1998, 92 (2): 203 - 7.
- Esamaifo. Relationship between
exposure to tobacco smoke and bronchial asthma in children: a
review. East Atr Med J 1998, 75 (1): 47 - 50.
- Knight JM, Eliopoulus C, Klein
J, Greenwald M, Korens Pharmacokinetic. Predisposition to
nicotine from environmental tobacco smoke: a risk factor for
pediatric asthma. J. Asthma 1998, 35 (1): 113 - 7.
- Gergen PJ, Fowler JA, Maurer
KR, Davis WW, Overpeckmd. The burden of environmental tobacco
smoke exposure on the respiratory health of children 2 months
through 5 years of age in the united states: Third National
Health and nutrition examination survey, 1998 to 1994.
Pediatrics 1998, 101 (2): E 8.
- Withers NJ, Low L, Holgate ST,
Clough JB. The natural history of respiratory symptoms in a
cohort of adolescents [see comments]. Am J. Respir crit care
Med. 1998, 158 (20: 352 - 7.
- Rodríguez SO, Ferrer RI,
Quintana CE, Rodríguez GA. Influencia del taba- quismo en el
asma bronquial de niños menores de 5 años. Pediatrika 2000,
20 (4): 167-70.
- Chen Y, Rennie DC, Rosman JA.
Influence of environmental tobacco smoke on asthma in
nonallergic and allergic children. Epidemiology 1996, 7 (50):
355 - 59.
- Brand PL, Duiverman EJ.
Coughing and wheezing children: improvement after parents stop
smoking. Ned Tijdschr geneeskd 1998, 142 (15): 825 - 7.
- National Heart, Lung and Blood
Institutes, National Institutes of Health. Bethesda, Maxyland
20892, Publication No. 92 - 3091, March 1992. International
consensus report on diagnosis and treatment of asthma. Eur
Respir J 1992; 5:601 - 41.
 LIMITANDO CUIDADOS INTENSIVOS EN CRIANÇAS MUITO DOENTES SEM
ESPERANÇA DE VIDA
LIMITANDO CUIDADOS INTENSIVOS EN CRIANÇAS MUITO DOENTES SEM
ESPERANÇA DE VIDA
 |
|
Autor:
Paulo Roberto Antonacci Carvalho
Columnista Experto de SIIC
Pediatra Intensivista (Especialização: Terapia
Intensiva Pediátrica/Bioética) Assistente da UTI Pediátrica
do Hospital de Clínicas de Porto Alegre, Universidade
Federal do Rio Grande do Sul, Porto Alegre
Institución:
Hospital de Clínicas de Porto Alegre, Universidade
Federal do Rio Grande do Sul, Porto Alegre, Rio Grande do
Sul, Brasil |
Introdução
A idéia do trabalho seguiu-se a uma apresentação de estudo
ocorrida nos EUA, por ocasião de encontro de terapia intensiva
pediátrica no estado de Utah, em 1992, quando o Dr. JM Dean
mostrou como morriam as crianças de sua UTIP naquela localidade.
O estudo foi publicado no ano seguinte no Critical Care
Medicine, sob o título «Modes of death in the pediatric
intensive care unit: withdrawal and limitation of supportive care».1
A primeira pergunta que nos intrigou foi: Como, modos de
morte?Todos morrem de insuficiência de um ou vários sistemas orgânicos.
Mas não era simplesmente causa de morte. Era o modo como os
pacientes, pela “intervenção” ou pela “omissão” da
equipe da UTI morriam ou eram deixados morrer. Para mim, era um
novo enfoque da morte que ocorria na UTI. Caíam por terra
conceitos mais ortodoxos aprendidos no curso médico de preservação
da vida a qualquer custo.
Em 1993, quando se iniciava a publicação da Revista de Bioética,
fomos convidados a escrever sobre o paciente terminal de UTI.2
Buscávamos fontes de informação na literatura, sendo a maioria
delas em periódicos norte-americanos. Não havia quase publicações
sobre o tema no Brasil. Percebíamos que as diferenças culturais,
as influências religiosas e as incertezas de ordem legal
dificultavam a abordagem do assunto sobre limitações terapêuticas
no nosso meio, e possivelmente em toda a América Latina.
Mas a questão era: a dificuldade de abordagem ou de relato no
enfoque da limitação terapêutica em pacientes com pouca ou
nenhuma chance de sobrevivência nas UTIs ocorreria na prática do
dia-a-dia das unidades no Brasil?
O desafio
Propusemos a realização de estudo retrospectivo na UTI Pediátrica
onde desenvolvemos a nossa atividade docente-assistencial, no
Hospital de Clínicas de Porto Alegre (HCPA), uma vez que entendíamos
ser de boa qualidade o registro em prontuários na mesma. Pensamos
fazê-lo primeiramente com o desenho retrospectivo, até porque a
chance de viés de aferição com um desenho prospectivo seria
muito grande.
O projeto foi enviado para o Comitê de Ética e Pesquisa do HCPA
com o título «Estudo retrospectivo sobre o modo de morrer de
pacientes internados na UTIP do HCPA». Aquele comitê propôs a
mudança para «modo de morte», sugerindo que a proposta seria
mais comprensível. Respondemos, firmando posição em manter «modo
de morrer», pois atenderia melhor a um dos objetivos do trabalho;
que era «identificar o tipo de atendimento recebido pelos
pacientes durante a morte na UTIP».
A proposta do estudo era a de revisar os prontuários de pacientes
que tivéssem morrido na UTIP no período de um ano, quando teríamos
entre 50 e 60 pacientes. Nossa taxa de internação anual era de
aproximadamente 450 pacientes e a taxa de mortalidade ficava em
torno de 12%. Na realidade, em função dos óbitos ocorridos nas
primeiras 24 horas de admissão e das exclusões por falta de
informações, a nossa amostra ficou reduzida a 44 pacientes.
Elaboramos um instrumento de registro de dados e utilizamos uma
classificação de modos de morrer que havia sido utilizada no
estudo original de Vernon e cols. e de outros estudos da
literatura.1,3-6 Então, testamos o instrumento de
registro para avaliar o grau de dificuldade no levantamento dos
dados necessários para a pesquisa.
Na avaliação do instrumento de registro de dados já observávamos
que o registro das particularidades da morte de muitos pacientes não
era claro. Tivemos que pesquisar dados de evolução, de prescrição
e de registro de enfermagem, para juntos montar o cenário dos últimos
dias ou horas dos pacientes que morreram na UTIP. Assim, por
exemplo, na evolução de um determinado paciente estava
registrado «paciente sofreu parada cardiorrespiratória na hora
tal, tendo sido constatado o óbito»; na prescrição não
aparecia registro de medicações usuais da ressuscitação
cardiorrespiratória; no registro de enfermagem aparecia apenas o
horário do óbito. A conclusão dos autores era a de que a equipe
tinha uma orientação, não explícita ou registrada em prontuário,
de não ressuscitação do paciente em caso de parada
cardiorrespiratória.
Inclusive, os resultados preliminares do estudo foram divulgados
na página eletrônica do Núcleo Interinstitucional de Bioética
do HCPA (www.ufrgs.br/HCPA/gppg/bioetica.htm), no ano de 1998.7
Nessa publicação eletrônica, os autores discriminavam os modos
de «não adoção» e de «retirada de medidas de suporte de vida»
pesquisados no trabalho, ainda que não se detectasse com exatidão
diferenças nessas tomadas de decisão por parte da equipe da
UTIP, e o número de pacientes era reduzido para mostrar diferenças
estatísticas.
Da mesma forma, os dados obtidos nos prontuários não nos
permitiram tirar outras conclusões em relação à discussão e
à tomada de decisão da equipe quanto à limitação terapêutica:
quando ocorreu, de que forma ocorreu, quem da equipe participou,
qual o conhecimento da família em relação à decisão e qual a
participação da família nesse processo.
A realidade local
Os resultados dos modos de morrer obtidos no estudo, 41% dos
pacioentes com modos de morrer sugestivos de atitudes
assistenciais limitadoras, de certa forma, surpreenderam a todos nós,
porque mostravam que também no nosso meio ocorre a limitação
terapêutica nas UTIs, embora isso não seja tacitamente
reconhecido, pelas razões já referidas anteriormente. Começamos
a nos perguntar se essa prática, apesar de ser éticamente
sustentável, estaria sendo éticamente adotada. Se toda a equipe
estaria participando do processo de tomada de decisão (consenso).
Se a família também estaria tomando conhecimento desse processo
(revelação).
Após redação do trabalho, ao qual demos o título «Identificando
restrições nos cuidados intensivos em crianças sem esperança
de vida», enviamos o mesmo para periódico pediátrico
conceituado no meio científico brasileiro. Após avaliação dos
revisores, sem restrições, houve uma manifestação do seu
conselho editorial no sentido de verificar se efetivamente os
autores estariam dispostos a publicá-lo e arcar com as suas
consequências, por se tratar de estudo muito polêmico. Frente a
tal posicionamento, resolvemos cancelar a sua publicação e
discutir mais cautelosamente as eventuais implicações de sua
publicação.
Após exautiva discussão, entendemos que a sua não divulgação
apenas manteria o status de atitudes inadequadas e unilaterais em
relação à prática da limitação terapêutica, que
provavelmente ocorrem em muitas UTIs do nosso país.
Então, resolvemos apenas mudar o nome do estudo para «Modos de
morrer na UTI Pediátrica de um hospital terciário», e optamos
por publicá-lo na Revista da Associação Médica Brasileira,
com maior abrangência no meio médico, e que avaliou o trabalho e
publicou-o em tempo recorde (menos de 6 meses), sem objeções ou
restrições.8
Mudança de atitude
Em relação à prática que o estudo revelou na nossa UTIP, fomos
buscar apoio no Comitê de Bioética do HCPA, e durante mais de
dois anos realizamos reuniões semanais dentro da UTIP,
objetivando a discussão dos aspectos bioéticos que permeiam o
atendimento dos pacientes criticamente doentes e o melhor manejo
dos dilemas relacionados ao atendimento de pacientes em final de
vida. Essa experiência motivou uma apresentação por ocasião do
III Congresso Mundial de Terapia Intensiva Pediátrica, em
Montreal (Canadá), em 2000.9 Percebemos um
amadurecimento muito grande da equipe nos posicionamentos bioéticos
com pacientes criticamente doentes. Na prática, passamos a
realizar processos de tomada de decisão para limitação terapêutica
com discussão em equipe e de forma consensual.
Passamos também a compartilhar com as famílias essas decisões médicas,
respeitando muitas vezes a sua discordância na decisão proposta
pela equipe. Da mesma forma, passamos a registrar as decisões na
evolução de prontuário médico.
Tais atitudes resultaram no planejamento e realização de um
segundo estudo, com o mesmo desenho do anterior, que está em
andamento e que está avaliando os registros de pacientes que
morreram na unidade durante o ano de 2002.
O crescimento da equipe e o nível das discussões sobre dilemas e
conflitos na UTIP determinou também o interesse do Comitê de Bioética
de participar mais proximamente das discussões de pacientes da
UTIP. Hoje, alguns dos membros desse comitê participam dos rounds
clínicos da UTIP, pelo menos uma vez na semana, resultando em
contribuição mútua.
BIBLIOGRAFIA
- Vernon DD et al. Modes of
death in the pediatric intensive care unit: withdrawal and
limitation of supportive care. Crit Care Med 1993;
21:1798-802.
- Piva JP, Carvalho PRA.
Considerações éticas nos cuidados médicos do paciente
terminal. Bioética 1993; 1:129-38.
- Prendergast TJ, Claessens MT,
Luce JM. A national survey of end-of-life care for critically
ill patients. Am J Respir Crit Care Med 1998; 158:1163-7.
- Jefferson LS, White BC, Louis
PT, Brody BA, King DD, Roberts CE. Use of the natural death
act in pediatric patients. Crit Care Med 1991; 19:901-5.
- Koch KA, Rodeffer HD, Wears
RL. Changing patterns of terminal care manegement in an
intensive care unit. Crit Care Med 1994; 22:233-43.
- Kjellstrand CM. Who should
decide about your death?JAMA 1992; 267:103-4.
- Goldim JR, Carvalho PRA. Os
modos de morrer em Unidades de Tratamento Intensivo. Disponível
em http://www.ufrgs.br/HCPA/gppg/modo.htm.
- Carvalho PRA, Rocha TS, Santo
AE, Lago P. Modos de morrer na UTI Pediátrica de um hospital
terciário. Rev Ass Med Brasil 2001; 47:325-31.
- Carvalho PRA, Trotta EA,
Goldim JR. A new proposal for a bioethical approach to
critically ill patients. Pediatr Crit Care Med 2000;
1[Suppl.]:78.
 LA HETEROGENEIDAD MOLECULAR EN EL MIOCARDIO EN DESARROLLO Y SUS
IMPLICACIONES EN LA FISIOPATOLOGIA CARDIACA
LA HETEROGENEIDAD MOLECULAR EN EL MIOCARDIO EN DESARROLLO Y SUS
IMPLICACIONES EN LA FISIOPATOLOGIA CARDIACA
|

|
|
Diego
Franco
Columnista Experto de SIIC
Profesor Asociado en Biología Celular. Embriología
Molecular, Cardiogénesis, Expresión y Regulación génica.
Universidad de Jaén, Departamento de Biología
Experimental, Facultad de Ciencias Experimentales y de la
Salud
Institución:
Universidad de Jaén, Departamento de Biología
Experimental, Facultad de Ciencias Experimentales y de la
Salud, Jaén, España |
La formación del corazón es un proceso complejo en el cual
intervienen distintos tipos celulares (figura 1). En las primeras
fases de desarrollo embrionario, dos regiones simétricas conspicuas
del mesodermo se diferencian en tejido promiocárdico, expresando así
una serie de factores de transcripción que invariablemente las
convierten en miocardiocitos. Estas dos regiones promiocárdicas,
denominadas crestas cardíacas, se fusionan en la línea media del
embrión en desarrollo y dan lugar a un tubo cardíaco inicial,
compuesto de dos capas; una capa interna de endocardio rodeada por
una capa externa de miocardio. Entre estas dos capas se localiza una
sustancia amorfa y acelular a modo de lámina basal denominada
gelatina cardíaca.10
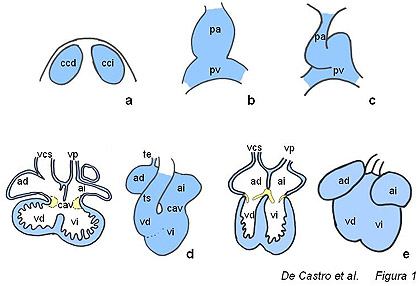
Figura 1. Esquema
ilustrativo de las diferentes etapas del desarrollo cardiaco. a,
crestas precardíacas; b, tubo cardíaco inicial; c,
asa cardíaca; d, corazón embrionario, en el cual se
observa el inicio del proceso de septación de las cámaras
atriales y ventriculares; e, corazón fetal, en el cual se
observa que el proceso de septación se ha completado y las válvulas
atrioventriculares se han desarrollado. ad, atrio derecho; ai,
atrio izquiedo; cav, canal atrioventricular; ccd,
cresta cardíaca derecha; cci, cresta cardíaca izquierda; pa,
polo arterial; pv, polo venoso; te, tracto de
entrada; td, tracto de salida; vcs, vena cava
superior; vp, vena pulmonar; vd, ventrículo
derecho; vi, ventrículo izquierdo.
Según se avanza en el desarrollo, el tubo cardiaco inicial se
delamina del mesodermo dorsal y sufre invariablemente una torsión
hacia la derecha. Es a partir de este estadio cuando las futuras
regiones ventriculares y atriales empiezan a vislumbrase a nivel
morfológico, y como veremos más adelante también a nivel
molecular. En este estadio embrionario se pueden distinguir cinco
regiones claramente delimitadas: el tracto de entrada, las cámaras
atriales, el canal atrioventricular, las cámaras ventriculares y el
tracto de salida. Es también en este estadio cuando se empieza a
observar los primeros signos de septación, dado que entre las cámaras
atriales y ventriculares ya se empiezan a esbozar los futuros septos
interatrial (septo interatrial primario) e interventricular (porción
muscular), respectivamente. Curiosamente, existe una continuidad
morfológica entre las regiones del tracto de entrada, canal
atrioventricular y tracto de salida a nivel de la curvatura interna,
lo cual ha llevado a plantear la hipótesis de que la especificación
molecular del miocardio atrial y ventricular acontece exclusivamente
en las regiones de la curvatura externa.3 Finalmente cabe
resaltar que una de las etapas decisivas durante la morfogénesis
cardíaca es la formación y alineamiento de los distintos septos
cardíacos, para generar así un órgano pulsátil con doble
circuito sanguíneo. De este modo, el corazón embrionario sufre una
tabicación del tracto de entrada, canal atrioventricular y tracto
de salida que permite obtener entradas y salidas independientes a
las cámaras atriales y ventriculares derecha e izquierda,
respectivamente. En este estadio se configura también a nivel
morfológico el sistema de conducción cardíaco, el cual permite
que se produzca la contracción sincrónica y acompasada de las
distintas cámaras cardíacas.9 En los últimos años
hemos experimentado un gran avance en el conocimiento de los
mecanismos moleculares que regulan la cardiogénesis. Hemos asistido
al descubrimiento de un número importante de factores de
transcripción específicos del miocardio, así como se ha
establecido la amplia heterogeneidad en proteínas estructurales que
subyace al miocardio en formación y que se mantiene en la mayoría
de los casos en el corazón adulto.5,6,8 En esta revisión,
queremos realizar un barrido por los distintos patrones de expresión
que se observan en el miocardio en desarrollo, así como en el
adulto, e ilustrar cuáles son las implicaciones que dicha
heterogeneidad provoca en la práctica clínica. Para ello es
importante resaltar cuáles son los mecanismos de especificación
celular que acontecen durante el desarrollo. Las células de
mesodermo en formación reciben señales de los tejidos contiguos en
forma de factores de crecimiento secretados que, mediante la
activación de receptores de membrana específicos, provocan directa
o indirectamente que unos factores de transcripción se transcriban
y por tanto sean activos. Estos factores de transcripción generan a
su vez respuestas en el núcleo que conllevan a la síntesis de
proteínas estructurales, tales como proteínas contráctiles, del
citoesqueleto o reguladoras del impulso eléctrico. Así pues, la
generación de distintos patrones de expresión de los factores de
transcripción, proteínas contráctiles/citoesqueleto y proteínas
reguladores del impulso eléctrico es indicativa, respectivamente,
de características morfogéneticas, estructurales y funcionales del
corazón en formación.
En los primeros estadios del desarrollo cardíaco, distintos
factores de transcripción tales como MEF2C, Nkx2.5 y GATA4, entre
otros, muestran un patrón de expresión homogéneo a lo largo del
tubo cardíaco inicial.8 Otros factores de transcripción
muestran sin embargo una regionalización en su expresión en los
distintos ejes embrionarios; Tbx5 muestran un gradiente ántero-
posterior,3 Hand2 (eHAND) muestra una expresión
diferencial en el eje dorso- ventral1 y Pitx2 se expresa
exclusivamente en la región izquierda del eje derecha- izquierda.2
Dentro de las proteínas estructurales, distintas proteínas sarcoméricas
muestran diferencias en el eje ántero-posterior pero no hay
evidencias de regionalización en el eje dorso-ventral. En el caso
del eje derecha-izquierda, existe una proteína de la matriz
extracelular, la flectina, que se expresa exclusivamente en la región
izquierda.14 Por el contrario, no existen evidencias de
expresión de ninguna de las proteínas involucradas en la generación
o conducción del impulso eléctrico en este estadio (figura 2A).
 
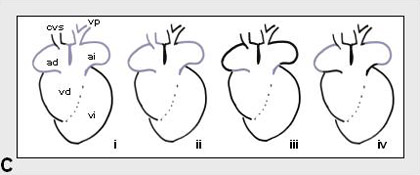
Figura 2.
Esquemas representativos de los diferentes patrones de expresión
en las distintas etapas del desarrollo cardiaco: A, etapa
de tubo cardíaco inicial; B, etapa embrionaria; y C,
etapa fetal/adulto. En la etapa de tubo cardíaco inicial (A)
existe una regionalización en los tres ejes embrionarios. En el
eje anteroposterior (A/P) muestran heterogeneidad en su
expresión factores de transcripción tales como Tbx5 y proteínas
sarcoméricas tales como αMHC y βMHC, así como proteínas
involucradas en el metabolismo del calcio, tales como SERCA2 a y
fosfolamban (PBL). En el eje derecha/izquierda (L/R)
muestran una expresión diferencial el factor de transcripción
Pitx2 y la proteína extracelular flectina. En el eje dorso-
ventral (D/V) sólo el factor de transcripción Hand2
muestra diferencias de expresión. En la etapa embrionaria (B)
existe una mayor heterogeneidad en la expresión. Hay genes que
muestran expresión sólo en las regiones de formación de
miocardio (i; p.ej. GATA5 y GATA6), genes que muestran
diferencias entre el miocardio primario y el miocardio de cámara
(ii; SERCA2a, PLB, Tbx2, BMP2, BMP4, por mencionar
algunos), genes que se expresan tan sólo en las cámaras atriales
o en las ventriculares (iii; p. ej. αMHC, βMHC,
MLC2a y MLC2v), genes que muestran expresión en el miocardio
derivado de la cresta cardíaca izquieda (iv; Pitx2) o
genes que parecen demarcar el futuro sistema de conducción
ventricular (v; Irx2, Irx3 y Tbx3). Finalmente, en la etapa
adulta, la heterogeneidad molecular parece restringirse al
miocardio auricular puesto que el miocardio ventricular muestra sólo
expresión en gradiente a lo largo de las paredes libres
ventriculares. En el miocardio auricular existe heterogeneidad
molecular entre el miocardio de las venas cavas (i), el
miocardio mediastinal (ii), el miocardio derivado del canal
atrioventricular embrionario (iii) y el miocardio de las
aurículas propiamente dicho (iv).
En el estadio embrionario, la mayoría de los
factores de transcripción muestran un patrón homogéneo, tales
como los anteriormente mencionados y otros, tales como GATA5 y
GATA6, solo se expresan en aquellas zonas donde se está produciendo
aún el reclutamiento de nuevas células miocárdicas.12
En este estadio existe un refinamiento de la diferenciación
dorso-ventral de tal modo que algunos factores de transcripción
delimitan las fronteras entre el miocardio primario y el miocardio
específico de cámara (atrial y ventricular), como es el caso de
Tbx2.10 A su vez aparecen las primeras diferencias de
expresión entre el miocardio sistémico y pulmonar, ilustrados por
Hand1 y Hand2.13 También aparecen los primeros signos de
diferenciación del sistema ventricular de conducción, con la
expresión de distintos factores de transcripción, Irx2, Irx3 y
Tbx3, en las presuntas áreas de formación del fascículo de His y
las ramas derecha e izquierda.4 Las diferencias en el eje
derecha-izquierda siguen estando representadas por Pitx2, resaltado
que dichas diferencias se mantiene como tales en las cámaras
atriales pero son convertidas en diferencias dorso-ventral en las cámaras
ventriculares.2 Los patrones de expresión de las proteínas
contráctiles refuerza la heterogeneidad molecular en el eje ántero-posterior
y en las regiones de miocardio primario/cámara (miosinas y
actinas), así como en los recién creados compartimientos sistémico/pulmonar
(miosinas).16 Dicha heterogeneidad en la expresión de
proteínas contráctiles también se extiende al sistema ventricular
de conducción cardiaca.
Las proteínas involucradas en la conducción cardíaca muestran
diferencias entre las regiones de miocardio primario/cámara
(conexinas),15 mientras que los distintos canales iónicos
muestran el mismo tipo de patrón o bien se expresan de forma homogénea
en el corazón embrionario (figura 2B).
En el estadio fetal, así como en el corazón adulto, las
diferencias de expresión de los distintos factores de transcripción
quedan refinadas al eje ántero-posterior, es decir, entre las cámaras
auriculares y ventriculares. Por otro lado, las diferencias de
expresión dorso-ventral y derecha-izquierda se desvanecen. En
definitiva, en los estadios adultos, sólo un número reducido de
factores de transcripción siguen expresándose de forma homogénea,
tales como Nkx2.5, MEF2C y GATA4, mientras sólo unos pocos se
expresan de forma heterogénea en el eje ántero-posterior, como por
ejemplo Irx4 y Tbx5. La expresión de proteínas contráctiles sigue
la misma tendencia que los factores de transcripción en lo que
respecta al miocardio ventricular pero sin embargo se diversifica
ampliamente en el miocardio auricular, dando lugar a la diferenciación
de al menos cuatro dominios de expresión. Por otro lado, la expresión
de canales iónicos es bien homogénea a lo largo del miocardio,
tales como los canales de sodio, o muestran diferencias en el eje ántero-posterior,
tales como las subunidades auxiliares de los canales de potasio IK,7
o bien presentan heterogeneidad entre el miocardio primitivo y el
específico de cámara, tales como las subunidades auxilares de los
canales citoplasmáticos de calcio o distintas bombas de calcio
mitocondriales (figura 2C).
En esencia, se puede observar que el miocardio en formación es un
tejido altamente dinámico que presenta alto grado de heterogeneidad
en su expresión génica. Este dato es importante tenerlo en cuenta
a la luz de la inminente aplicación de células pluripotentes
embrionarias para la reparación del miocardio dañado. En segundo
lugar, es importante destacar que dicha heterogeneidad se manifiesta
también en el corazón adulto, y de una forma muy especial en las cámaras
auriculares. Curiosamente, zonas discretas del miocardio auricular
son frecuentemente puntos de reentrada de fibrilación auricular.
Este perfil parece coincidir con la heterogeneidad molecular
observada en las aurículas. Seria por tanto interesante ver si
existe alteración de la expresión molecular en aquellos pacientes
con predisposición a reentradas arritmogénicas.
BIBLIOGRAFIA
-
Biben, C. and
Harvey, R. P. Homeodomain factor Nkx2-5 controls left/right
asymmetric expression of bHLH gene eHand during murine heart
development. Genes Dev. 1997 Jun 1; 11(11):1357-69.
-
Campione, M.; Ros,
M. A.; Icardo, J. M.; Piedra, E.; Christoffels, V. M.;
Schweickert, A.; Blum, M.; Franco, D., and Moorman, A. F. Pitx2
expression defines a left cardiac lineage of cells: evidence for
atrial and ventricular molecular isomerism in the iv/iv mice.
Dev Biol. 2001 Mar 1; 231(1):252-64.
-
Christoffels, V.
M.; Habets, P. E.; Franco, D.; Campione, M.; de Jong, F.;
Lamers, W. H.; Bao, Z. Z.; Palmer, S.; Biben, C.; Harvey, R. P.,
and Moorman, A. F. Chamber formation and morphogenesis in the
developing mammalian heart. Dev Biol. 2000 Jul 15;
223(2):266-78.
-
Christoffels, V.
M.; Keijser, A. G.; Houweling, A. C.; Clout, D. E., and Moorman,
A. F. Patterning the embryonic heart: identification of five
mouse Iroquois homeobox genes in the developing heart. Dev Biol.
2000 Aug 15; 224(2):263-74.
-
Fishman, M. C. and
Chien, K. R. Fashioning the vertebrate heart: earliest embryonic
decisions. Development. 1997 Jun; 124(11):2099-117.
-
Franco, D.;
Campione, M.; Kelly, R.; Zammit, P. S.; Buckingham, M.; Lamers,
W. H., and Moorman, A. F. Multiple transcriptional domains, with
distinct left and right components, in the atrial chambers of
the developing heart. Circ Res. 2000 Nov 24; 87(11):984-91.
-
Franco, D.;
Demolombe, S.; Kupershmidt, S.; Dumaine, R.; Dominguez, J. N.;
Roden, D.; Antzelevitch, C.; Escande, D., and Moorman, A. F.
Divergent expression of delayed rectifier K(+) channel subunits
during mouse heart development. Cardiovasc Res. 2001 Oct;
52(1):65-75.
-
Franco, D.;
Dominguez, J.; de Castro Md Mdel, P., and Aranega, A.
[Regulation of myocardial gene expression during heart
development]. Rev Esp Cardiol. 2002 Feb; 55(2):167-84.
-
Franco, D. and
Icardo, J. M. Molecular characterization of the ventricular
conduction system in the developing mouse heart: topographical
correlation in normal and congenitally malformed hearts.
Cardiovasc Res. 2001 Feb 1; 49(2):417-29.
-
Franco, D.;
Markman, M. M.; Wagenaar, G. T.; Ya, J.; Lamers, W. H., and
Moorman, A. F. Myosin light chain 2a and 2v identifies the
embryonic outflow tract myocardium in the developing rodent
heart. Anat Rec. 1999 Jan; 254(1):135-46.
-
Habets, P. E.;
Moorman, A. F.; Clout, D. E.; van Roon, M. A.; Lingbeek, M.; van
Lohuizen, M.; Campione, M., and Christoffels, V. M. Cooperative
action of Tbx2 and Nkx2.5 inhibits ANF expression in the
atrioventricular canal: implications for cardiac chamber
formation. Genes Dev. 2002 May 15; 16(10):1234-46.
-
Morrisey, E. E.;
Tang, Z.; Sigrist, K.; Lu, M. M.; Jiang, F.; Ip, H. S., and
Parmacek, M. S. GATA6 regulates HNF4 and is required for
differentiation of visceral endoderm in the mouse embryo. Genes
Dev. 1998 Nov 15; 12(22):3579-90.
-
Thomas, T.;
Yamagishi, H.; Overbeek, P. A.; Olson, E. N., and Srivastava, D.
The bHLH factors, dHAND and eHAND, specify pulmonary and
systemic cardiac ventricles independent of left-right sidedness.
Dev Biol. 1998 Apr 15; 196(2):228-36.
-
Tsuda, T.; Philp,
N.; Zile, M. H., and Linask, K. K. Left-right asymmetric
localization of flectin in the extracellular matrix during heart
looping. Dev Biol. 1996 Jan 10; 173(1):39-50.
-
Van Kempen, M. J.;
Vermeulen, J. L.; Moorman, A. F.; Gros, D.; Paul, D. L., and
Lamers, W. H. Developmental changes of connexin40 and connexin43
mRNA distribution patterns in the rat heart. Cardiovasc Res.
1996 Nov; 32(5):886-900.
-
Zammit, P. S.;
Kelly, R. G.; Franco, D.; Brown, N.; Moorman, A. F., and
Buckingham, M. E. Suppression of atrial myosin gene expression
occurs independently in the left and right ventricles of the
developing mouse heart. Dev Dyn. 2000 Jan; 217(1):75-85.
|



