Introdução
A síndrome da imunodeficiência adquirida (acquired immunodeficiency syndrome - AIDS) tornou-se epidêmica no mundo.1 Diversos sistemas do organismo podem ser acometidos pelo vírus da imunodeficiência humana (HIV) e as lesões de pele foram observadas desde as primeiras descrições da AIDS,2 como uma manifestação inicial da doença ou evidência de deterioração do sistema imunológico3 e ainda podem indicar fenômeno de reconstituição imunológica.4
Diversos autores têm demonstrado que as dermatoses têm elevada prevalência e incidência nos pacientes pediátricos com AIDS. Estas doenças apresentam-se com lesões atípicas, recorrentes e diretamente relacionadas com as categorias clínico-imunológicas graves3,5,6 e carga viral acima de 100 000 cópias/ml.6
Estes achados podem ser explicados pelas alterações imunológicas e nutricionais causadas pela AIDS, que são mais pronunciadas nos pacientes com doença avançada.7 Tais alterações imunológicas ocorrem mesmo nos estágios precoces da infecção pelo HIV. Dentre elas temos as mudanças no perfil Th1 para Th2 que tem sido descrito em pacientes com infecção por esse retrovírus. Estas modificações imunológicas podem ter um papel importante nas manifestações clínicas que ocorrem no curso da AIDS, podendo facilitar a ocorrência de manifestações alérgicas nos estágios iniciais da infecção pelo HIV em indivíduos geneticamente predispostos.8,9
O prurigo estrófulo é uma dermatose comum em crianças, causada por uma reação de hipersensibilidade a picadas de insetos. Vários mecanismos imunológicos parecem estar envolvidos na sua fisiopatologia. Hipersensibilidade tipo I, III e IV parece participar em diferentes fases de desenvolvimento da lesão e, portanto, pode depender de uma alteração imunológica tanto de mecanismos Th1 e Th2. Em crianças infectadas pelo HIV esta doença é mais prevalente, como foi observado em alguns estudos de séries de pacientes pediátricos,6,10 e parece ser mais freqüente no Brasil.11
Uma vez que ambas as doenças dependem de alterações do balanço imunológico, delineou-se este estudo com o objetivo de avaliar a freqüência do prurigo estrófulo em um grupo de crianças infectadas pelo HIV e sua distribuição conforme as categorias imunológicas e a carga viral.
Método
Estudo prospectivo, transversal, realizado no período de março 1998 a junho de 2004, no Hospital das Clínicas de Curitiba-PR, Brasil. O estudo obteve a aprovação do Comitê de Ética e Pesquisa em Seres Humanos e consentimento de todos os responsáveis pelos pacientes.
Todos os pacientes que neste período consultaram no Serviço de Infectologia Pediátrica com diagnóstico de infecção pelo HIV, baseados em critérios do Ministério da Saúde brasileiro,12 foram incluídos. Um protocolo especialmente delineado para a pesquisa foi preenchido com dados epidemiológicos como sexo, idade e forma de transmissão do HIV. Os pacientes foram avaliados pelo Serviço de Dermatologia Pediátrica para detecção de alterações dermatológicas. No momento de entrada no protocolo, um exame dermatológico completo foi realizado mesmo que não houvesse queixa de doença de pele. Todas as observações de prurigo estrófulo foram registradas. Nestes casos, o diagnóstico da dermatose foi determinado por critérios clínicos e epidemiológicos de prurigo estrófulo. E em caso de dúvida, foi realizado estudo histopatológico da lesão.
O número de linfócitos T CD4+ foi determinado pela técnica de imunofluorescência por citometria de fluxo e o número de cópias virais do HIV pela técnica de NASBA.
As crianças tiveram sua capacidade imunológica determinada pelo número de linfócitos T CD4+ no momento mais próximo do exame dermatológico, não mais de 2 meses antes ou depois, da entrada no protocolo. A partir destes dados, os pacientes foram estratificados segundo critérios de classificação imunológica preconizados pelo Centers for Diseases Control and Prevention,13 em 1) ausência de imunossupressão, 2) imunossupressão moderada e 3) imunossupressão grave.
O número de linfócitos T CD4+ e o logaritmo da carga viral foram correlacionados com o diagnóstico de prurigo estrófulo. Os dados foram expressos em média ± desvio padrão da média quando adequado e a análise foi realizada através do programa JMP 5.01®. Os testes de qui-quadrado e ‘t’ de Student foram aplicados para avaliar dados paramétricos ou dicotômicos, respectivamente. O teste de Kruskal-Wallis foi usado para dados não paramétricos. Em todos os testes estatísticos foi considerado como significante p < 0.05.
Resultados
Durante o estudo, 127 pacientes com idade inferior a 14 anos tiveram o diagnóstico de infecção pelo HIV. A média de idade foi de 3.8 anos variando de 3 meses até 13.9 anos. Quarenta pacientes (31%) tinham idade entre 3 e 24 meses, trinta e sete casos (29%) entre 25 e 48 meses, vinte e oito pacientes (22%) com 49 até 96 meses, vinte e um casos (16%) de 97 até 144 meses e dois pacientes (1%) com mais de 145 meses. Setenta pacientes (55%) eram do sexo feminino. A transmissão do HIV foi perinatal em 125 casos, por transfusão sanguínea em 1 e pelo leite da avó materna (mãe HIV negativa) em 1 caso. A distribuição dos atendimentos nas estações do ano foi de 25 (20%) casos no verão, 27 (21%) na primavera, 39 (31%) no outono e 36 (28%) no inverno.
Quanto aos valores de linfócitos T CD4+, cinqüenta e um pacientes (40%) foram classificados na categoria imunológica 1 (sem imunossupressão), quarenta e cinco (36%) na 2 (imunossupressão moderada) e trinta e um (24%) na categoria 3 (imunossupressão grave). O logaritmo da carga viral variou de indetectável até 7 com média de 4.6 ± 1.1 (n = 119).
O prurigo estrófulo foi observado num total de trinta e três pacientes (26% do total), dentre eles dezessete (51%) eram do sexo feminino. A média de idade dos pacientes com prurigo foi de 2.9 ± 1.9 anos e daqueles pacientes sem esta dermatose foi de 4.2 ± 2.9 anos (teste t de Student, p < 0.001; figura 1).

Figura 1. Análise da média de idade dos pacientes com prurigo estrófulo comparada com a média de idade dos pacientes sem esta dermatose.
Quando comparada à distribuição do total de atendimentos nas estações do ano com a distribuição dos atendimentos em que havia prurigo estrófulo houve diferença (χ2 = 31; p = 0.001). As avaliações com esta dermatose foram predominantemente diagnosticadas no verão com dezesseis pacientes (49%) registrados nesta estação. Outros dez casos (30%) na primavera, cinco (15%) no outono e dois casos (6%) no inverno (figura 2).

Figura 2. Distribuição da porcentagem de pacientes com e sem prurigo estrófulo conforme as estações do ano.
Quando comparada com a distribuição do total de pacientes nas categorias imunológicas houve predomínio dos casos de prurigo associados com as categorias sem imunodeficiência (χ2 = 10 e p < 0.006; figura 3). Dezessete casos (52%) foram classificados na categoria 1, quatorze pacientes (42%) na categoria imunológica 2 e apenas dois casos (6%) na categoria 3.

Figura 3. Distribuição da porcentagem de pacientes com e sem prurigo conforme as categorias imunológicas.
O valor médio dos níveis de linfócitos T CD4+ dos pacientes com prurigo estrófulo foi de 1 137/mm3 e daqueles sem esta dermatose foi de 821/mm3, com diferença significante (test t Student; p < 0.001; figura 4).
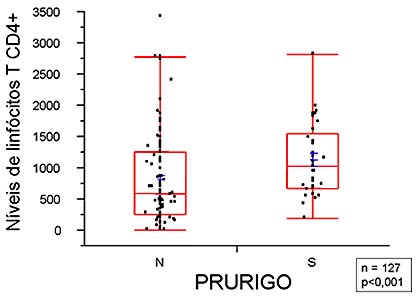
Figura 4. Comparação da distribuição dos níveis de linfócitos T CD4+ nos pacientes com e sem prurigo estrófulo.
O logaritimo da carga viral foi de 4.5 ± 1 nos pacientes com prurigo e 4.6 ± 1 naqueles sem prurigo. Não houve diferença significativa em relação à distribuição dos casos com e sem prurigo conforme o logaritmo da carga viral (Kruskal-Wallis p = 0.37).
Estudo histopatológico das lesões foi realizado em 4 pacientes, e evidenciou: epiderme com paraceratose, espongiose, acantose acentuada e queratinócitos preservados na camada basal; derme com papilomatose moderada, infiltrado inflamatório monomorfonuclear com predomínio de linfócitos e eosinófilos cuja quantidade variou de poucos até muitos. Todos os achados podem ser considerados compatíveis com o diagnóstico de prurigo estrófulo.
Discussão
Sabe-se que o prurigo estrófulo é uma dermatose comum na infância e sua imunofisiopatologia é explicada por reações de hipersensibilidade, desencadeada por picadas de insetos sugadores de sangue, como culicídeos do gênero Culex (mosquitos) e os sifonápteros (pulgas).14
O diagnóstico é baseado na presença de lesões papulares, edematosas, eritematosas, com distribuição linear, aos pares e muito pruriginosas. Esse último sintoma leva a modificação traumática e a conseqüente escoriação. As lesões evoluem de forma crônica ou recorrente, caracterizadas por profusão de lesões com facilidade de impetiginação e por deixar cicatrizes hipercrômicas.15
O prurigo estrófulo é mais freqüente nas regiões de clima quente e úmido, ou seja, em países tropicais e subtropicais, pois os ovos dos insetos necessitam de calor e umidade para transformar-se em larvas. Por esse mesmo motivo apresenta características sazonais com prevalência nos meses de verão e outono.16 No presente estudo, a maior prevalência do prurigo estrófulo ocorreu nos períodos mais quentes do ano mesmo em uma população HIV positivo com efeitos sobre o sistema imune. A sazonalidade da observação reforça a hipótese de que as lesões dos pacientes em questão tenham sido provocadas por picada de insetos, e isso tem importância quando se considera que o diagnóstico dessa dermatose é basicamente clínico.
A média de idade de 3 anos, verificada nas avaliações dos casos de prurigo estrófulo no presente estudo, é semelhante à descrita na literatura sobre crianças sem infecção pelo HIV nas quais a forma clássica dessa dermatose ocorre entre 2 e 5 anos de idade.17 Antes do primeiro ano de vida o prurigo é pouco observado, pois inúmeras picadas sucessivas são necessárias para que ocorra a sensibilização do sistema imune, e o paciente passe a apresentar lesão. Parte deste processo também se deve ao amadurecimento imunológico que ocorre progressivamente com o crescimento da criança.18,19 Na maioria dos casos, após os 8 anos, a doença cessa suas manifestações, pois as inúmeras picadas ao longo do tempo promovem a perda da resposta de hipersensibilidade.15
A literatura demonstra que, em crianças não infectadas pelo HIV, o prurigo estrófulo é doença freqüente e representa 13% das consultas dermatológicas.20 Neste estudo observamos uma incidência um pouco maior de prurigo estrófulo, no entanto existe a limitação de não avaliar um grupo controle. Entretanto, isso pode indicar a possibilidade da alteração imunológica desta população aumentar a prevalência de dermatoses por hipersensibilidade.21
Lim et al.3 e El Hachem et al.,22 em estudo longitudinal e transversal, respectivamente, sobre dermatoses nas crianças com infecção pelo HIV, não observaram casos dessa dermatose; no entanto Lèauté-Labréze et al.6 referem 12 casos em 35 pacientes na França, e Forsea et al.,10 na Romênia, citam 18% de prurigo em sua amostra. Essas discrepâncias podem ser explicadas pela sazonalidade desta dermatose e fatores genéticos e ou epidemiológicos da população estudada. Esses autores não avaliaram associação desta dermatose com as categorias imunológicas dos pacientes.
Rangel et al.,23 no Rio de Janeiro, avaliando crianças com infecção pelo HIV, consideraram o prurigo estrófulo a dermatose mais comum, com 30% de pacientes afetados. Em estudo longitudinal realizado no Serviço de Infectologia Pediátrica do Hospital de Clínicas de Curitiba em 40 crianças com infecção pelo HIV, o prurigo estrófulo afetou 52% dos pacientes e predominou na categoria imunológica 1.21
Apesar do pequeno número de estudos publicados, essas observações demonstram a elevada prevalência do prurigo estrófulo nas crianças com infecção pelo HIV, mais alta que na população não infectada, sobretudo em estudos realizados no Brasil. Esta observação pode indicar que exista predisposição genética do hospedeiro associada a um ambiente propício para a proliferação de artrópodes.
Os mecanismos imunológicos envolvidos na reação a picadas de inseto ainda não foram totalmente elucidados, mesmo em crianças sem infecção pelo HIV. Evidências apontam para uma reação de hipersensibilidade tipo I (mediada por IgE) em resposta aos antígenos presentes na saliva do inseto, que são depositados na pele no momento da picada.15 Entretanto, outros relatos demonstram de maneira inequívoca que há também a participação de resposta de hipersensibilidade mediada por células T.24,25 A reação tardia que ocorre 20 a 24 horas após a picada do inseto, e que consiste em pápula ou placa pruriginosa, é uma reação de hipersensibilidade do tipo IV, e por isso pode persistir por dias.15,24 Com relação à polarização dos linfócitos T, há aparente mudança de um perfil predominantemente Th2 para um perfil Th1 nas fases de evolução do prurigo estrófulo. Por conseguinte o prurigo estrófulo é doença diretamente dependente de mecanismos imunológicos. Não obstante, o paciente com infecção pelo HIV apresenta alterações imunológicas que parecem interferir no desenvolvimento da dermatose.
A infecção pelo HIV está associada não só a uma ativação da imunidade humoral (hipergamaglobulinemia), como também a alteração nas reações de hipersensibilidade mediada por células nas fases iniciais da AIDS. Sabe-se que há modificações no padrão de resposta Th1 para Th2.26,27
Um maior número de doenças alérgicas observado na infecção pelo HIV parece ser decorrente do aumento das citocinas do tipo 2 e do aumento da IgE.28 No entanto, uma resposta Th2 protetora não parece ser fenômeno que ocorra em todos os pacientes com infecção pelo HIV. Várias evidências indicam que alguns indivíduos infec�tados pelo vírus apresentam um tipo de resposta Th2 crônica e sustentada, que provavelmente ocorreria por suas características genéticas ou pelas condições do ambiente. Por exemplo, indivíduos que vivem em áreas infestadas por helmintos. Além do mais, por excessiva ativação do linfócito Th2, tais pacientes poderiam apresentar maior replicação do HIV, e assim, progredir mais rapidamente para a imunossupressão grave.29
A influência do padrão predominante Th2 na AIDS para evolução da doença é controverso na criança. Um fator protetor foi proposto pela observação de uma criança, com síndrome hiper-IgE e infecção pelo HIV, que apresentou padrão de evolução de progressor lento. Por isso não se pode considerar que todo paciente com IgE aumentada irá apresentar pior evolução quando infectado pelo HIV.30,31
Outro exemplo do provável papel protetor da IgE na infecção pelo HIV é descrito num estudo de 30 crianças com infecção pelo HIV, no qual 7 tinham IgE aumentada, com níveis baixos de CD4 em 71% dos casos, mas não apresentavam infecção oportunista nem falência de crescimento quando comparadas a outras crianças sem IgE aumentada.9
Como conseqüência dessas observações, é possível considerar que a alteração imune causada pelo HIV predisponha ao desenvolvimento de doenças alérgicas nos doentes com perfil genético para atopia nas fases iniciais da infecção. Essa predisposição tenderia a diminuir com a progressão da infecção, pois a capacidade imune de ativação seria necessária para a resposta a alérgenos e para o desenvolvimento de reações alérgicas, mas esta encontra-se reduzida nas fases de maior imunossupressão.28
Sabe-se que o tratamento antiretroviral induz na criança uma reposição celular por produção tímica.32 Essa reposição ocorre com clones virgens, o que, portanto explica a perda do perfil de memória.32,33 Entretanto, para alérgenos ambientais que são promotores das hipersensibilidades, a exposição antigênica é contínua.34 Assim, rapidamente os clones produzidos no timo são novamente ativados, e novos T de memória de ação estão presentes na circulação.
Portanto, pode-se considerar que a reconstituição imune se realiza em ordem inversa à da perda imunológica promovida pelo HIV, principalmente para antígenos ambientais e auto-antígenos, daí por que, durante a reconstituição, o paciente poderá voltar a apresentar dermatoses inflamatórias que estão associadas às fases iniciais da infecção pelo HIV e que não mais estavam ocorrendo por ausência de célula efetora nas fases finais de imunos�supressão.
Um indicador dessa inversão, promovida pela reconstituição imune, é a doença da restauração imune, que tem sido observada em adultos e crianças que apresentam melhora clínica e imunológica após uso de tratamento anti-retroviral efetivo. Quando se manifesta na pele, representa o retorno de uma dermatose que não se manifestava mais, talvez por falta de célula imune de ação, e que retorna quando os parâmetros imunológicos voltam a melhorar induzidos pelo tratamento. A resposta imune é tão exacerbada e sem mecanismos de regulação que causa a doença.35
Além das doenças infecciosas, as doenças mediadas por mecanismos de hipersen�sibilidade também podem ser manifestação de restauração imune, como a reativação de hipersensibilidade a picadas de insetos em adultos, semanas a meses após início do tratamento com zidovudina,36 o que provavelmente se deve ao aumento da função de células T, conseqüente ao tratamento anti-retroviral.37
Neste estudo houve associação de maior número de casos de prurigo estrófulo nos indivíduos cujo sistema imunológico ainda não se encontrava muito modificado. Esses dados estão de acordo com aqueles da literatura que apontam para a maior ocorrência de atopia nas fases iniciais da AIDS.28 Esse conjunto de fatos ocorre porque a imunidade celular é perdida inicialmente com o aumento concomitante da imunidade humoral, seguido de uma progres�siva perda de ambas as respostas no final da evolução da AIDS.
Nos adultos com infecção pelo HIV é descrita uma manifestação clínica que apresenta semelhanças com o prurigo. Trata-se da erupção papular pruriginosa ou pruritic papular eruption (PPE). Na fisiopatologia do PPE, uma hipótese é a reativação das manifestações de hipersensibilidade a picadas de insetos induzida pela alteração de imunorregulação das células T.38,39
A PPE ocorre principalmente em residentes em países tropicais e subtropi�cais, com incidência que pode variar de 12%40 a 50%.17,41 Sua maior prevalência, em determinadas regiões geográficas, pode estar relacionada a características genéticas do hospedeiro, ou ainda, aos antígenos dos artrópodes que podem ser mais indutores de reação em determinadas áreas geográficas.39 Alguns autores têm associado PPE com categorias de maior imunossupressão.42 No entanto, estudo de citocinas nos pacientes com PPE e infecção pelo HIV indica que essa dermatose tem maior possibilidade de manifestação nas fases precoces da infecção pelo HIV.43
A maioria dos autores que avaliou dermatoses em crianças não encontrou PPE.3,21,22 Poucos descrevem essa dermatose na faixa etária pediátrica,44 e quando investigado, a histologia do PPE nesta faixa etária foi sugestiva de prurigo estrófulo.45
De maneira geral, o médico não pensa em investigar a possibilidade de infecção pelo HIV perante uma manifestação de hipersensibilidade como o prurigo estrófulo. Esse paradoxo encontra explicação na alteração imune nas fases precoces da infecção pelo HIV, que causa diversas modificações imunes antes da imunossupressão. A elevada prevalência de prurigo estrófulo observada na população estudada indica que, em crianças que apresentem essa dermatose de maneira exuberante e recorrente, a possibilidade de infecção pelo HIV não deve ser descartada quando existir evidências epidemiológicas de transmissão deste retrovírus.
Conclusões
Os dados observados sugerem que as modificações imunológicas nas categorias imunológicas “sem imunossupresão” da AIDS na infância favorecem o desenvolvimento de hipersensibilidade à picada dos insetos. Entretanto, à medida que ocorre uma perda da resposta imunológica, ocorre uma diminuição progressiva do desenvolvimento de hipersensibilidades neste grupo. Assim, estudos neste pacientes podem favorecer o entendimento dos mecanismos imunofisiopatológicos da hipersensibilidade à picada de insetos.
BIBLIOGRAFÍA
1. Novelli VM. Assessing prognosis in infants infected with human immunodeficiency virus. J Pediatr 1996; 129(5):623-5.
2. Uthayakumar S, Nandwani R, Drinkwater T, Nayagam AT, Darley CR. The prevalence of skin disease in HIV infection and its relationship to the degree of immunosuppression. Br J Dermatol 1997; 137(4):595-8.
3. Lim W, Sadick N, Gupta A, Kaplan M, Pahwa S. Skin diseases in children with HIV infection and their association with degree of immunosuppression. Int J Dermatol 1990; 29(1):24-30.
4. King MD, Reznik DA, O'Daniels CM, Larsen NM, Osterholt D, Blumberg HM. Human papillomavirus-associated oral warts among human immunodeficiency virus-seropositive patients in the era of highly active antiretroviral therapy: an emerging infection. Clin Infect Dis 2002; 34(5):641-8.
5. El Hachem M, Bernardi S, Pianosi G, Krzysztofiak A, Livadiotti S, Gattinara GC. Mucocutaneous manifestations in children with HIV infection and AIDS. Pediatr Dermatol 1998; 15(6):429-34.
6. Lèauté-Labréze C, Niamba P, Douard D, Taïeb A. Cutaneous manifestations of paediatric HIV infection: a cohort study of 35 patients. Ann Dermatol Veneorol 1998; 125(S1P2):80.
7. Wiznia AA, Lambert G, Pavlakis S. Pediatric HIV infection. Med Clin North Am 1996; 80(6):1309-36.
8. Clerici M, Fusi ML, Ruzzante S, Piconi S, Biasin M, Arienti D, et al. Type 1 and type 2 cytokines in HIV infection - a possible role in apoptosis and disease progression. Ann Med 1997; 29(3):185-8.
9. Secord EA, Kleiner GI, Auci DL, Smith-Norowitz T, Chice S, Finkielstein A, et al. IgE against HIV proteins in clinically healthy children with HIV disease. J Allergy Clin Immunol 1996; 98(5 Pt 1):979-84.
10. Forsea D, Madarescu M, Strauss L, Petrea S, Tiplica S, Popescu C, Lacobescu R. Cutaneous manifestations in AIDS children. Ann Dermatol Veneorol 1998; 125(S1P3):80-1.
11. Orozco Y, Cafe E. Skin manifestations in children HIV positive update. Ann Dermatol Venereol 2002; 129(1S):813.
12. Ministério da Saúde. Brasil. Programa Nacional de DST e Aids. Guia de tratamento clinico da infecção pelo HIV em crianças. Secretaria de Vigilância em Saúde. 2004.
13. Centers for disease Control. Revised classification system for human immunodeficiency virus infection in children less Than 13 years of age. MMWR 1994; 43 (RR-12):1-19.
14. Martins ER, Ourici A, Chigros B. Prurigo estrófulo. Alerg Pediatr 1989; 3:5-8.
15. Stibich AS, Schartz RA. Papular urticaria. Cutis 2001; 68(2):89-91.
16. Maunder JW. In: Harper J, Orange A, Prose N. Text book of pediatric dermatology. 1 ed. United Kingdom: Blackwell Science; 2000.
17. Pradinaud R, Sainte-Marie D, Strobel M, Degarve B, Roul S. Le prurigo en milieu tropical. Importance de son association avec l'infection a VIH. Bull Soc Pathol Exot 1993; 86(5 Pt 2):512-6.
18. Protonotariou E, Malamitsi-Puchner A, Rizos D, Sarandakou A, Makrakis E, Salamolekis E. Alterations in Thl/Th2 cytokine concentrations in early neonatal life. J Matern Fetal Neonatal Med 2003; 14(6):407-10.
19. Rich RR, Fleisher TT, Shearer WT, Kotizn BL, Schroeder HW, Jr. Clinical immunology principles and practice 2nd ed. New York: C.V. Mosby; 2001.
20. Mahe A, Cisse I, Faye O, N'Diaye HT, Niamba P. Skin diseases in Bamako (Mali). Int J Dermatol 1998; 37(9):673-6.
21. Carvalho VO, Flenick LTM, Taniguchi K, Marinoni LP, Giraldi S, Bertogna J. Alterações dermatológicas em crianças com AIDS e sua relação com categorias clínico-imunológicas e carga viral. An Bras Dermatol 2003; 78(6):679-92.
22. El Hachem M, Tudor G, Matusa R, Pascu R, Borguese L, Cristini S, Castelli I, Gattinara G. Mucocutaneous infections in romanian HIV infected children: medical and surgical treatment of 400 cases. Ann Dermatol Veneorol 1998; 125(S1P4):81.
23. Rangel GV, Rubini NPM, Leal DWC, Cordovil AVDP, Arabe J, Capelo, AV. Manifestações mucocutâneas na AIDS pediátrica. Programa oficial do VII Congresso Brasileiro de Alergia e Imunologia em Pediatria; 1999; Brasília, Brasil; 1999. p. 123.
24. Garcia E, Halpert E, Rodriguez A, Andrade R, Fiorentino S, Garcia C. Immune and histopathologic examination of flea bite-induced papular urticaria. Ann Allergy Asthma Immunol 2004; 92(4):446-52.
25. Shibasaki M, Sumazaki R, Takita H. Hypersensitive reactions to mosquito bites in congenital agammaglobulinemia. Ann Allergy 1986; 56(1):81-4.
26. Clerici M, Shearer GM. The Th1-Th2 hypothesis of HIV infection: new insights. Immunol Today 1994; 15(12):575-81.
27. Becker Y. The changes in the T helper 1 (Th1) and T helper 2 (Th2) cytokine balance during HIV-1 infection are indicative of an allergic response to viral proteins that may be reversed by Th2 cytokine inhibitors and immune response modifiers-a review and hypothesis. Virus Genes 2004; 28(1):5-18.
28. Corominas M, García JF, Mestre M, Fernández Viladrich P, Buendía E. Predictors of atopy in HIV-infected patients. Ann Allergy Asthma Immunol 2000; 84(6):607-11.
29. Romagnani S, Maggi E. Th1 versus Th2 responses in AIDS. Curr Opin Immunol 1994; 6(4):616-22.
30. Lyamuya EF, Matee MI, Kasubi M, Scheutz F. Immunoglobulin profile in HIV-1 infected children in Dar es Salaam. East Afr Med J 1999; 76(7):370-5.
31. Seroogy CM, Wara DW, Bluth MH, Dorenbaum A, White C, Durkin HG, et al. Cytokine profile of a long-term pediatric HIV survivor with hyper-IgE syndrome and a normal CD4 T-cell count. J Allergy Clin Immunol 1999; 104(5):1045-51.
32. Douek DC, Koup RA, McFarland RD, Sullivan JL, Luzuriaga K. Effect of HIV on thymic function before and after antiretroviral therapy in children. J Infect Dis 2000; 181(4):1479-82.
33. Feeney ME, Draenert R, Roosevelt KA, Pelton SI, McIntosh K, Burchett SK, et al. Reconstitution of virus-specific CD4 proliferative responses in pediatric HIV-1 infection. J Immunol 2003; 171(12):6968-75.
34. Roberts G, Peckitt C, Northstone K, Strachan D, Lack G, Henderson J, et al. Relationship between aeroallergen and food allergen sensitization in childhood. Clin Exp Allergy 2005; 35(7):933-40.
35. Tangsinmankong N, Kamchaisatian W, Lujan-Zilbermann J, Brown CL, Sleasman JW, Emmanuel PJ. Varicella zoster as a manifestation of immune restoration disease in HIV-infected children. J Allergy Clin Immunol 2004; 113(4):742-6.
36. Diven DG, Newton RC, Ramsey KM. Heightened cutaneous reactions to mosquito bites in patients with acquired immunodeficiency syndrome receiving zidovudine. Arch Intern Med 1988; 148(10):2296.
37. Sempowski GD, Hicks CB, Eron JJ, Bartlett JA, Hale LP, Ferrari G, et al. Naive T cells are maintained in the periphery during the first 3 months of acute HIV-1 infection: Implications for analysis of thymus function. J Clin Immunol 2005; 25(5):462-72.
38. Sundharam JA. Pruritic skin eruption in the acquired immunodeficiency syndrome: arthropod bites? Arch Dermatol 1990; 126(4):539.
39. Resneck JS, Jr., Van Beek M, Furmanski L, Oyugi J, LeBoit PE, Katabira E, et al. Etiology of pruritic papular eruption with HIV infection in Uganda. JAMA 2004; 292(21):2614-21.
40. Rosatelli JB, Machado AA, Roselino AM. Dermatoses among Brazilian HIV-positive patients: correlation with the evolutionary phases of AIDS. Int J Dermatol 1997; 36(10):729-34.
41. Liautaud B, Pape JW, DeHovitz JA, Thomas F, LaRoche AC, Verdier RI, et al. Pruritic skin lesions. A common initial presentation of acquired immunodeficiency syndrome. Arch Dermatol 1989; 125(5):629-32.
42. Muhammad B, Eligius L, Mugusi F, Aris E, Chale S, Magao P, et al. The prevalence and pattern of skin diseases in relation to CD4 counts among HIV-infected police officers in Dar es Salaam. Trop Doct 2003; 33(1):44-8.
43. Aires JM, Rosatelli JB, de Castro Figueiredo JF, Roselino AM. Cytokines in the pruritic papular eruption of HIV. Int J Dermatol 2000; 39(12):903-6.
44. Wananukul S, Thisyakorn U. Mucocutaneous manifestations of HIV infection in 91 children born to HIV-seropositive women. Pediatr Dermatol 1999; 16(5):359-63.
45. Wananukul S, Deekajorndech T, Panchareon C, Thisyakorn U. Mucocutaneous findings in pediatric AIDS related to degree of immunosuppression. Pediatr Dermatol 2003; 20(4):289-94.
|


![]()

