Introducción
La aciduria orgánica (AO) es causada por un defecto en el catabolismo de los
aminoácidos, principalmente metionina, treonina, valina, isoleucina (MTVI) y de
ácido grasos de cadena impar, las más frecuentes son la acidemia propiónica (AP) y
la acidemia metilmalónica (AMM).
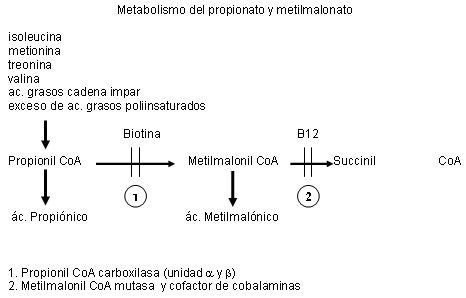
La AP se produce por deficiencia de la enzima propionil CoA carboxilasa (PCC)
(figura 1), compuesta por dos subunidades α y β, codificadas en los
genes PCCA y PCCB, respectivamente, y ambas son dependientes de la biotina. El
gen de la subunidad α está localizado en el brazo largo del cromosoma 13 y
el de la subunidad β en el brazo largo del cromosoma 3. Cualquier alteración
en los genes PCCA o PCCB produce AP. Se estima una incidencia de 1:100 000
recién nacidos.1 La AMM se debe al déficit o ausencia de la enzima
metilmalonil CoA mutasa [formas mut(º) y mut(-)] o
a defectos de las cobalaminas (cblA y cblB) o vitamina B12 (figura
1). Se demostró que la presencia de vitamina B12 en las formas
mut(-), cblA y cblB aumenta la actividad de la enzima y mejora su
pronóstico.2 El gen que codifica la enzima se ubica en el locus 6p21.
La incidencia de la AMM es de 1:50 000 recién nacidos en la población de raza
blanca.3
La sintomatología clínica de la AO puede manifestarse en el período neonatal o ser
de presentación tardía. Los síntomas son rechazo de la alimentación, vómitos,
deshidratación, compromiso de conciencia progresivo hasta el coma, hipotonía,
convulsiones, hipoglucemia, cetoacidosis con aumento del desequilibrio aniónico,
hiperamonemia, hiperglicinemia, hiperlactatemia, trombopenia, leucopenia y,
ocasionalmente, anemia. La presencia de pancitopenia puede llevar a confundir el
cuadro con sepsis.4 Si estas patologías no son diagnosticadas
tempranamente y tratadas en forma adecuada durante los cuadros agudos se
pueden producir graves secuelas neurológicas e incluso la
muerte.5,6
El tratamiento consiste en restringir la ingesta de los aminoácidos MTVI, evitar el
catabolismo proteico endógeno y la lipólisis. Durante la crisis aguda se recomienda
realizar hemofiltración o diálisis peritoneal, suspender las proteínas naturales e
iniciar el manejo nutricional de emergencia por vía parenteral, con aporte de
calorías, biotina, vitamina B12 y L-carnitina por vía oral.7-
9
El Instituto de Nutrición y Tecnología de los Alimentos (INTA) de la Universidad de
Chile, centro de referencia nacional para el diagnóstico de estas enfermedades, tiene
un programa de seguimiento compuesto por médicos, nutricionistas, bioquímico,
neurólogo, psicólogo y asistente social encargados de realizar evaluaciones
periódicas, orientadas a cubrir todos los aspectos vulnerables del niño y lograr
crecimiento y desarrollo normales.
El objetivo del presente estudio es actualizar los resultados obtenidos del
seguimiento médico, nutricional, bioquímico y psicológico de los niños con AP y AMM
tratados en el policlínico de enfermedades metabólicas del INTA de la Universidad de
Chile.
Pacientes y métodos
La muestra está conformada por 29 niños con AP y AMM diagnosticados desde
1980 a la fecha por el Laboratorio de Enfermedades Metabólicas del INTA.
Durante la primera crisis se midieron en sangre gases venosos, electrolitos
plasmáticos, amonio y acilcarnitina. El diagnóstico se estableció a través del análisis
de ácidos orgánicos en orina por cromatografía de gas con espectrometría de masa.
La presencia de los ácidos orgánicos 3-hidroxipropiónico, 3-hidroxibutírico y
metilcitrato confirmó AP y el hallazgo de los ácidos metilmalónico y metilcítrico hizo
lo propio con AMM.
Protocolo de tratamiento
Durante la etapa aguda se suspendió el aporte de proteínas, se proporcionó
glucosa (10 mg/kg/minuto) y lípidos intravenosos al 20% (2 g/kg/día), se corrigió
el equilibrio hidroelectrolítico y ácido-base. Cuando los valores de amonemia
superaron los 600 μg/dl se efectuó diálisis peritoneal. Se suplementó en forma
paralela por vía oral con 200 mg/kg/día de L-carnitina; la AP con 10 mg biotina/día
y la AMM con 20 mg de vitamina B12/día.
El período de seguimiento crónico incluyó evaluaciones médicas, nutricionales y
bioquímicas mensuales. La evaluación nutricional consistió en establecer los
requerimientos individuales de macronutrientes y micronutrientes y de los
aminoácidos MTVI, de acuerdo con las recomendaciones de la Recommended
Dietary Allowance (RDA), 2001.7 La dieta restringida en los
aminoácidos MTVI, es hipercalórica (100-120 cal/kg/día), hipoproteica (1.0-1.5
g/kg/día de origen natural), es necesaria la suplementación con una fórmula
especial sin MTVI para completar los requerimientos proteicos. Se mantuvo la
suplementación de biotina o vitamina B12 y de L-carnitina 100
mg/kg/día.10
Se compararon las medidas antropométricas: peso, talla, circunferencia craneana
con los patrones estándar del National Center for Health Statistic
(NCHS).11
Una vez al mes y durante los primeros 6 meses de tratamiento se evaluaron los
niveles de amonio, se cuantificaron los aminoácidos con un analizador de
aminoácidos (Biotronik 2000). Posteriormente, cada mes, se controló el perfil de
acilcarnitinas y aminoácidos, por espectrometría de masa en tándem (Perkin
Elmer).
Semestralmente se realiza una evaluación psicométrica. En niños menores de 36
meses se utiliza la prueba de Bayley y en los mayores la prueba de Wechsler y
Stanford Binet.
Como estudio adicional, en 3 casos con AMM fue posible medir la actividad de la
enzima metilmalonil CoA mutasa in vitro en cultivo de fibroblastos, para
evaluar la respuesta a megadosis de vitamina B12. En 8 casos con
AP se determinó la actividad de la enzima propionil CoA carboxilasa en cultivo de
fibroblastos y se realizó además el estudio molecular para identificar las mutaciones
en el gen PCCB. Los análisis enzimáticos y moleculares fueron realizados en el
Centro de Estudios Moleculares de la Universidad Autónoma de Madrid,
España.
Este estudio es del tipo descriptivo, retrospectivo y transversal. Para el análisis
estadístico se utilizó el programa de computación Excel 2000 para Windows y se
calculó el promedio de los datos ± 1 desviación estándar.
Resultados
La muestra está compuesta por 29 niños, de los cuales 17 son de sexo
masculino y 12 de sexo femenino. Del total, 21 pacientes presentan AP y 8 AMM.
En 13 de ellos los síntomas clínicos se presentaron durante el período neonatal (10
AP y 3 AMM) y en los otros 16 pacientes la sintomatología clínica apareció después
del quinto mes de vida (11 AP y 5 AMM).
Las AO de presentación neonatal se diagnosticaron en promedio a los 6.6 ±
6.9 días de edad (intervalo de 2 a 19 días) y los de manifestación tardía a los 13
± 15 meses de edad (intervalo de 2.4 meses a 10 años). Nueve de los 13
pacientes con la forma neonatal requirieron diálisis peritoneal, correspondiendo a 7
AP y a 2 AMM.
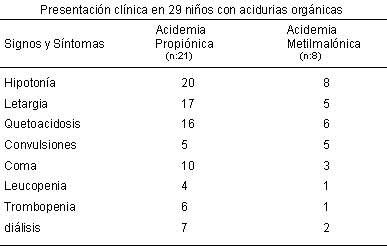
Al momento del diagnóstico, la cetoacidosis estuvo presente en 22 de los 29 niños,
11 de ellos de presentación neonatal (tabla 1). Entre los signos bioquímicos destaca
el elevado nivel de amonio encontrado en las AO de presentación neonatal, en las
AP fue de 1 137 ± 882 μg/dl y en las AMM de 1 500 ± 801.9
μg/dl. En las formas tardías el nivel de amonio fue de 151.3 ± 109
μg/dl para ambas patologías, considerándose valores normales entre 20 y 80
μg/dl. A la fecha, 7 casos de presentación neonatal y 4 con la forma tardía
fallecieron (37.9%), de los cuales 9 eran AP y 2 AMM. Tres de ellos fallecieron
durante un episodio de descompensación grave, realizándose el diagnóstico
post mortem; 6 pacientes con AO neonatal, que se encontraban en
seguimiento, fallecieron producto de infección grave, y 2 niños fallecieron por
descompensaciones repetidas causadas por desnutrición secundaria a tratamiento
inadecuado.
Actualmente 18 niños con AO (12 AP y 6 AMM) se encuentran en seguimiento, con
un promedio de 5.8 ± 3.0 años en los de presentación neonatal y de 8.4
± 4.3 años en la forma tardía.
Tanto en las AP como en las AMM de presentación neonatal la ingesta de proteínas
de origen natural (leche maternizada, cereales, frutas y verduras) fue de 1.2
± 0.6 gr/kg/día y la de proteínas artificiales fue de 0.7 ± 0.1 g/kg/día
(fórmula sin MTVI). En el grupo de AP y AMM de presentación tardía, la ingesta de
proteínas naturales fue de 1.3 ± 0.2 g/kg/día y no fue necesario entregar
fórmula especial sin MTVI para completar los requerimientos de proteínas (tabla 2).
El nivel de valina sérica fue de 65.1 ± 34 μM/l en promedio en los de
presentación neonatal y de 90.5 ± 4.0 μM/l en los tardíos, el valor
recomendado es de 95 a 300 μM/l. Tanto la AP como la AMM presentaron en
promedio niveles de isoleucina inferiores a 35 μM/l (valores recomendados 35 a
105 μM/l). En ambas situaciones de déficit los pacientes fueron suplementados
farmacológicamente, de acuerdo con las necesidades individuales.

Los niños con AO presentación neonatal mantuvieron el nivel de propionilcarnitina
de 42.8 ± 25 μM/l y los de presentación tardía de 37.3 μ 21.7
μM/l (valor recomendado en seguimiento < 40 μM/l). La carnitina libre fue
de 49.4 ± 6.5 μM/l y de 53.3 ± 3.5 μM/l (valor recomendado >
30 μM/l ) en las formas neonatal y tardía, respectivamente (tabla 3).

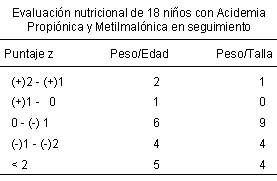
En cuanto al estado nutricional según el índice de masa corporal (IMC), el 22.2% de
los pacientes está bajo de peso, el 50% es normal, el 22.2% de ellos tienen
sobrepeso y un caso con AP está obeso (tablas 4 y 5). Debido al incremento
deficitario de peso y estatura, 7 pacientes de presentación neonatal y 3 de
presentación tardía fueron sometidos a gastrostomía.

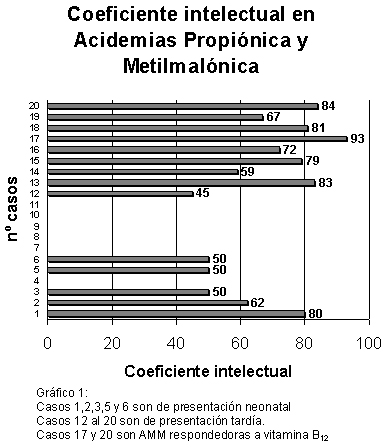
El coeficiente intelectual en niños con AO de presentación neonatal fue de 58.4
± 13 y en la forma tardía de 73.6 ± 14 (gráfico 1).
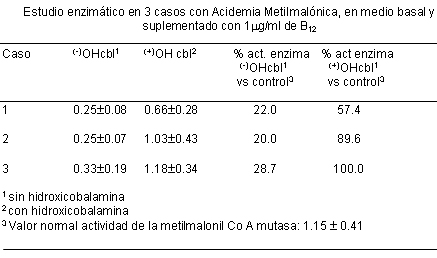
De los 6 niños con AMM, uno desarrolló insuficiencia renal crónica y requirió diálisis
peritoneal. En 3 casos se estudió la actividad de la enzima in vitro; dos
pacientes normalizaron la actividad de la enzima in vitro en presencia de
hidroxicobalamina (tabla 6).
La actividad enzimática en las 8 AP fluctuó entre 8.1 y 38.6 pmol/minuto/mg de
proteína, se considera normal 1 479 pmol/minuto/mg de proteína (tabla 7).

El estudio molecular se realizó sólo en 7 de los 21 niños con AP, tipificándose en 5
de ellos la mutación ins/del (1218del/14ins12): 3 en homocigosis y 2 en
heterocigosis compuesta (una en combinación con la mutación E168K, y el otro con
la mutación 1298-1299-insA). Los otros 2 niños presentan la mutación E168K, uno
en homocigosis y el otro en heterocigosis compuesta con la mutación c1170insT
(1173-1174insT) (tabla 7). Cuatro pacientes con AP fueron homocigotos para la
misma mutación, comprobándose el antecedente de consanguinidad entre los
progenitores.
Discusión
Diversos autores señalan que el diagnóstico precoz, el uso de la L-carnitina y
las fórmulas lácteas sin MTVI mejoraron la calidad de vida de los pacientes con AO,
especialmente en la forma neonatal.10,12-14 Al analizar la dieta en
nuestra casuística, se observa que los pacientes con AP y AMM de presentación
neonatal toleran la ingesta de proteínas naturales en promedio de 1.2 ± 0.6
g/kg/día y de 0.7 ± 0.1 g/kg/día de proteínas artificiales. Los pacientes de
presentación tardía cubren sus requerimientos de proteínas sólo con proteínas
naturales y con ello mantienen niveles de propionilcarnitina en 37.3 ± 21.7
μM/ y de carnitina libre en 53.3 ± 3.5 μM/l, ambos parámetros se
consideran un buen control metabólico. Es importante señalar que los niños de
presentación neonatal también tuvieron niveles de propionilcarnitina de 42.8
± 25 μM/l, nivel considerado superior a lo recomendado, y carnitina libre
de 49.4 ± 6.5 μM/l, aceptado durante el seguimiento. Este resultado se
tradujo en un menor aporte de proteínas naturales, que hizo necesaria la
prescripción de fórmula láctea especial sin MTVI para proporcionar los
requerimientos adecuados de proteínas para promover anabolismo; junto con ello,
disminuir las posibilidades de descompensación por aumento del nivel de
propionilcarnitina.10,15,16
Se ha descrito que niveles de isoleucina inferiores a 20 μM/l pueden producir
pérdida de peso, decoloración de la mucosa bucal, desequilibrio entre los
aminoácidos esenciales y no esenciales, disminución del colesterol plasmático y,
que si esta deficiencia se mantiene en el tiempo, afectará el crecimiento ponderal
del niño.17 Todos los pacientes del estudio tuvieron ingesta de
isoleucina dentro de lo recomendado por la RDA, sin embargo, el nivel plasmático
en promedio fue de 26.7 μM/l, siendo necesaria la suplementación
farmacológica en 12 casos (4 neonatales y 8 tardíos). Ninguno de estos niños
manifestó signos clínicos de deficiencia de isoleucina.
Los niños con AO, especialmente aquellos con la forma neonatal, evolucionan
frecuentemente con mal incremento ponderal por anorexia. En ellos, el uso de
gastrostomía previene el deterioro del estado nutricional y disminuye la frecuencia
de las descompensaciones.15 En este estudio, 10 niños requirieron
gastrostomía porque presentaron descenso en el canal de crecimiento durante el
primer año de seguimiento. En la actualidad, 7 de los 10 casos con gastrostomía se
mantienen en seguimiento y tienen un IMC entre el percentil 10 y 95, que se
considera un estado nutricional normal de acuerdo con el peso para la talla. Tres de
estos niños con gastrostomía de presentación neonatal y estado nutricional normal,
fallecieron por descompensación aguda durante el seguimiento. Esto nos permite
señalar la importancia que tiene detectar y tratar precozmente los cuadros
infecciosos agudos, para aplicar rápidamente la terapia intensiva, la hemodiálisis o
la diálisis peritoneal son la mejor alternativa para lograr restablecer el equilibrio
metabólico.
Con relación al coeficiente intelectual (CI), se determinó que los niños de
presentación neonatal tienen un CI más bajo que los de presentación tardía (58.4
± 13 y 73.6 ± 15, respectivamente). Esta diferencia se podría
relacionar con la presencia de hiperamonemia en el período neonatal, momento en
el cual el sistema nervioso central está en rápido crecimiento y desarrollo, y es más
susceptible al efecto deletéreo de las noxas. En este estudio los niños de
presentación neonatal fueron diagnosticados en promedio a los 6.6 días de vida y
tuvieron niveles de amonio de mayores que 1 137 μg/dl, a diferencia de los de
presentación tardía, quienes fueron diagnosticados en promedio a los 13 meses de
edad y tuvieron niveles de amonio de 151.3 μg/dl.
Las diferentes formas de presentación de la AMM tienen la misma sintomatología
clínica y bioquímica, pero existen diferencias entre ellas frente a una sobrecarga de
vitamina B12. El 90% los pacientes con la forma cblA y un menor
porcentaje con las formas mut(-) y cblB responden efectivamente a
megadosis de B12, al aumentar la actividad de la enzima se
favorece su pronóstico.14,18,19 De las tres AMM estudiadas, 2 de
ellos normalizaron in vitro la actividad enzimática en presencia de
hidroxicobalamina. Este hallazgo concuerda con la clínica, ya que al aumentar la
dosis oral de B12, de 1.0 mg/día a 20 mg/día, disminuyó la
excreción de ácido metilmalónico en orina de 3 094 y 1 763 mg/mg de creatinina a
220 y 695 mg/mg/creatinina, respectivamente.
En este estudio 8 pacientes con AP tuvieron actividad enzimática inferior al 3% con
respecto a lo normal y no se detectaron diferencias porcentuales de actividad entre
las formas neonatal y tardía (véase tabla 7). Esta observación sugiere que la
heterogeneidad clínica entre las AP de presentación neonatal y de presentación
tardía no sería explicable a través de la actividad enzimática
residual.20,21 Con el objetivo de interpretar las diferencias
fenotípicas se buscaron las mutaciones que producen AP, a la fecha se describieron
más de 60 mutaciones.22-24 Las mutaciones más frecuentes en la
población española son: ins/del (31%) y la mutación c1170insT
(16.7%).25 En nuestra serie estas mutaciones se presentaron con
una frecuencia de 47% y 6.2%, respectivamente. La mutación E168K tiene una
frecuencia de 25%.
Al correlacionar el genotipo con el fenotipo, se demostró que los niños homocigotos
para las mutaciones ins/del y c1170insT o heterocigotos compuestos con la
mutación 1298-1299insA, tienen ausencia total de actividad de la enzima propionil
CoA carboxilasa.25 En nuestro estudio, de las 7 AP estudiadas, los 3
pacientes que poseen la mutación ins/del en homocigosis debutaron con una AO de
presentación neonatal, al igual que el niño con la mutación ins/del en combinación
con la mutación 1298-1299insA, resultados concordantes con lo descrito en la
literatura.24 La actividad enzimática para estas mutaciones fue
mayor a lo descrito (1.2% y 2.4% con respecto a valores normales), por lo que se
deducie que el estudio enzimático por sí solo no permite predecir el pronóstico de la
enfermedad, es necesario el estudio molecular.
Se puede concluir que el pronóstico en las AO de presentación neonatal y tardía se
asocia estrechamente con la edad al diagnóstico, a la precocidad en la detección de
cuadros infecciosos durante el seguimiento y a la terapia intensiva aplicada durante
estas descompensaciones metabólicas.
Los autores no manifiestan conflictos.
BIBLIOGRAFÍA
-
Fenton, W, Gravel R, Rosenberg, L. Disorders of propionate and
methylmalonate metabolism. En The metabolic and molecular bases of inherited
disease, 8th capítulo 94, parte 9, tomo II, eds. Scriver C, Beaudet A,
Sly W, Valle D. Ed. Mc Graw-Hill, Nueva York, 2001, 2165 -2194.
-
Baulny O, Saudubray J. Branched-chain organic acidurias. En Inborn metabolic
disease. Diagnosis and treatment, IV Disorders of amino acids metabolism and
transport, capítulo 16. Eds. Fernandes J, Saudubray JM, Van Den Berghe G. Ed.
Springer-Verlag Berlin Heidelberg, New York, 2000, 195-212.
-
Rosemblatt DS, Ledley FD. A molecular study of methylmalonic aciduria:
structure - function correlations. Bull Acad Natl Med 1996;180:1553 - 1563.
-
Sanjurjo P. Acidemias metil-malónica y propiónica. En Diagnóstico y tratamiento
de las enfermedades metabólicas hereditarias, capítulo 23. Eds Sanjurjo P, Baldellou
A. Ed. Ergon S.A, 2001,248-255.
-
Baumgartner R, Leopold D. Propionic (PA) and methylmalonic (MMA)
acidemias. En: 25th conference of the European metabolic group, Milupa, european
metabolic group. 1992;4.
-
Baulny O, Wendel U, Saudubray J. Branched-chain organic acidurias. En:
Fernández J, Saudubray JM, Van Den Berghe G, eds. Inborn metabolic disease.
Diagnosis and treatment. Part VI Organic Acids. New York. Editorial: Springer-Verlag,
1995; 206-221.
-
Acosta P. Propionic or methylmalonic acidemia. Protocols 13. En Nutrition
Support Protocols. Eds Acosta P, Yannicelli S. Ed. Abbott Laboratories, USA, 2001,
230-261.
-
Roe CH, Millington D, Maltby D y col. L-Carnitine enhances excretion of propionyl
coenzyme. A as propionylcarnitine in propionic acidemia. J Clin Invest 1984; 73:
1785-1788.
-
Walter JH, Leonard JV, Thompsom GN y col. Parenteral nutrition in propionic
acidemia and methylmalonic acidemia. J Pediatr, 1990;117:338-339.
-
Yannicelli S, Acosta PB, Velásquez A y col. Improved growth and nutrition status
in children with methylmalonic or propionic acidemia fed an elemental medical food.
Mol Genet Metab, 2003;80:181-188.
-
Barrera G. Estándares antropométricos para evaluación del estado nutritivo.
Instituto de Nutrición y Tecnología de los Alimentos, Universidad de Chile, 2004.
-
Feillet F, Bodamer O, Dixon M, Sequeira S, Leonard J. Resting energy
expenditure in disorders of propionate metabolism. J Pediatr, 2000, 136,659-663.
-
Walter J, Leonard J, Thompson G, Halliday D. Parenteral nutrition in propionic
acidemia and methylmalonic acidemia. J Pediatr, 1990, 117(2), 338-339.
-
Van der Meer SB, Poggi F, Spada M, y col. Clinical outcome of long-term
management of patients with vitamin B12-unresponsive methylmalonic acidemia. J
Pediatr 1994; 125:903- 908.
-
Cornejo V, Raimann E. Errores innatos del metabolismo de los aminoácidos. En
Colombo M, Cornejo V, Raimann E., eds. Errores innatos en el metabolismo del
niño, capítulo 3. Editorial Universitaria, Chile, 2003; 71-125.
-
Baumgarten E, Viardot C. Long-term follow-up of 77 patients with isolated
methylmalonic acidaemia. J Inher Metab Dis 1995; 18: 138-142.
-
Thomas E. Dietary management of inborn errors of aminoacid metabolism with
protein-modified diets. J Child Neurol 1992;7:S92-111.
-
Ninan TK, Thom H, Rusell G. Oral vitamin B12 treatment of cobalamin-
responsive methylmalonic aciduria. J Inher Metab Dis 1992; 15: 939-940.
-
Matsui SM, Mahoney MJ, Rosemberg LE. The natural history of the inherited
methylmalonic acidemias. N Engl J Med, 1983;14:85-861.
-
Chloupkova M, Ravn K, Schwartz M y col. Changes in the carboxyl terminus of
the beta subunit of human propionyl-CoA carboxylase affect the oligomer assembly
and catalysis: expression and characterization of seven patient-derived mutant forms
of PCC in Escherichia coli. Mol Genet Metab 2000;71:623-632.
-
Ravn K, Chloupkova M, Christensen E y col. High incidence of propionic acidemia
in Greenland is due to a prevalent mutation, 1540insCCC, in the gene for the β-
subunit of propionyl CoA carboxylase. Am J Hum Genet 2000;67:203-206.
-
Richards E, Desviat LR, Perez B y col. Three novel splice mutations in the PCCA
gene causing identical exon skipping in propionic acidemia patients. Hum Genet
1997;101:93-96.
-
Muro S, Pérez B, Desviat LR, Y col. Effects of PCCB gene mutations on the
heteromic and homomeric assembly of propionyl -CoA carboxilase. Mol Genet Metab,
2001;74:476-483.
-
Lamhonwah AM, Troxel CE, Scuster S, y col. Two distinct mutations at the same
site in the PCCB gene in propionic acidemia. Genomics 1990; 8: 249-254.
-
Rodriguez P, Hoenicka J, Muros A., y col. Human propionyl -Co A carboxylase
β subunit gene: exon-intron definition and mutation spectrum in spanish and
latin american propionic acidemia patients. Am J Hum Genet 1998; 63:360-369.
|


![]()

