Introducción
En todo el mundo hay 40 millones de personas con HIV/sida, 20 millones de las cuales fallecen por causa del sida. El 1% de las personas entre 15 y 49 años tiene HIV. En los países en vías de desarrollo, cada vez más aumenta el número de mujeres infectadas por HIV, el cual sobrepasa al de los hombres. En Tailandia, 570 000 personas tienen HIV, de las cuales aproximadamente 300 000 son mujeres.1 A pesar de las recomendaciones generales establecidas desde hace varios años en diferentes regiones para evitar la transmisión vertical del virus de la inmunodeficiencia humana 1 (HIV-1), aproximadamente 630 000 niños en todo el mundo adquieren la infección cada año, la mayoría de los cuales nace en los países en vías de desarrollo.2 En 2003, 12.1 millones de niños del Africa subsahariana quedaron huérfanos a causa del sida.1
Si bien la mayoría de los niños con infección por HIV viven en Africa, la prevalencia anual del HIV en este grupo etario en Asia está en rápido aumento.2 En Tailandia, la epidemia comenzó entre los usuarios de drogas endovenosas y en prostitutas y se esparció rápidamente a los clientes de estas últimas y a partir de éstos a sus esposas, novias e hijos.3,4
La enfermedad por HIV tiene una progresión más rápida en los niños en comparación con los adultos. Al año de edad, el 30% presenta sida y a los 5 años, casi la mitad lo padece.5-7 La administración de terapia antirretroviral en los niños es difícil en los países en vías de desarrollo debido a las limitaciones en cuanto a disponibilidad, accesibilidad económica y formulaciones apropiadas. Los niños y sus familias con HIV enfrentan la discriminación en su comunidad y en la escuela. Es importante poner todos los esfuerzos en la prevención de la transmisión vertical de la infección por HIV-1.
Prevención de la transmisión vertical del HIV-1
Se realizaron progresos significativos en la última década en la prevención de la transmisión vertical del HIV. La profilaxis con agentes antirretrovirales (ARV), evitar el amamantamiento y la realización de operación cesárea en las mujeres con alta carga de ARN del HIV puede reducir la transmisión.8-11 En Tailandia, la mortalidad infantil por enfermedades infecciosas es baja, de modo que la interrupción de la lactancia materna no tiene impacto en la mortalidad relacionada con las infecciones.7
En 1994, los resultados del protocolo 076 del grupo de ensayos clínicos sobre sida en pediatría (Pediatric AIDS Clinical Trials Group,
PACTG) abrieron la puerta hacia el logro de un mayor efecto preventivo.12 En ese estudio clínico se comenzó la administración de zidovudina (ZDV) oral a mujeres embarazadas infectadas por HIV, entre las semanas 14 y 34 de gestación y continuó hasta el trabajo de parto, momento en que se utilizó ZDV endovenosa. Los niños recibieron ZDV en jarabe por 6 semanas y se alimentaron con fórmula láctea.
La tasa de transmisión del HIV disminuyó de 22.6% en el grupo placebo a 7.6% en el grupo de ZDV. Esta intervención se adoptó rápidamente como un estándar de atención en la mayoría de los países desarrollados junto con la prohibición de la lactancia materna. Debido a su alto costo y complejidad no es posible la implementación del protocolo original en la mayoría de las naciones en vías de desarrollo.13,14
Un estudio proveniente de Uganda (HIVNET 012) evaluó la eficacia y seguridad en la reducción de la transmisión vertical del HIV-1 con la administración de una única dosis de nevirapina (NVP) por vía oral en las mujeres con infección por HIV durante el trabajo de parto y otra dosis a los niños amamantados dentro de las 72 horas después del nacimiento. Esta estrategia se comparó con el esquema de administración de ZDV oral al comienzo del trabajo de parto y luego a los niños durante 7 días después del nacimiento.15 Se observó disminución del 40% en el grupo de NVP comparado con el de ZDV. A los 18 meses de edad, 16% de los lactantes en el grupo de NVP en comparación con 26% del grupo de ZDV habían adquirido la infección por HIV.16 Esto constituyó una estrategia innovadora que es simple y puede ser implementada en lugares de pocos recursos que ponen en práctica la lactancia materna.
En el estudio SAINT, la mitad de las mujeres recibieron el régimen HIVNET 012, excepto por la dosis adicional de NVP durante los primeros días posparto, y a la otra mitad se le administró el esquema ZDV/lamivudina (3TC) más ZDV a los lactantes. No hubo diferencias en la tasa de transmisión. A los 2 meses, el 12% de los niños en el grupo de NVP y el 12% en el grupo de ZDV/3TC habían adquirido la infección por HIV.17 En el ensayo PETRA se utilizaron tres regímenes de ZDV/3TC que se compararon con placebo. Si bien hubo un beneficio inicial, especialmente cuando tanto las madres como sus hijos recibieron ZDV/3TC, el efecto preventivo disminuyó considerablemente debido al amamantamiento.18
El estudio PACTG 316 no encontró mayor reducción en la transmisión del HIV cuando se administró una única dosis de NVP a las mujeres tratadas con terapia antirretroviral de gran actividad (TARGA) y a sus hijos.19
Prevención de la transmisión vertical del HIV-1 en Tailandia
Desde los primeros momentos de la epidemia de HIV en Tailandia se desalentó el amamantamiento en las mujeres infectadas por HIV. El gobierno tailandés provee fórmulas lácteas en forma gratuita a todos los niños expuestos al HIV por al menos un año. Por ende, no se implementó la lactancia materna en ninguno de los estudios o programas conducidos en Tailandia.
En 1996, la Sociedad de la Cruz Roja Tailandesa (SCRT), con el apoyo de la princesa Soamsawali y el Ministerio de Salud Pública (MSP) de Tailandia, inició una campaña de donación llamada “Salve la vida de un niño con sida”. Los objetivos fundamentales fueron evitar la transmisión vertical del HIV-1 mediante la provisión de ZDV para las mujeres embarazadas infectadas por HIV por medio de la donación pública y evaluar la factibilidad y accesibilidad económica de la terapia con ZDV.
Este programa utilizó un régimen PACTG 076 modificado con una dosis diaria más baja de ZDV durante el embarazo y ZDV oral en lugar de endovenosa durante el trabajo de parto, con una tasa de transmisión del HIV del 6%, la cual es mucho menor que la del 20% informada por otros investigadores en las mujeres que no recibieron ZDV.14
Posteriormente, se encontró que la transmisión no fue diferente si las mujeres comenzaban el tratamiento con ZDV antes o después de las 30 semanas de gestació.13 A finales de 1999, la SCRT recomendó que, en este programa, la administración de ZDV para las mujeres infectadas por HIV durante el embarazo debía comenzar a las 32 semanas de gestación (más de 6 a 8 semanas antes del parto) y continuar hasta el trabajo de parto.
En 1997, el grupo de estudio colectivo Bangkok para la transmisión vertical del HIV, conocido como el “Estudio Bangkok”, realizó un ciclo corto, controlado con placebo, de profilaxis con ZDV para evitar la transmisión vertical por HIV. Se administró ZDV oral a las mujeres embarazadas infectadas por HIV, desde las 36 semanas de gestación y durante el parto. No se suministró ZDV a los lactantes. Se observó 50% de disminución en la transmisión con una tasa de infección del 9% en el grupo tratado, en comparación con el 19% en el grupo placebo.14 Este estudio originó muchas controversias respecto de los aspectos éticos de la realización de un ensayo controlado con placebo en países en vías de desarrollo cuando se conoce la existencia de un tratamiento efectivo.16,20,21
En el mismo año, Lallemant y col. estudiaron la tasa de transmisión del HIV con regímenes terapéuticos de distinta duración con ZDV para la madre y el niño y hallaron que una mayor duración del tratamiento materno desde las 28 semanas de gestación fue crucial en la reducción de la transmisión, mientras que la duración de la terapia en el niño no fue importante.22
En 1999, un grupo de investigadores tailandeses analizó el uso de 3TC en combinación con ZDV en un estudio no aleatorizado de grupo único.23 A las mujeres se les administró ZDV/3TC desde las 34 semanas de gestación hasta el parto y los lactantes recibieron 4 semanas de monoterapia con ZDV. La tasa de transmisión fue del 2.8%.
En el 2000, luego de que se conocieron los resultados del estudio HIVNET 012, la SCRT incorporó el esquema de una dosis única de NVP en su programa terapéutico en un intento por reducir aun más la transmisión. De los primeros 80 niños nacidos en el hospital King Chulalongkorn Memorial en los cuales se utilizó el régimen de la SCRT, ninguno contrajo la infección.24 Los beneficios de una dosis única de NVP en adición al ZDV en la reducción de la transmisión vertical del HIV fueron confirmados por Lallemant y col.25 Cuando se administró una dosis única de NVP en adición al ZDV tanto a las madres como a los niños, la tasa de transmisión fue del 2.2% comparada con el 7.2% en el grupo de ZDV sola.
Debido a los datos de aparición de resistencia con una dosis única de NVP, la SCRT decidió modificar el programa terapéutico una vez más para dar sólo TARGA (ZDV/3TC/NVP) a todas las mujeres (tabla 1). Las mujeres con enfermedad por HIV más avanzada comenzaron con TARGA más temprano y continuaron hasta el parto; mientras que aquellas con enfermedad más leve o recuento de células CD4 mayor a 200 células/mm3 pudieron interrumpir la TARGA después del parto.
La NVP se suspendió 7 días antes de los análogos de nucleósidos a fin de evitar la aparición de resistencia.

Programa nacional de prevención de Tailandia
En 1997, el MSP de Tailandia decidió realizar una investigación operativa mediante la utilización de un ciclo corto de ZDV como parte de un programa amplio de prevención del HIV perinatal en los hospitales públicos, que luego se extendió a un programa nacional.26,27 Entre octubre de 2000 y julio de 2001, el 93% de aproximadamente 300 000 mujeres que dieron a luz, acordó la realización de la prueba de detección del HIV, la cual fue positiva en 3 958 (1.2%).
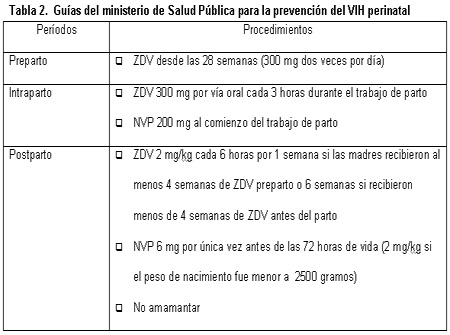
El 70% de las mujeres se trataron con ZDV y más del 80% de los lactantes recibieron ZDV y fórmula láctea.26 A todas las embarazadas se les aconsejó y se les ofreció la realización voluntaria de la prueba de detección del HIV y a todas aquellas con resultados positivos se les ofreció el tratamiento con ZDV a partir de las 34 semanas de gestación y hasta el parto. A los lactantes se les administró ZDV durante un período de tiempo que dependió de la duración del tratamiento materno con ZDV (tabla 2). Se recomendó la operación cesárea en las mujeres con más de 1 000 copias/ml de ARN del HIV. Las pruebas para la detección de anticuerpos anti-HIV en los niños se realizaron a las edades de 12 y 18 meses.
Debido al logro de tasas de transmisión marcadamente más bajas con la adición de una dosis única de NVP a la terapia con ZDV, según los informes de Lallemant y col., el MSP decidió en 2003 la inclusión de esta droga en las nuevas guías terapéuticas (tabla 2).
Programas MTCT plus en Tailandia
El objetivo del programa MTCT (mother to child transmission) plus es brindar a toda la familia atención médica y apoyo psicológico a fin de mejorar su calidad de vida, la relación interfamiliar y una contribución a la sociedad. El programa ofrece la detección de infecciones oportunistas, TARGA, monitoreo y diagnóstico del HIV para todos los miembros de la familia. Un equipo de obstetras, internistas, pediatras, enfermeros, asesores, educadores y nutricionistas trabajan en conjunto para brindar atención integral a las familias.
En octubre de 2002, el MSP comenzó un programa piloto MTCT plus en cuatro provincias, con la inclusión de 350 embarazadas por año con financiamiento del Fondo Global para Sida, Tuberculosis y Malaria. Hay planes para extender este programa a todos los hospitales regionales y provinciales. En el mismo año, la SCRT también comenzó su propio programa MTCT plus con financiamiento parcial de la Universidad de Columbia y ha incorporado hasta ahora 600 madres, padres y niños.
Resistencia y tratamiento de madres y lactantes luego de la exposición a regímenes sin TARGA para la prevención perinatal del HIV
Las preocupaciones acerca del riesgo de resistencia y las consecuencias a largo plazo de los regímenes sin TARGA que son utilizados en la prevención de la transmisión vertical del HIV, acaban de ser confirmadas por el informe de Jourdain y col. Las mujeres tailandesas que participaron en el ensayo de prevención del HIV perinatal (Perinatal HIV Prevention trial-2 study)25 posteriormente se trataron con TARGA basada en NVP cuando su recuento de células CD4 cayó por debajo de 250 células/mm3.28 Se encontró que las mujeres que habían estado expuestas a NVP tuvieron la tasa de respuesta terapéutica más baja aun cuando no se detectaron mutaciones en el genotipo. Luego de 6 meses del comienzo de la TARGA, sólo el 38% y el 52% de las mujeres expuestas a NVP con mutaciones o sin mutaciones a NVP, respectivamente, tuvieron menos de 50 copias/ml de ARN de HIV en comparación con el 68% de aquellas sin exposición a NVP. Este aumento de resistencia constituye un tema importante debido a que la terapia basada en NVP es el régimen de TARGA más ampliamente disponible y más económico en Tailandia y en otras naciones subdesarrolladas. También se produce resistencia a ZDV, pero es de menor magnitud.29,30 Debido a que las consecuencias de la resistencia a NVP son grandes, ya que una única mutación a NVP confiere resistencia tanto a NVP como a efavirenz (EFV), es preocupante que se produzcan mutaciones a NVP en 20% a 32% de mujeres y niños expuestos a una dosis única de NVP.28,31,32 La diseminación de virus resistentes a NVP es también un motivo de preocupación. Las guías pediátricas de los EE.UU. y de la Organización Mundial de la Salud sugirieron que los lactantes sean tratados con TARGA de acuerdo con la disponibilidad y accesibilidad económica de cada región.33-35 No hay suficiente información que garantice evitar la exposición a drogas por MTCT perinatal.
Los partidarios de los cursos cortos de TARGA argumentaron que para evitar la resistencia debe utilizarse un régimen que pueda suprimir el ARN del HIV. Sin embargo, los beneficios necesitan ser sopesados con la toxicidad relacionada con el tratamiento continuo con NVP. Un informe reciente demostró que las embarazadas, especialmente aquellas con altos niveles de CD4, parecen tener mayor riesgo de toxicidad hepática. Cuatro de 18 embarazadas tuvieron hepatitis fulminante luego de 4 a 6 semanas de tratamiento con ZDV/3TC/NVP.36 La utilización de ciclos cortos de TARGA puede no ser factible en ámbitos menos desarrollados que Tailandia.
Conclusión
La experiencia tailandesa de implementación de un programa nacional para reducir la transmisión vertical del HIV alentó a otras naciones a comenzar sus propios programas piloto. El mayor desafío es expandir la cobertura más allá de los proyectos piloto para llegar a todas las embarazadas infectadas por HIV y a sus familias. Esto requiere liderazgo y planificación para mejorar la infraestructura, entrenamiento, motivación, contratación del personal de salud necesario y mejora en los sistemas de distribución, de modo que las pruebas para la detección del HIV, la medicación y la provisión de fórmulas lácteas sean ampliamente disponibles para las personas que las requieran. Tailandia se dirige actualmente hacia el próximo paso mediante la expansión del programa MTCT plus para brindar atención ampliada a largo plazo para las mujeres con infección por HIV y sus familias.
Los autores no manifiestan conflictos.
BIBLIOGRAFÍA
-
2004 Report on the global AIDS epidemic. Geneva: Joint United Nations
Program on HIV/AIDS, 2004.
-
Steinbrook R. The AIDS epidemic in 2004. N Engl J Med 2004;351:115-7.
-
Pancharoen C, Thisyakorn U. Pediatric acquired immunodeficiency syndrome in
Asia: mother-to-child transmission. Clin Infect Dis 2002;34 Suppl 2:S65-9.
-
Weniger BG, Limpakarnjanarat K, Ungchusak K, et al. The epidemiology of HIV
infection and AIDS in Thailand. AIDS 1991;5 Suppl 2:S71-85.
-
Chotpitayasunondh T, Vanprapar N, Simonds RJ, et al. Safety of late in utero
exposure to zidovudine in infants born to human immunodeficiency virus-infected
mothers: Bangkok. Bangkok Collaborative Perinatal HIV Transmission Study Group.
Pediatrics 2001;107:e5.
-
Chearskul S, Chotpitayasunondh T, Simonds RJ, et al. Survival, disease
manifestations, and early predictors of disease progression among children with
perinatal human immunodeficiency virus infection in Thailand. Pediatrics
2002;110:e25.
-
Thisyakorn U, Paupunwatana S, Chotpitayasunondh T, Kanchanamayul V,
Limpitikul W, Panpitpat C. Perinatal HIV infection in Thailand. In: Brown T, Sittitrai
W, eds. International symposium on Pediatric AIDS in Thailand: A public health and
social dilemma. Cambridge, MA: Harvard AIDS Institute, 1995:23-7.
-
Connor EM, Sperling RS, Gelber R, et al. Reduction of maternal-infant
transmission of human immunodeficiency virus type 1 with zidovudine treatment.
Pediatric AIDS Clinical Trials Group Protocol 076 Study Group. N Engl J Med
1994;331:1173-80.
-
The mode of delivery and the risk of vertical transmission of human
immunodeficiency virus type 1--a meta-analysis of 15 prospective cohort studies.
The International Perinatal HIV Group. N Engl J Med 1999; 340:977-87.
-
Nduati R, Richardson BA, John G, et al. Effect of breastfeeding on mortality
among HIV-1 infected women: a randomised trial. Lancet 2001;357:1651-5.
-
Rousseau CM, Nduati RW, Richardson BA, et al. Longitudinal analysis of human
immunodeficiency virus type 1 RNA in breast milk and of its relationship to infant
infection and maternal disease. J Infect Dis 2003; 187:741-7.
-
Connor EM, Mofenson LM. Zidovudine for the reduction of perinatal human
immunodeficiency virus transmission: Pediatric AIDS Clinical Trials Group Protocol
076-results and treatment recommendations. Pediatr Infect Dis J 1995;14:536-41.
-
Thisyakorn U, Khongphatthanayothin M, Sirivichayakul S, et al. Thai Red Cross
zidovudine donation program to prevent vertical transmission of HIV: the effect of
the modified ACTG 076 regimen. AIDS 2000;14:2921-7.
-
Shaffer N, Chuachoowong R, Mock PA, et al. Short-course zidovudine for
perinatal HIV-1 transmission in Bangkok, Thailand: a randomised controlled trial.
Bangkok Collaborative Perinatal HIV Transmission Study Group. Lancet
1999;353:773-80.
-
Guay LA, Musoke P, Fleming T, et al. Intrapartum and neonatal single-dose
nevirapine compared with zidovudine for prevention of mother-to-child transmission
of HIV-1 in Kampala, Uganda: HIVNET 012 randomised trial. Lancet 1999;354:795-
802.
-
Jackson JB, Musoke P, Fleming T, et al. Intrapartum and neonatal single-dose
nevirapine compared with zidovudine for prevention of mother-to-child transmission
of HIV-1 in Kampala, Uganda: 18-month follow-up of the HIVNET 012 randomised
trial. Lancet 2003;362:859-68.
-
Moodley D, Moodley J, Coovadia H, et al. A multicenter randomized controlled
trial of nevirapine versus a combination of zidovudine and lamivudine to reduce
intrapartum and early postpartum mother-to-child transmission of human
immunodeficiency virus type 1. J Infect Dis 2003;187:725-35.
-
Efficacy of three short-course regimens of zidovudine and lamivudine in
preventing early and late transmission of HIV-1 from mother to child in Tanzania,
South Africa, and Uganda (Petra study): a randomised, double-blind, placebo-
controlled trial. Lancet 2002;359:1178-86.
-
Dorenbaum A, Cunningham CK, Gelber RD, et al. Two-dose
intrapartum/newborn nevirapine and standard antiretroviral therapy to reduce
perinatal HIV transmission: a randomized trial. JAMA 2002; 288:189-98.
-
Lurie P, Wolfe SM. Unethical trials of interventions to reduce perinatal
transmission of the human immunodeficiency virus in developing countries. N Engl J
Med 1997;337:853-6.
-
Lallemant M, McIntosh K, Jourdain G, et al. Ethics of placebo-controlled trials of
zidovudine to prevent the perinatal transmission of HIV in the Third World. N Engl J
Med 1998;338:839-40; author reply 840-1.
-
Lallemant M, Jourdain G, Le Coeur S, et al. A trial of shortened zidovudine
regimens to prevent mother-to-child transmission of human immunodeficiency virus
type 1. Perinatal HIV Prevention Trial (Thailand) Investigators. N Engl J Med
2000;343:982-91.
-
Chaisilwattana P, Chokephaibulkit K, Chalermchockcharoenkit A, et al. Short-
course therapy with zidovudine plus lamivudine for prevention of mother-to-child
transmission of human immunodeficiency virus type 1 in Thailand. Clin Infect Dis
2002;35:1405-13.
-
Suntarattiwong P, Pancharoen C, Thaithumyanon P, et al. Single dose
nevirapine in addition to zidovudine to prevent perinatal HIV transmission in King
Chulalongkorn Memorial Hospital, Bangkok, Thailand. 11th International Congress
on Infectious Diseases, Cancun, Mexico. March 4-7, 2004. [Abstract 61.005].
-
Lallemant M, Jourdain G, Le Coeur S, et al. Single-dose perinatal nevirapine
plus standard zidovudine to prevent mother-to-child transmission of HIV-1 in
Thailand. N Engl J Med 2004;351:217-28.
-
Kanshana S, Simonds RJ. National program for preventing mother-child HIV
transmission in Thailand: successful implementation and lessons learned. AIDS
2002;16:953-9.
-
Amornwichet P, Teeraratkul A, Simonds RJ, et al. Preventing mother-to-child
HIV transmission: the first year of Thailand's national program. JAMA
2002;288:245-8.
-
Jourdain G, Ngo-Giang-Huong N, Le Coeur S, et al. Intrapartum exposure to
nevirapine and subsequent maternal responses to nevirapine-based antiretroviral
therapy. N Engl J Med 2004;351:229-40.
-
Sullivan JL. Prevention of mother-to-child transmission of HIV-what next? J
Acquir Immune Defic Syndr 2003;34 Suppl 1:S67-72.
-
Nolan M, Fowler MG, Mofenson LM. Antiretroviral prophylaxis of perinatal HIV-1
transmission and the potential impact of antiretroviral resistance. J Acquir Immune
Defic Syndr 2002;30:216-29.
-
Eshleman SH, Guay LA, Mwatha A, et al. Comparison of nevirapine (NVP)
resistance in Ugandan women 7 days vs. 6-8 weeks after single-dose NVP
prophylaxis: HIVNET 012. AIDS Res Hum Retroviruses 2004;20:595-9.
-
Jackson JB, Becker-Pergola G, Guay LA, et al. Identification of the K103N
resistance mutation in Ugandan women receiving nevirapine to prevent HIV-1
vertical transmission. AIDS 2000;14:F111-5.
-
The working group on antiretroviral therapy. Guidelines for the use of
antiretroviral agents in pediatric HIV infection, www.aidsinfo.nih.gov, January 20,
2004.
-
World Health Organization. Scaling up antiretroviral therapy in resource-limited
settings: treatment guidelines for a public health approach, 2003.
-
Ministry of Public Health, Thailand. National guidelines for the clinical
management of HIV infection in children and adult, 2002.
-
Hitti J, Frenkel L, Huang S, et al. Toxicity with continuous nevirapine in
pregnancy: results from PACTG 1022. 11th Conference on retroviruses and
opportunistic infections, San Francisco. February 8-11, 2004. [Abstract 938].
|


![]()
