Introducción
Si bien es relativamente infrecuente (5.6/100 000 hombres de raza blanca en los Estados Unidos) el cáncer testicular es la neoplasia más común entre los hombres jóvenes de diversos países. Si se comparan los índices uniformados por edad desde 1973-1977 hasta 1993-1997, los hombres de raza blanca en los Estados Unidos presentaron un aumento del 47.4%, mientras que el promedio mundial se incrementó un 60%.1 La enfermedad presenta diferencias demográficas sorprendentes, de hasta 20 veces, al comparar algunas poblaciones.
Los índices más elevados (así como los mayores incrementos en porcentaje) se presentaron en Dinamarca, Finlandia, Noruega y Suecia (Dinamarca tenía un índice de 9.9/100 000 y un incremento del 70%), mientras que los índices más bajos se encontraron en las poblaciones de América latina, Asia y Africa (Cali, Colombia, tenía un índice de 1.9/100 000 y un porcentaje del 26.7%).1 El incremento en la incidencia parece estar más asociado al grupo de nacimiento que al período calendario del diagnóstico.2 La explicación más probable de este aumento es la modificación temporal en los factores de riesgo, mientras que los cambios en los patrones diagnósticos, la codificación y los métodos de vigilancia no parecen ser factores explicativos.1 Además, existen pruebas que indican que la incidencia de criptorquidia y de hipospadias (la malformación congénita más frecuente entre los niños) se encuentra también en aumento, según lo evaluado por los registros mundiales.3
Mientras que la incidencia de cáncer testicular se encuentra en aumento, la búsqueda de los factores etiológicos es dificultosa. Existen pruebas crecientes que demuestran que los eventos que acontecen durante los períodos prenatal y perinatal son factores de riesgo importantes para contraer cáncer testicular. La criptorquidia está reconocida como el factor de riesgo más importante y los hombres con esa patología presentan un riesgo relativo de cáncer testicular que oscila entre el 2.5 y el 11.4.4 Ciertos indicios, como la escasa edad al momento del diagnóstico de neoplasia testicular, y el hecho de que el 95% de los tumores testiculares deriva de la célula germinal (que relacionaría el cáncer testicular con esta estirpe celular) destacan la interferencia con las hormonas sexuales durante el embarazo. La exposición adecuada a la testosterona y a la sustancia inhibidora mulleriana son necesarias para el desarrollo sexual masculino normal y para la expresión de ese fenotipo. Se sospecha que hay relación entre las anormalidades reproductivas masculinas y la interferencia en las señales esteroideas producidas por los estrógenos (ya sea por exposición a éstos o por supresión de la testosterona), los compuestos parecidos a los estrógenos y los antiandrógenos, aun en dosis bajas. Los niveles elevados de estrógenos pueden afectar las células germinales del feto, por medio del retraso o la interrupción en el desarrollo. El momento de la exposición es crítico, ya que la diferenciación sexual masculina tiene lugar cerca de la séptima semana de gestación.
Determinadas características, como la baja concentración seminal, la motilidad escasa y el porcentaje elevado de espermatozoides morfológicamente anormales se asociaron con riesgo elevado de cáncer testicular en un estudio de cohorte realizado recientemente entre hombres que consultaron una clínica de fertilidad de Copenhague, entre 1963 y 1995.5 Skakkebaek afirma que el cáncer testicular, la infertilidad y los defectos reproductivos masculinos, como la criptorquidia y las hipospadias, deberían estudiarse como un fenómeno único, denominado síndrome de disgenesia testicular, cuya causa subyacente probablemente sea de tipo ambiental.6
El factor genético también contribuye. Los hermanos, padres y gemelos de los casos presentan riesgo elevado.7,8 Recientemente, se confeccionó un modelo animal de los tumores testiculares derivados de las células germinales que mostró que la mutación Ter –mutación heredable en el gen dnd de las ratas– determina un aumento en la susceptibilidad a presentar, en forma espontánea, tumores testiculares de las células germinales.9
Exposición a estrógenos exógenos
El ejemplo del dietilestilbestrol (DES), un potente estrógeno médico que se indicó a nivel mundial para prevenir la pérdida fetal en el embarazo desde fines de la década del ’40 hasta comienzos de los ’70, genera mayor preocupación. Los hijos de las mujeres que recibieron DES durante el embarazo presentaron 3 veces más riesgo de cáncer testicular, en comparación con los hombres que no se vieron expuestos al DES durante el período prenatal (RR = 3.05, 95% IC = 0.65-22.0), aunque no se pudo determinar si este resultado fue sólo azaroso ya que el número de casos fue sumamente escaso. Los hallazgos que relacionan la exposición al DES con el incremento del riesgo de hipospadias no fueron concluyentes, por lo que no se pudieron establecer conclusiones definitivas debido a que, nuevamente, la muestra era pequeña.11-14 En ratas, la exposición materna al DES y a otros estrógenos afectó al gen 3 para la insulina de las células de Leydig embrionarias, lo que determinó criptorquidia, aun cuando las mutaciones específicas de este gen no se hayan relacionado con dicha patología en la población humana.15,16
Diversos agentes químicos ambientales pueden actuar como estrógenos débiles (al unirse a los receptores y estimular una respuesta) o inhibir la unión de hormonas biológicas a sus respectivos receptores. Los pesticidas, los ftalatos y los fitoestrógenos naturales de la dieta pueden interferir con las hormonas o comportarse como estrógenos débiles. La exposición paterna también puede afectar las células germinales del feto, a través de mutaciones en el ADN.
Pierik17 demostró que la exposición paterna a los pesticidas se asociaba con criptorquidia (OR = 3.8, 95% IC = 1.1-13.4), a pesar de que dicha determinación no permitió la identificación de agentes químicos específicos. La concentración prenatal de ftalatos, considerando sus niveles ambientales, se asoció recientemente con disminución de la longitud anogenital y descenso testicular incompleto en humanos.18
Exposición a estrógenos exógenos
La exposición a estrógenos exógenos es otro factor de preocupación. En varios estudios actuales, los hijos de madres añosas y los primogénitos se encuentran en riesgo.19-22
El nivel plasmático de estrógenos fue mayor en las mujeres con menor cantidad de hijos y se incrementó con la edad en las mujeres nulíparas.23,24 Algunos de los factores de riesgo más constantes relacionados con la exposición temprana incluyen la edad materna, la cantidad de hijos, la edad gestacional, el peso al nacer y el uso de estrógenos exógenos.25 Realizamos el mayor estudio de asociación hasta la fecha, a fin de evaluar los factores de riesgo parentales y gestacionales para la enfermedad en cuestión. Relacionamos los los certificados de nacimiento con los casos de cáncer testicular obtenidos del California Cancer Registry (RCC), el registro de datos sobre cáncer más grande de los Estados Unidos, basado en la población.26 Los seminomas fueron clasificados de acuerdo con los códigos histológicos ICD-O 906.1, 906.1 y 906.3; el resto fue considerado como tumor no seminomatoso (teratomas, tumores del saco vitelino, tumores de histología mixta; por lo general, aproximadamente el 50% de los tumores testiculares). Es interesante investigar el cáncer testicular según su histología, ya que difiere la tendencia a largo plazo de los dos tipos histológicos principales: la incidencia de los seminomas aumenta más rápidamente que la de los no seminomas en los Estados Unidos y Canadá.27,28 Pudimos relacionar 1 645 casos individuales de los archivos electrónicos de los certificados de nacimiento de California con aquellos casos nacidos entre 1960 y 1995. Para cada caso, seleccionamos, en forma aleatoria, tres controles aislados de los archivos de nacimiento de California, que coincidieran en fecha de nacimiento y sexo. Tras la exclusión de factores, como el sexo indeterminado y la incompatibilidad entre la edad gestacional y el peso al nacer, quedaron disponibles 4 445 controles para analizar.
Al aplicar el método de regresión logística condicional confirmamos estudios previos que establecían que la edad materna avanzada se asociaba a riesgo elevado de cáncer testicular en el niño. Los hijos de madres de entre 25 y 29 años presentaron riesgo elevado, en comparación con aquellos cuyas madres tenían menos de 20 (OR = 1.31, 95% IC = 1.09-1.59) (tabla 1). El odds ratio para los hijos de madres de 30 años fue de 1.49 (95%, IC = 1.23-1.81) (el valor de p para dicha tendencia fue < 0.0001). Después de corregir, de acuerdo con un modelo multivariado, la raza parental, la edad paterna, el antecedente de muerte fetal, la cantidad de hijos y el peso al nacer, se estableció un aumento del 3% del riesgo de cáncer testicular con cada año de incremento (ORC = 1.03, 95% IC = 1.01- 1.05)

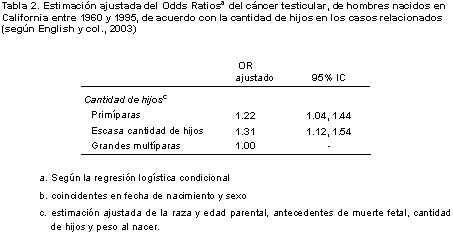
También confirmamos hallazgos previos que mostraban la relación existente entre la cantidad de hijos y el riesgo de cáncer testicular. Observamos que las mujeres primíparas o las multíparas con escasa cantidad de hijos (un solo hijo previo) presentaron mayor riesgo, en comparación con las multíparas con dos o más hijos previos (ORC = 1.22, 95% IC = 1.04-1.44 para las primíparas; OR = 1.31, 95% IC = 1.12-1.54 para las multíparas con escasa cantidad de hijos (tabla 2).
La importancia de la edad gestacional y el peso al nacer
Los estudios que investigaron los efectos de la gestación prematura y el retraso de crecimiento en el riesgo de cáncer testicular presentaron resultados variados, principalmente por verse limitados debido al escaso tamaño de la muestra. Weir y col., en un estudio sobre 502 casos y 975 controles realizado en Ontario, observaron que era más probable que los casos, y no lo controles, fueran pretérmino (12% vs. 8%), aunque no establecieron mayor riesgo asociado al peso al nacer, ya fuese alto o bajo.22 En forma similar, en un estudio realizado en Dinamarca, sobre 357 casos y 704 controles, Sabroe y Olson determinaron que los niños con bajo peso al nacer no presentaban mayor riesgo.19 Akre y col. establecieron un mayor odds ratio controlado, en relación con el cáncer testicular no seminomatoso en los niños de bajo peso al nacer,29 mientras que un estudio prospectivo de Wanderas obtuvo resultados opuestos, es decir mayor riesgo de seminoma testicular en los de bajo peso al nacer, si bien ambos estudios presentaron pruebas de heterogeneidad no significativas.21
Numerosos estudios documentaron la asociación entre la criptorquidia y el bajo peso al nacer.17,30-32 Sin embargo, el bajo peso al nacer se debe a dos procesos inconfundibles de etiología distinta: el retraso del crecimiento intrauterino (RCIU) y la prematurez. Los niños de bajo peso pueden nacer muy pequeños, en forma prematura o con ambas características. Necesitamos aclarar cuál de dichos aspectos es más importante a fin de promover las intervenciones o políticas que puedan influir sobre el riesgo; mientras que el RCIU posee factores de riesgo conocidos, como el hábito de fumar durante el embarazo y la escasa ganancia de peso materna, no se conocen la mayoría de los factores de riesgo para la prematurez.
En nuestro estudio, hallamos mayor riesgo significativo de seminoma en los niños de bajo peso al nacer (< 2 500 g), en comparación con aquellos de entre 2 500 y 4 000 gramos (OR = 1.67, 95% IC = 1.11-2.51). Este resultado sólo se aplicó a los seminomas y no fue observado en los tumores no seminomatosos (valor de p para la homogeneidad = 0.02). Analizamos más en profundidad la distribución mixta del peso al nacer y la edad gestacional a través de la aplicación del esquema de cinco categorías propuesto por Yerushalmy33 (tabla 3). Esto nos permitió encasillar los efectos del tamaño escaso al nacimiento dentro de su correspondiente dicotomía: ya sea debido a los efectos del RCIU (recién nacidos a término de entre 1 500 y 2 499 gramos) o a parto prematuro (recién nacidos pretérmino, de entre 1 500 y 2 400 gramos). Aquellos con menos de 1 500 gramos al nacer son pretérmino en su mayoría. Al analizar las categorías correspondientes a edad gestacional y peso al nacer, de acuerdo con el tipo histológico, el riesgo de seminoma se limitó a los nacidos a término de entre 1 500 y 2 499 gramos. Estos niños presentaron 2.7 veces más probabilidades de desarrollar cáncer testicular, en comparación con los que pesaron más de 2 500 gramos (OR = 2.69, 95% IC = 1.40-5.17) (tabla 3). Este efecto repercutió exclusivamente en los seminomas (valor de p para la homogeneidad = 0.008). No establecimos diferencias en el riesgo de cáncer testicular sobre la base de la altura al nacer, cuando analizamos la información por separado según el tipo histológico.
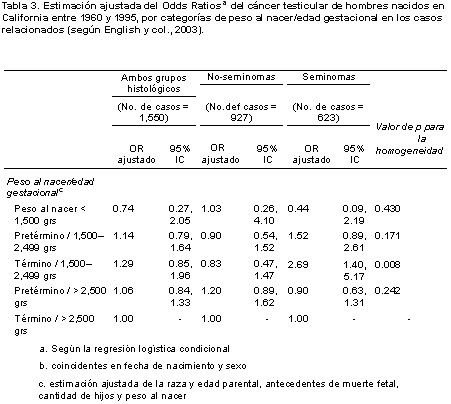
El retraso de crecimiento intrauterino ha sido propuesto como uno de los factores de riesgo más constantes asociados a las hipospadias y la criptorquidia.34,35 Determinamos que los recién nacidos a término de entre 1 500 y 2 499 gramos presentaban 2.7 veces más riesgo de presentar seminoma testicular que los que pesaban igual o más de 2 500 gramos. Esto sugiere que los factores relacionados con el retraso de crecimiento intrauterino, a diferencia del nacimiento prematuro, desempeñan un papel en el riesgo de seminoma testicular. Posiblemente haya un factor de riesgo común desconocido hasta el momento en el medio intrauterino, relacionado con el retraso de crecimiento, la criptorquidia, las hipospadias y el cáncer testicular.
Conclusiones
La incidencia del cáncer testicular continúa en aumento en todo el mundo y es bastante improbable que pueda explicarse en función de los métodos de codificación o los patrones diagnósticos. La explicación más factible es la modificación temporal en los factores de riesgo. Diversos estudios y datos biológicos muestran la importancia de las alteraciones de los niveles hormonales fetales en el descenso testicular incompleto, el principal factor de riesgo para el cáncer testicular. Ciertos factores, como la edad materna avanzada y la escasa cantidad de hijos, relacionados con la concentración materna de estrógenos, pueden fundamentar parte del incremento observado. La edad materna avanzada y la escasa cantidad de hijos también pueden ser marcadores de la disminución de la fertilidad, factor que se relacionaría con el seminoma testicular. Es posible que la exposición putativa incremente el riesgo de infertilidad femenina y de cáncer testicular en la progenie. El aumento de la supervivencia de los recién nacidos más pequeños, particularmente en las naciones con estilos de vida occidental, también estaría relacionado con el riesgo elevado. Los programas cuyos objetivos apunten a la disminución de la prevalencia del retraso de crecimiento, a través del cese del hábito de fumar y los dirigidos a evitar la escasa ganancia ponderal, pueden ser preventivos.
Los datos actuales que relacionan la exposición exógena a estrógenos y el riesgo de cáncer testicular en la progenie masculina son sugerentes, aunque no lo suficientemente definitivos para establecer conclusiones firmes. Sin embargo, cada vez son más los estudios que establecen asociaciones entre la exposición a compuestos que interfieren con los estrógenos, como los pesticidas y los ftalatos, y el cáncer testicular u otros trastornos reproductivos masculinos. Si se considera la creciente exposición de la población a los compuestos que interfieren con los estrógenos, que se encuentran en los productos de cuidado personal, los plásticos y los pesticidas,36 sería importante la realización de estudios que evalúen la relación entre el nivel corporal prenatal de agentes que interfieren con el sistema endocrino y las alteraciones reproductivas como la criptorquidia al momento de nacer. El intento de limitar la exposición a estas sustancias, establecido recientemente por diversas leyes de California y Europa, parece prudente desde el punto de vista de la salud pública y concuerda con el Principio Preventivo, que establece que “cuando una actividad implique amenaza a la salud humana o al ambiente, se deben tomar las medidas preventivas, aun cuando la relación entre causa y efecto no se encuentre totalmente establecida, desde el punto de vista científico”.37
El autor no manifiesta “conflictos de interés”.
BIBLIOGRAFÍA
-
Purdue MP, Devesa SS, Sigurdson AJ, et al. International patterns and trends in
testis cancer incidence. Int J Cancer. 2005; 115(5):822-7.
-
Richiardi L, Bellocco R, Adami HO, et al. Testicular cancer incidence in eight
northern European countries: secular and recent trends. Cancer Epidemiol
Biomarkers Prev. 2004; 13(12):2157-66.
-
Paulozzi LJ. International trends in rates of hypospadias and cryptorchidism.
Environ Health Perspect. 1999; 107(4):297-302.
-
Schottenfeld D. Testicular Cancer. In: Schottenfeld D, Fraumeni Jr , eds.
Cancer Epidemiology and Prevention, 2nd edn. New York: Oxford
University Press, 1996.
-
Jacobsen R, Bostofte E, Engholm G, et al. Risk of testicular cancer in men with
abnormal semen characteristics: cohort study BMJ 2000; 321(7264):789-92.
-
Skakkebaek NE. Testicular dysgenesis syndrome. Horm Res. 2003; 60 Suppl
3:49.
-
Garner MJ, Turner MC, Ghadirian P, et al. Epidemiology of testicular cancer: An
overview. Int J Cancer. 2005; 116(3):331-9.
-
Swerdlow AJ, De Stavola BL, Swanwick MA, et al. Risk factors for testicular
cancer: a case-control study in twins. Br J Cancer. 1999; 80(7):1098-102.
-
Youngren KK, Coveney D, Peng X, et al. The Ter mutation in the dead end gene
causes germ cell loss and testicular germ cell tumours. Nature. 2005;
435(7040):360-4.
-
Strohsnitter WC, Noller KL, Hoover RN, et al. Cancer risk in men exposed in
utero to diethylstilbestrol. J Natl Cancer Inst. 2001; 93(7):545-51.
-
Palmer JR, Wise LA, Robboy SJ, et. al. Hypospadias in Sons of Women Exposed
to Diethylstilbestrol In Utero. Epidemiology. 2005; 16(4):583-586.
-
Klip H, Verloop J, Van Gool JD, et al. Hypospadias in sons of women exposed to
diethylstilbestrol in utero: a cohort study. Lancet. 2000; 359(9312):1102-7.
-
Wilcox AJ, Baird DD, Weinberg CR, et al. Fertility in men exposed prenatally to
diethylstilbestrol. N Engl J Med. 1995; 332(21):1411-6.
-
Swan SH. Intrauterine exposure to diethylstilbestrol: long-term effects in
humans. APMIS. 2000; 108(12):793-804.
-
Nef S, Shipman T, Parada LF. A molecular basis for estrogen-induced
cryptorchidism. Dev Biol. 2000; 224(2):354-61.
-
Baker LA, Nef S, Nguyen MT, et al. The insulin-3 gene: lack of a genetic basis
for human cryptorchidism. J Urol. 2003; 169(2):622.
-
Pierik FH, Burdorf A, Deddens JA, et al. Maternal and paternal risk factors for
cryptorchidism and hypospadias: a case-control study in newborn boys. Environ
Health Perspect. 2004; 112(15):1570-6.
-
Swan SH, Main KM, Liu F, et al. Decrease in anogenital distance among male
infants with prenatal phthalate exposure. Env Health Persp 2005.
-
Sabroe S, Olsen J. Perinatal correlates of specific histological types of testicular
cancer in patients below 35 years of age: a case-cohort study based on midwives’
records in Denmark. Int J Cancer. 1998; 78(2):140-3.
-
Swerdlow AJ, Huttly SR, Smith PG. Prenatal and familial associations of
testicular cancer. Br J Cancer. 1987; 55(5):571-7.
-
Wanderas EH, Grotmol T, Fossa SD, et al. Maternal health and pre- and
perinatal characteristics in the etiology of testicular cancer: a prospective
population- and register-based study on Norwegian males born between 1967 and
1995. Cancer Causes Control. 1998; 9(5):475-86.
-
Weir HK, Marrett LD, Kreiger N, et al. Pre-natal and peri-natal exposures and
risk of testicular germ-cell cancer. Int J Cancer. 2000; 87(3):438-43.
-
Panagiotopoulou K, Katsouyanni K, Petridou E, et al. Maternal age, parity, and
pregnancy estrogens. Cancer Causes Control. 1990; 1(2):119-24.
-
Trichopoulos D, Cole P, Brown JB, Goldman MB, MacMahon B. Estrogen profiles
of primiparous and nulliparous women in Athens, Greece. Natl Cancer Inst. 1980
Jul; 65(1):43-6.
-
Depue RH, Pike MC, Henderson BE. Estrogen exposure during gestation and
risk of testicular cancer. J Natl Cancer Inst. 1983; 71(6):1151-5.
-
English PB, Goldberg D, Wolff C, Smith D. Parental and birth characteristics in
relation to testicular cancer risk among males born between 1960 and 1995 in
California (United States). Cancer Causes Control 14:815-825, 2003.
-
Weir HK, Marrett LD, Moravan V. Trends in the incidence of testicular germ cell
cancer in Ontario by histologic subgroup, 1964-1996. CMAJ. 1999; 160(2):201-5.
-
McGlynn KA, Devesa SS, Sigurdson AJ, et al. Trends in the incidence of
testicular germ cell tumors in the United States. Cancer. 2003 Jan 1; 97(1):63-70.
-
Akre O, Ekbom A, Hsieh CC, et al. Testicular nonseminoma and seminoma in
relation to perinatal characteristics. J Natl Cancer Inst. 1996; 88(13):883-9.
-
Morley R, Lucas A. Undescended testes in low birthweight infants. Br Med J
(Clin Res Ed). 1987; 295(6601):753.
-
Gatti JM, Kirsch AJ, Troyer WA, et al. Increased incidence of hypospadias in
small-for-gestational age infants in a neonatal intensive-care unit. BJU Int. 2001;
87(6):548-50.
-
Akre O, Lipworth L, Cnattingius S, et al. Risk factor patterns for cryptorchidism
and hypospadias. Epidemiology. 1999; 10(4):364-9.
-
Yerushalmy J. The classification of newborn infants by birth weight and
gestational age. J Pediatr 71:164-172, 1967.
-
Biggs ML, Baer A, Critchlow CW. Maternal, delivery, and perinatal
characteristics associated with cryptorchidism: a population-based case-control
study among births in Washington State. Epidemiology. 2002; 13(2):197-204.
-
Moller H, Weidner IS. Epidemiology of cryptorchidism and hypospadias.
Epidemiology. 1999; 10(4):352-4.
-
Centers for Disease Control and Prevention. Second National Report on Human
Exposure to Environmental Chemicals. Atlanta, GA: U.S. Department of Health and
Human Services, Centers for Disease Control and Prevention, National Center for
Environmental Health, Division of Laboratory Sciences, 2003.
-
Wingspread Statement on the Precautionary Principle, 1998.
|


![]()
