 CONCENTRACIÓN
DE FRUCTOSA EN EL PLASMA SEMINAL DE PACIENTES CON
AZOOSPERMIA OBSTRUCTIVA Y NO OBSTRUCTIVA
CONCENTRACIÓN
DE FRUCTOSA EN EL PLASMA SEMINAL DE PACIENTES CON
AZOOSPERMIA OBSTRUCTIVA Y NO OBSTRUCTIVA
|
|

|
Columnista Experto de SIIC
Dr. William
Buckett
Profesor Adjunto. Division of Reproductive Endocrinology and
Infertility, Department of Obstetrics and Gynecology, McGill
University, Hôpital Royal Victoria, Montreal, Quebec,
Canadá
Institución:
McGill University, Hôpital Royal Victoria, Montreal,
Quebec, Canadá
|
Introducción
La fructosa es secretada por las vesículas seminales y las glándulas
sexuales accesorias. En los seres humanos, la fructosa es la mayor
fuente de carbohidratos en el plasma seminal y provee más de la
mitad de los carbohidratos consumidos por los espermatozoides. La
fructosa también parece esencial para la motilidad espermática
normal [9]. La mediana de la concentración de fructosa en el plasma
seminal humano es 2-3 mg/ml [2].
Luego de la eyaculación, la fructosa es consumida por los
espermatozoides (proceso conocido como fructólisis). Por lo tanto,
ante la presencia de un elevado número de espermatozoides, mayor
cantidad de fructosa será consumida; en casos de azoospermia, menor
cantidad. Esto ha llevado a la demostración de una correlación
negativa entre la concentración de fructosa del plasma seminal y la
concentración de espermatozoides móviles [3]. Recientemente se ha
establecido el concepto de concentración corregida de fructosa [4].
Es bien conocido que los andrógenos son esenciales para el
desarrollo embriológico y el posterior crecimiento y funcionamiento
de las vesículas seminales y de las glándulas accesorias luego de
la pubertad [5]. Sin embargo, se desconoce si las gonadotrofinas o
algún otro mensajero endocrino cumplen algún papel en la secreción
de fructosa.
La estimación de la concentración de fructosa en el plasma seminal
ha sido utilizada en la evaluación rutinaria del semen [6], aunque
informes más recientes han sugerido que esta estimación rutinaria
de fructosa seminal [7,8] no es de utilidad. Las recomendaciones
actuales señalan que la fructosa seminal es útil como herramienta
de detección sistemática de azoospermia obstructiva u oligospermia
severa, en donde es un signo de disfunción de las vesículas
seminales, las cuales pueden ser exploradas ulteriormente por
ecografía transrectal [9]. Los niveles elevados de fructosa seminal
han sido asociados con astenozoospermia [3], pero no existen
informes acerca de alguna diferencia en la concentración de
fructosa en pacientes con azoospermia no obstructiva.
Por consiguiente, el propósito de este estudio fue medir las
concentraciones de fructosa en el plasma seminal en pacientes con
azoospermia no obstructiva (determinada por valores de la hormona
folículo estimulante (FSH) > 10 UI/l) y compararlas con las de
pacientes con azoospermia obstructiva (determinada por valores de
FSH < 5 UI/l) y con las de pacientes con análisis seminal
normal.
Materiales y
métodos
Se seleccionaron pacientes provenientes de una clínica regional de
andrología, la cual es un centro de referencia de alta complejidad
y de enseñanza de infertilidad masculina. Durante el período de
estudio, todos los hombres vírgenes de tratamiento, a los que se
les realizó un análisis seminal como parte de la rutina de
estudios de fertilidad, fueron incluidos en el estudio. Fueron
excluidos quienes padecían cualquier cuadro clínico que requiriera
tratamiento continuo y los que tenían antecedentes de cirugía
pelviana o escrotal (incluyendo vasectomía) e indicios de infección,
manifestada por una leucocitospermia (> 1 x 106 leucocitos/ml).
Todos los pacientes realizaron una única muestra de semen y de FSH
sérica.
Muestras de semen
Se recolectaron muestras frescas por masturbación en un recipiente
estéril plástico luego de 4 días de abstinencia sexual,
provenientes de 1 178 pacientes. El análisis seminal estándar [10]
fue realizado dentro de la primera hora de emisión, después de su
licuefacción.
Determinación
de fructosa
Luego del análisis seminal, las muestras fueron centrifugadas a 1
000 g por 5 minutos y se removió el sobrenadante del plasma seminal
para medir la concentración de fructosa. Esto se realizó
utilizando colorimetría de ácido resorcinol [11]. El coeficiente
de variación entre diferentes lotes fue 4.6% para 3.5 mg/ml (19.6
mmol/l) y los límites de medición fueron 0.09 y 7.2 mg/ml.
Determinación sérica de hormona estimulante de folículos (FSH)
La FSH sérica se determinó utilizando un equipo de doble
anticuerpo para FSH (Diagnostic Products, DPC Ltd, Llanberris, Reino
Unido). La precisión intraensayo fue > 10% en todos los puntos
de la curva de ensayo. La precisión entre diferentes ensayos
presentó un coeficiente de variación entre 8% y 12%. En nuestro
laboratorio (sobre la base de 480 muestras provenientes de 480
pacientes con parámetros seminales normales), el percentilo 95 para
FSH es 5 UI/L.
Análisis estadístico
La normalidad de la distribución de las concentraciones de fructosa
se investigó con la prueba de Shapiro-Wilk. Los resultados se
expresaron como medianas e intervalos intercuartilos, y las
comparaciones entre los grupos se efectuaron mediante la prueba U de
Mann-Whitney. Se consideraron estadísticamente significativos los
valores de p < 0.01.
Resultados
De los 1 178 pacientes incorporados inicialmente al estudio, 265
(22.5%) presentaron azoospermia; 683 (58.0%), otros parámetros
anormales en el análisis seminal, y 230 (19.5%), un resultado
normal (de acuerdo con los criterios de la OMS). De los 265
pacientes con azoospermia, 139 (52.5%) mostraron una FSH sérica
> 10 UI/l y fueron denominados como grupo de azoospermia no
obstructiva (Grupo 1). Ochenta y nueve pacientes (33.6%) tuvieron
una FSH sérica < 5 UI/l y constituyeron el grupo control de
azoospermia obstructiva (Grupo 2). Los restantes 37 pacientes con
azoospermia presentaron FSH séricas entre 5-10 UI/l y fueron
excluidos del estudio. Los 230 hombres con parámetros seminales
normales conformaron el grupo control (Grupo 3).
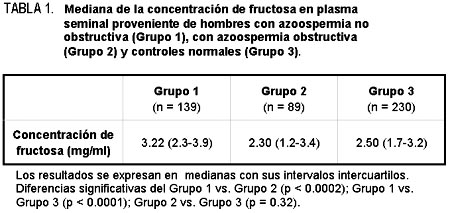
Se observaron concentraciones significativamente elevadas en el
plasma seminal de pacientes con azoospermia no obstructiva (Grupo 1)
al ser comparadas con las de pacientes con azoospermia obstructiva
(Grupo 2) (p < 0.0002), o con individuos normales (Grupo 3) (p
< 0.0001). No hubo mayores diferencias entre las concentraciones
de fructosa de plasma seminal del grupo de azoospermia obstructiva y
el grupo control (Grupo 2 y Grupo 3; p = 0.32), aunque el valor de
la mediana fue menor en el grupo de azoospermia obstructiva.
Ver tabla 1.
La concentración corregida de fructosa, definida como [logaritmo de
la concentración de espermatozoides móviles] x [concentración de
fructosa seminal], no se puede calcular en ambos grupos de
azoospermia (Grupo 1 y Grupo 2), puesto que el logaritmo de 0 es
menos infinito (-∞).
Discusión
Estos resultados son los primeros en demostrar que las
concentraciones de fructosa están aumentadas en el semen de
pacientes con azoospermia no obstructiva. Esto podría ser resultado
de una secreción continua de fructosa a partir de las vesículas
seminales y de las glándulas sexuales accesorias en ausencia de
espermatozoides, lo cual conduce a falta de utilización de fructosa
y, por consiguiente, a concentraciones más elevadas en el plasma
seminal. Ya ha sido establecida una relación negativa entre la
motilidad espermática y la concentración de fructosa de plasma
seminal [3], aunque esta correlación fue débil (r = 0.062); es
improbable que sea la única razón para el incremento significativo
de concentraciones de fructosa comparadas con las del grupo control
y el grupo de azoospermia obstructiva. Aunque debe considerarse que,
en este último grupo, pueden haber varios pacientes que presenten
algún grado de disfunción vesicular y, por eso, muestren bajas
concentraciones de fructosa [12]. Más del 2% de los hombres estériles
pueden tener tales anomalías [13]; pero es improbable que éstas
hayan provocado la disminución de la mediana de la concentración
de la fructosa de todo el grupo, porque la dispersión y el
intervalo entre cuartilos son similares a la de los controles
normales.
Otra posible explicación del aumento de la concentración de
fructosa es que su secreción sea también dependiente de la
estimulación de FSH. El conocimiento convencional se basa en que la
estructura y función de la vesícula seminal y las de la glándula
accesoria son andrógeno dependientes, aunque se ha arribado a esa
conclusión considerando que estas glándulas no tienen función
antes de la pubertad y presentan regresión en ausencia de
testosterona (por ejemplo, luego de la castración). El papel de los
otros factores que pueden influir sobre la función de la vesícula
seminal y la secreción de fructosa no ha sido investigado. Estos
resultados deberían sugerir que la FSH también juega un papel en
la secreción de fructosa.
Muchos debates se han centrado en el concepto de azoospermia
obstructiva y no obstructiva, determinadas por la FSH sérica, luego
del rescate de espermatozoides vitales en biopsias testiculares en
hombres con azoospermia no obstructiva y posteriores embarazos con
recién nacidos vivos [14,15]. Sin embargo, la FSH sérica aún
permanece como un buen factor de discriminación de posibilidad de
rescate de espermatozoides vivos y como factor predictivo de
resultado exitoso [7,9] y, por lo tanto, continúa siendo útil la
clasificación de azoospermia en obstructiva y no obstructiva basada
en los niveles séricos de FSH. En este estudio, los hombres con FSH
sérica entre 5 UI/L y 10 UI/L fueron excluidos con el objeto de
crear dos grupos distintivos.
La estimación de las concentraciones corregidas de fructosa, como
expresión opuesta a la concentración incorrecta de fructosa, puede
jugar un papel importante cuando las concentraciones de
espermatozoides móviles son elevadas; pero, como admiten los
autores, no es útil en casos de oligospermia severa [16] o, como lo
demuestra este trabajo, en casos de azoospermia.
Aunque este estudio ha demostrado elevadas concentraciones de
fructosa en plasma seminal en azoospermia no obstructiva, estos
hallazgos no indican que tenga sentido continuar con la estimación
seminal de rutina de la concentración de fructosa. Es improbable
que, junto con la FSH sérica, la fructosa del plasma seminal sea
capaz de discriminar entre aquellos pacientes con probabilidad de
que se les rescate espermatozoides en un biopsia testicular y aquéllos
en los que esto no es probable.
En conclusión, por consiguiente, éste es el primer estudio en
demostrar un aumento de la concentración de fructosa en el plasma
seminal de hombres con azoospermia no obstructiva. Aunque ello pueda
obedecer a la falta de utilización de fructosa, por la ausencia de
espermatozoides en el semen, necesita determinarse aún el papel de
la FSH en la función de la vesícula seminal y la glándula
accesoria.
BIBLIOGRAFIA
- Schoenfled CY, Amelar RD, Dubin L, Numeroff M (1979): Prolactin, fructose and zinc levels found in human seminal plasma. Fertil Steril 32:206-208.
- Suominen J (2001): Seminal fructose and glucose in asthenozoospermia. Int J Androl 24:253-254.
- Lewis-Jones DI, Aird IA, Biljan MM, Kingsland CR (1996): Effects of sperm activity on zinc and fructose concentration in seminal plasma. Hum Reprod 11:2465-2467.
- Gonzales GF (2001): Function of seminal vesicles and their role on male infertility. Asian J Androl 3:251-258.
- Setchell BP, Brooks DE (1988) Anatomy, vasculature, innervation and fluids of the male reproductive tract. In: The physiology of reproduction. Knobil E, Neill J (Eds). New York: Raven Press, pp753-836.
- Perez-Pelaez M, Jeyendran RS, Alagaratnam D (1985): Biochemistry of seminal plasma in azoospermic men. Arch Androl 15:177-180.
- Papadimas J, Papadopoulou F, Ioannidis S, Spanos E, Tarlatzis B, Bontis J, Mantalenakis S (1996): Azoospermia: clinical, hormonal, and biochemical investigation. Arch Androl 37:97-102.
- Zopfgen A, Priem F, Sudhoff F, Jung K, Lenk S, Loening SA, Sinha M (2000): Relationship between semen quality and the seminal plasma components carnitine, alph- glucosidase, fructose, citrate and granulocyte elastase in infertile men compared with a normal population. Hum Reprod 15:840-845.
- Crosignani PG, Rubin BL (2000): Optimal use of infertility diagnostic tests and treatments. The ESHRE Capri Workshop Group. Hum Reprod 15:723-732.
- World health Organization (1999): WHO Laboratory Manual for the Examination of Human Semen and Semen-Cervical Mucus Interaction (3rd Edition). Cambridge: CUP.
- Moon KH, Bunge RG (1968): Observations on the biochemistry of human semen. Fertil Steril 19:186-191.
- Lewin LM, Beer R, Lunenfeld B (1977): Paper chromatographic estimation of fructose and myo-inositol in human seminal fluid: a method for evaluating seminal vesicle and prostatic function. Int J Fertil 22:48-51.
- Aumuller G, Riva A (1992): Morphology and functions of the human seminal vesicle. Andrologia 24:183-196.
- Wu FCW (1995): Whither the investigation of male infertility? Is FSH measurement redundant and should azoospermic patients have testicular biopsy? Hum Reprod 10:1945- 1947.
- Devroey P, Liu J, Hagy Z, Goossens A, Tournaye H, Camus M, Van Steirteghem A, Silber S (1995): Pregnancies after testicular sperm extraction and intracytoplasmic sperm injection in non-obstructive azoosoermia. Hum Reprod 10:1457-1460.
- Gonzales GF, Villena A (2001): True corrected seminal fructose level: a better marker of the function of the seminal vesicles in infertile men. Int J Androl 24:255-260.
|
 ERECCIÓN
NATURAL PROVOCADA POR PROSTAGLANDINA E1 EN EL DIAGNÓSTICO Y
TRATAMIENTO DE LAS ANOMALÍAS PENEANAS CONGÉNITAS
ERECCIÓN
NATURAL PROVOCADA POR PROSTAGLANDINA E1 EN EL DIAGNÓSTICO Y
TRATAMIENTO DE LAS ANOMALÍAS PENEANAS CONGÉNITAS
|
Columnista
Experto SIIC
Dr. Sava V.
Perovic
Profesor en la University
Children’s Hospital, Departamento de Urología, Belgrado,
Yugoslavia
Institución:
University Children’s Hospital, Departamento de Urología,
Belgrado, Yugoslavia |
Introducción
Desde que Gittes y Mc Laughlin la crearon, la técnica de la
erección artificial1 ha sido el método intraoperatorio más usado
para el diagnóstico de la curvatura peneana, sea aislada o asociada
con otras anomalías del pene.2 Sin embargo, sus desventajas nos han
llevado a investigar una técnica más simple o mejor para inducir
la erección; es el caso de la aplicación de una droga vasoactiva:
la prostaglandina E1 (PGE1).
Materiales y
métodos
Desde febrero de 1991 a febrero de 1999 la erección natural
inducida por la PGE1 fue utilizada en 912 pacientes con edades de 12
meses a 47 años (promedio: 4.9 años). Las indicaciones fueron
varias anomalías peneanas congénitas: curvatura peneana simple (80
casos), curvatura ventral peneana sin hipospadias (136) o con
hipospadia (283), epispadias (32), cripple penis (48), micropene
(27) y otras 65 anomalías peneanas diversas. La ereción natural
con PGE1 fue usada para el diagnóstico de la curvatura peneana, el
tratamiento quirúrgico de las anomalías del pene y el control
posoperatorio. La inyección de PGE1 se practica dentro de los
cuerpos cavernosos sobre el sector lateral de la porción media del
pene levemente elongado. La dosis de PGE1 dependió de la edad y del
tamaño y la respuesta del pene. Según nuestros conocimientos, no
existe una fórmula precisa para la dosificación de PGE1 tanto en
niños como en adultos. La dosis inicial de PGE1 que nosotros
utilizamos fue de 0.5-1 gg en niños entre 1 y 5 años, 1-2.5 gg en
adolescentes y 5-10 gg en adultos. En casos de una respuesta
eréctil inadecuada (35 pacientes), se volvió a inyectar pero de
manera contralateral. Después de la segunda inyección todos, a
excepción de 7 sujetos, lograron una erección adecuada. En estos
11 individuos que no respondieron, la PGE1 no se inyectó por
tercera vez y se implementó la erección artificial. La reparación
quirúrgica fue realizada mientras se intentaba la erección natural
con PGE1.
Resultados
En 877 pacientes se logró una erección completa. Una reacción
positiva, que consistió en la erección completa, fue observada
entre 2 y 10 minutos después de la inyección y se mantuvo desde 30
minutos hasta 4 horas (promedio: 80 minutos). Una erección
prolongada hasta 6 horas fue registrada en 2 pacientes. No tuvo
lugar la existencia de priapismo. Once pacientes fueron
caracterizados como no respondedores, dado que no se logró una
erección adecuada aun después de la segunda inyección de PGE1.
Tampoco se produjeron hematomas ni lesiones en el lugar de la
inyección; del mismo modo, ni la uretra ni el ovillo neurovascular
se afectaron por el procedimiento. No se produjeron efectos
colaterales y el seguimiento se extendió de 6 meses a 8 años
(promedio. 5.5 años). Durante este período no se registraron
complicaciones locales o sistémicas.
Discusión
La erección artificial tiene sus desventajas: dilatación forzada
de los tejidos eréctiles peneanos, limitaciones en el tiempo y
dificultad para ser utilizada en hipospadias severas, epispadias,
micropene y cripple penis.
Las epispadias representan un problema especial debido a las
características anatómicas. Los cuerpos cavernosos son divergentes
y la circulación cruzada entre los 2 cuerpos se obtiene,
principalmente, sobre el epitelio uretral con epispadia. La
circulación cruzada es insuficiente para que la solución salina
inyectada dentro de uno solo de los cuerpos cavernosos se transfiera
al otro y de este modo obtener una erección completa. Lo mismo
sucede si la inyección se practica dentro del glande epispádico.
La erección artificial es necesaria para inyectar simultáneamente
solución salina dentro de ambos cuerpos cavernosos. Debido a la
divergencia de éstos, la colocación de un torniquete en la base
del pene del sujeto con epispadia es muy dificultosa. En la
erección con PGE1 la circulación cruzada es suficiente para
distribuir la sustancia vasoactiva dentro del otro cuerpo cavernoso
y lograr de este modo la erección completa de ambas estructuras. En
epispadias, la inyección de PGE1 dentro de un solo cuerpo cavernoso
es suficiente y la colocación del torniquete resulta innecesaria.
 |
|
 |
| Figura
1. La erección natural con PGE1 muestra la marcada curvatura
ventral peneana en un adolescente. La uretra con los cuerpos
esponjosos y el ovillo neurovascular son fácilmente
movilizados durante la erección completa permanente sin
sangrado significativo. |
|
Figura
2. El mismo paciente. La erección natural provocada con PGE1
durante la cirugía permitió la correción precisa de la
curvatura ventral (corporoplastia dorsal y técnica de la
plicatura de incisión). |
En el tratamiento
de las anomalías congénitas peneanas la erección artificial se
utiliza varias veces de manera intraoperatoria con el fin de evaluar
las anormalidades y corregirlas. En la erección natural con PGE1
habitualmente una inyección de la sustancia vasoactiva logra una
erección lo suficientemente prolongada como para evaluar y corregir
la anomalía existente.
En la erección artificial se utiliza, habitualmente, una aguja de
amplio diámetro mientras que para la inyección del PGE1 se emplea
una aguja de un calibre inferior a los 27 Gauge.
La erección provocada por la inyección intracavernosa de PGE1
tiene varias ventajas. El efecto farmacológico de la PGE1 se basa
en la inhibición de la actividad a1adrenérgica en los tejidos
peneanos y sus efectos relajantes sobre el músculo liso cavernoso.3
La dilatación lograda en los tejidos eréctiles es de tipo natural.
Durante la reparación quirúrgica, la erección del pene permite
una adecuada estimación del tamaño de los distintos colgajos que
deben ser preparados. Esto es muy importante en adolescentes y
adultos, donde la relación entre tamaño del pene eréctil y
fláccido es de hasta 4:1. Del mismo modo, la movilización de los
segmentos peneanos es mucho más fácil en el estado eréctil. El
estado eréctil ha mejorado notablemente el porcentaje de éxitos de
la cirugía de las anomalías congénitas peneanas, especialmente la
reparación de las hipospadias en adultos y adolescentes. La
erección natural con PGE1 ha probado ser un método muy seguro para
niños, teniendo en cuenta que ellos constituyen la mayoría de
nuestros pacientes. Sin embargo, este método tiene también sus
desventajas. Durante la cirugía pueden ocurrir episodios de
sangrado, aunque no demasiado diferentes de los que acontecen con el
pene fláccido, salvo que se lesionen los cuerpos cavernosos. La
erección prolongada después de la cirugía tiene también sus
desventajas, debido a que necesita de curaciones repetidas después
de la detumescencia peneana. Finalmente cabe señalar que este
método es costoso.
Conclusión
La erección natural lograda por la inyección de PGE1 dentro de un
cuerpo cavernoso es un método simple, eficaz, confiable y seguro
que podría ser una buena alternativa a la erección artificial en
el diagnóstico y el tratamiento de las anomalías congénitas
peneanas.
BIBLIOGRAFIA
- Schoenfled CY, Amelar RD, Dubin L, Numeroff M (1979): Prolactin, fructose and zinc levels found in human seminal plasma. Fertil Steril 32:206-208.
- Suominen J (2001): Seminal fructose and glucose in asthenozoospermia. Int J Androl 24:253-254.
- Lewis-Jones DI, Aird IA, Biljan MM, Kingsland CR (1996): Effects of sperm activity on zinc and fructose concentration in seminal plasma. Hum Reprod 11:2465-2467.
|
 EXCRECION
URINARIA DE
a-1-MICROGLOBULINA EN EL DIAGNOSTICO Y SEGUIMIENTO DE
LA PIELONEFRITIS AGUDA
EXCRECION
URINARIA DE
a-1-MICROGLOBULINA EN EL DIAGNOSTICO Y SEGUIMIENTO DE
LA PIELONEFRITIS AGUDA
|
 |
Columnista Experto de SIIC
Dr. Karel Everaert
Médico Urólogo,
Departamento de Urología, University Hospital of Ghent, Ghent,
Bélgica
Institución:
University Hospital of Ghent, Ghent, Bélgica
|
Introducción
A pesar de que
muchos pediatras nefrólogos, neurólogos y doctores en
rehabilitación aún consideran que el diagnóstico de la
pielonefritis aguda puede realizarse sobre la base del
examen de orina y de criterios clínicos y biológicos, la
identificación de la infección del tracto urinario (ITU)
en niños pequeños o en pacientes con enfermedad de vejiga
neurogénica1-4 es difícil. La sintomatología específica
a menudo está ausente y el elevado índice de
contaminación en la recolección de la muestra a través de
una bolsa adhesiva o un catéter se asocia con sensibilidad
y especificidad bajas de la leucocituria y bacteriuria,
especialmente cuando el estudio de orina no se realiza en
forma inmediata. El diagnóstico de ITU basado en los
criterios de Kass no sólo tiene carácter retrospectivo
(más de 48 horas), lo cual constituye una pérdida de
tiempo inaceptable (en caso de ITU alta), sino que en niños
pequeños también demuestra baja sensibilidad a causa de la
contaminación. La baja confiabilidad de la leucocituria y
la bacteriuria se asocia con sobretratamiento por
contaminación y subterapias o tratamientos demorados en
casos de pielonefritis aguda atípica. Debido a que el
diagnóstico de pielonefritis aguda puede ser difícil y
lleva mucho tiempo en niños de escasa edad y en pacientes
con vejiga neurogénica, una prueba rápida sería de suma
utilidad en el diagnóstico temprano de esta patología.
El ácido dimercaptosuccínico (DMSA) marcado con 99mTc es
un sustrato radioisotópico que se absorbe en los túbulos
contorneados proximales de forma tal que puede medirse su
captación renal. Los defectos de área se visualizan como
defectos de captación. El procedimiento se considera la
herramienta estándar para el diagnóstico de pielonefritis
aguda.6-11 Sin embargo, a menos que la centellografía se
realice en forma seriada, el centellograma en el momento de
una ITU aguda no permite diferenciar entre lesiones pasadas
y destrucción tubular reciente.10-11 Las proteínas
séricas de peso molecular inferior a 40 000 Da atraviesan
fácilmente la membrana glomerular y se reabsorben en los
túbulos renales de forma tal que, en orina normal, sólo se
encuentran cantidades extremadamente pequeñas. El daño de
los túbulos proximales se asocia con pérdida de estas
proteínas, aun cuando las lesiones son focales. Asimismo,
el fenómeno no puede ser enmascarado por compensación en
otras partes del riñón. Se sabe que la pielonefritis
origina daño en los túbulos proximales y que, por lo
tanto, puede diagnosticarse o seguirse a través de la
valoración de las pequeñas proteínas en orina. Para el
diagnóstico de pielonefritis, elegimos la proteína tubular
a-1-microglobulina (a1Mg) porque es estable, incluso a
temperatura ambiente, y puede ser fácilmente valorada por
inmunonefelometría, un método de amplia disponibilidad.

Los resultados tienen que mostrar correlación con la
centellografía con DMSA marcado con 99mTc, que es la prueba
estándar en el diagnóstico de daño de los túbulos
proximales. En caso de existir buena correlación entre la
excreción urinaria de a1Mg y la centellografía con DMSA,
la primera podría brindar el diagnóstico de manera
rápida, confiable y económica. Este método de rastreo
permitiría la adopción de mejores estrategias de
tratamiento y evitaría estudios innecesarios. Asimismo, se
podrían diferenciar las lesiones agudas y las secuelares.
Los objetivos del estudio fueron determinar si la lesión
positiva por centellografía (pielonefritis aguda) se
asociaba con elevada excreción de a1Mg (ausencia de falsos
negativos) y si los enfermos con lesiones negativas por
centellografía (cistitis) presentan niveles urinarios
normales de a1Mg (ausencia de falsos positivos).

Metodología
Pacientes
Seleccionamos retrospectivamente 62 niños (19 varones y 43
niñas, de 4 ± 3 años) derivados a nuestra clínica por
ITU (tabla 1), a quienes se había practicado ecografía
renal y centellografía con DMSA dentro de los 4 días del
inicio del tratamiento. Asimismo, los pacientes
seleccionados fueron evaluados con un nuevo estudio
centellográfico, al menos tres meses después. Todos los
enfermos tenían ITU confirmada, según criterios Kass.5
Cuarenta y cuatro se clasificaron como pielonefritis aguda
(27 varones y 17 niñas; 3 ± 3 años) según las imágenes
centellográficas. Sin embargo, sólo 31 de los 44 tenían
evidencia clínica de pielonefritis. En los 13 casos
restantes, el diagnóstico de pielonefritis aguda se basó
en las imágenes centellográficas ante la presencia de
síntomas atípicos. En 18 niños (3 varones y 15 mujeres; 6
± 4 años) se diagnosticó cistitis de acuerdo con
síntomas clínicos de ITU, sin lesiones focales en el
primer estudio centellográfico. Este grupo fue considerado
como control.
Métodos
En el momento del ingreso al hospital se tomó una muestra
de orina para cultivo. La concentración de a1Mg se
determinó mediante nefelometría aumentada por látex. Los
valores de referencia son de 0 a 8 mg/l. La centellografía
se realizó después de la hiperhidratación de los
enfermos. La captación derecha e izquierda absoluta de DMSA
con 99mTc se calculó a partir del registro de ambos
riñones, 24 horas después de la inyección del
radiomarcador. Los valores absolutos se calcularon después
de deducir la actividad basal y se expresaron como
porcentaje del total de la dosis inyectada. Las imágenes se
registraron con una cámara equipada con un colimador
multipropósito de baja energía.

Resultados
La edad y la distribución urinaria de la concentración de
a1Mg, para ambas subpoblaciones, se muestra en la figura 1.
Los resultados de la sintomatología, ecografía renal y
proteinuria renal (a1Mg) se dan en la tabla 1 para cada
diagnóstico.
El índice entre la excreción urinaria de creatinina y a1Mg
fue significativamente superior (p < 0.001) en pacientes
con pielonefritis aguda en comparación con los enfermos con
cistitis aguda (figura 1). Encontramos sensibilidad de 98%,
especificidad de 100% (p < 0.001, área bajo la curva de
0.980) y probabilidad negativa de 0.02. Sólo un paciente
con pielonefritis aguda presentó niveles normales de
excreción de a1Mg en relación con la eliminación de
creatinina mientras que todos los enfermos con cistitis
tuvieron eliminación normal de la proteína (tabla 1).
La tabla 2 muestra los resultados del porcentaje absoluto de
captación de DMSA con 99mTc en los riñones derechos e
izquierdos. Si bien la recaptación de DMSA y la a1Mg son
dos marcadores independientes de la función tubular
proximal, la correlación fue adecuada (r = 0.758; p <
0.001) en esta población seleccionada de enfermos.
Discusión
Nuestros datos indican que la excreción urinaria de a1Mg en
relación con la depuración de creatinina, en un estudio
elevadamente selectivo, tiene altas sensibilidad (98%) y
especificidad (100%) en el diagnóstico de pacientes con
lesiones agudas según la centellografía y en la capacidad
de diferenciar los enfermos sin lesiones agudas. Dos
estudios prospectivos demostraron sensibilidad de 94% a 96%
y especificidad de 73% a 78% de la eliminación urinaria de
a1Mg para el diagnóstico de pielonefritis aguda.18,19
Pueden mencionarse varias razones para la relativa baja
especificidad encontrada en estas investigaciones. Se
registraron concentraciones elevadas de a1Mg en algunos
enfermos con prostatitis aguda,18 que se explica por un
descenso en el índice de filtración glomerular (por debajo
del 70%) en estos pacientes sépticos y gravemente
enfermos.19 Con la finalidad de diferenciar entre
pielonefritis aguda y prostatitis, se sugirió la relación
entre la concentración urinaria de a1Mg y los niveles
séricos de antígeno prostático específico. La
temperatura elevada aumenta la proteinuria pero sólo ejerce
una influencia limitada sobre la eliminación urinaria de
a1Mg, a diferencia de los marcadores habituales de daño
tubular.14,18,19 Cuando la hipertermia se asocia con un
índice disminuido de filtración glomerular (por debajo del
70%), la excreción urinaria de a1Mg aumenta. Otras
condiciones que influyen negativamente sobre la
especificidad de la excreción urinaria de este marcador son
la insuficiencia renal manifiesta (índice de filtrado
glomerular inferior al 70%), daño glomerular (diabetes),
síndrome de Falconi y medicación nefrotóxica
(aminoglucósidos, quimioterapia, metales y exposición
crónica a antiinflamatorios no esteroides). Sin embargo,
estas situaciones son raras en pacientes en quienes se
sospecha ITU y pueden ser fácilmente diagnosticadas con una
buena historia clínica. Los estudios futuros deberán
evaluar la especificidad de la proteinuria como prueba
diagnóstica de disfunción tubular con sistemas
específicos tal como lo sugirieran Guder y colaboradores.21
La a-2-microglobulina se usó en el diagnóstico de la
pielonefritis aguda. Sin embargo, su estabilidad depende de
la acidez de la orina, la cual es sumamente variable y
requiere una determinación rápida de laboratorio, lo que
no siempre es posible.14,15 La actividad urinaria de la
N-acetil-beta-D-glucosaminidasa (NABG) fue útil en el
diagnóstico de la pielonefritis aguda en niños pero no en
pacientes con lesiones medulares.16,17 En cambio, la
eliminación urinaria de a1Mg tuvo sensibilidad y
especificidad elevadas en un estudio prospectivo en
pacientes con lesiones neurológicas, lo cual sugiere mayor
sensibilidad de este marcador en comparación con la
actividad de la NABG.18 La disfunción tubular distal
origina diabetes insípida transitoria y
pseudohipoaldosteronismo (pérdida de sal e hipercalcemia).
Sin embargo, la disfunción tubular distal no tiene valor
diagnóstico en pielonefritis focal unilateral debido a que
los túbulos remanentes compensan la función.12,13 La
centellografía con DMSA con 99mTc tiene utilidad probada en
el diagnóstico de pielonefritis aguda y es la prueba
estándar en estudios prospectivos de esta patología.
Seguramente, continúa siendo la mejor estrategia para
correlacionar el riesgo de evolución de las lesiones
renales cicatrizales. La excreción de a1Mg ofrece una
prueba ideal para valorar el daño tubular y dos estudios
prospectivos demostraron su utilidad clínica.18,19 Una
semana después del inicio del tratamiento con
antibióticos, la excreción de esta proteína se
normaliza18 pero no informa sobre el potencial daño renal
porque no se encuentra elevada en pacientes con
pielonefritis crónica.19 La excreción urinaria de a1Mg
tiene ventajas potenciales en el diagnóstico diferencial de
ITU superior e inferior. Su disponibilidad es mayor que la
de la centellografía y no se requiere la inyección de
radioisótopos. Esta prueba permite el diagnóstico de
pielonefritis aguda en el momento de la internación, antes
de que estén disponibles los resultados del cultivo de
orina.19
Conclusión
En un estudio retrospectivo de pacientes con pielonefritis
aguda y lesiones negativas en la centellografía (cistitis)
se demostró eliminación urinaria normal de a1Mg. En
estudios prospectivos, este parámetro sigue siendo una
prueba diagnóstica útil con elevada sensibilidad y
razonable especificidad. Esta cualidad puede incrementarse
con sistemas específicos proteicos tal como lo sugiere la
literatura médica.
BIBLIOGRAFÍA
1.
Rubin MI: Infection of the urinary tract. In Pediatric
Nephrology, Rubin MI and BarrattTM. The Williams &
Wilkins Compagny, Baltimore, 1975;607-645.
2.
Sponseller PD: Evaluating children with back pain. Am Fam
Phys 1996; 54:1933-1941.
3.
Waites KB, Canupp KC, De Vivo MJ: Epidemiology and risk
factors for urinary tract infection, foflowing spinal cord
injury. Arch Phys Med Rehabil 1993; 74:691-695.
4.
Van Kerrebroeck PEV, Koldewijn EL, Scherpenhuizen S,
Debruyne FMJ: The morbidity due to lower urinary tract
function in spinal cord injury patients. Paraplegia 1993;
31:320-329.
5.
Kass EH: Asymptomatic infections of the urinary tract. Tranc
Assoc of Am Physicians 1956;69:56
6.
Benador D, Benador N, Slosman DO: Cortical scintigraphy in
the evaluation of renal parenchymal changes in children with
pyelonephritis. J Paediatr 1994: 124:17-20.
7.
Rushton HG, Majd M, Chandra R: Evaluation of Tc-99-m DMSA
renal scans in experimental acute pyelonephritis in piglets.
J Urol 1988; 140:1169-1174.
8.
Merrick MV, Uttley WS, Wild SR: Detection of pyelonephritic
scarring in children by radio-isotope imaging. Br J Radiol
1980; 53:544-556.
9.
Conway JJ, Cohn RA: Evolving role of nuclear medicine for
the diagnosis and managment of urinary tract infection. J
Paediatr 1994; 124: 87-90.
10.
Everaert H, Flamen P, Franken PR, Peeters P, Bossuyt A,
Piepsz A: 99Tcm-DMSA renal seintigraphy for acute
pyelonephritis in adults: Planar and/or SPET imaging. Nucl
Med Com 1996; 17:884-889.
11.
Mackenzie JR: A review of renal scarring in children. Nucl
Med Com 1996; 17:176-190.
12.
De Naeyer A, Raes A, Vande Walle J: Significance of tubular
proteinuria in therapeutic and diagnostie approach of
children with urinary tract infections. Proceedings
Belgische kinderartsen vergadering 1993:129.

|
|



