 Resumen
La incidencia de enfermedad autoinmunitaria del oído interno (EAOI) es difícil de determinar: probablemente, se trata de una entidad poco frecuente, responsable de menos del 1% del total de casos de trastornos auditivos o mareos. Sin embargo, el diagnóstico de EAOI puede pasarse por alto debido a la falta de pruebas diagnósticas específicas. La principal característica de esta afección clínicamente diagnosticada es la presencia de una pérdida de audición neurosensitiva (PANS) bilateral, rápidamente progresiva y, con frecuencia, fluctuante, que se produce durante un período de semanas a meses. La progresión de la pérdida auditiva es demasiado rápida como para ser diagnosticada como presbiacusia y demasiado lenta como para llevar al diagnóstico de PANS súbita. Los síntomas vestibulares, tales como inestabilidad generalizada, ataxia, vértigo posicional y vértigo episódico, pueden estar presentes en casi el 50% de los pacientes. En ocasiones, sólo un oído se encuentra afectado inicialmente, pero la pérdida auditiva bilateral sucede en la mayoría de los pacientes, con umbrales audiométricos simétricos o asimétricos. Casi el 25% al 50% de los pacientes también presentan acúfenos y sensación de plenitud auditiva, los cuales pueden ser fluctuantes. Las enfermedades autoinmunitarias sistémicas coexisten en el 15% al 30% de los pacientes.
Resumen
La incidencia de enfermedad autoinmunitaria del oído interno (EAOI) es difícil de determinar: probablemente, se trata de una entidad poco frecuente, responsable de menos del 1% del total de casos de trastornos auditivos o mareos. Sin embargo, el diagnóstico de EAOI puede pasarse por alto debido a la falta de pruebas diagnósticas específicas. La principal característica de esta afección clínicamente diagnosticada es la presencia de una pérdida de audición neurosensitiva (PANS) bilateral, rápidamente progresiva y, con frecuencia, fluctuante, que se produce durante un período de semanas a meses. La progresión de la pérdida auditiva es demasiado rápida como para ser diagnosticada como presbiacusia y demasiado lenta como para llevar al diagnóstico de PANS súbita. Los síntomas vestibulares, tales como inestabilidad generalizada, ataxia, vértigo posicional y vértigo episódico, pueden estar presentes en casi el 50% de los pacientes. En ocasiones, sólo un oído se encuentra afectado inicialmente, pero la pérdida auditiva bilateral sucede en la mayoría de los pacientes, con umbrales audiométricos simétricos o asimétricos. Casi el 25% al 50% de los pacientes también presentan acúfenos y sensación de plenitud auditiva, los cuales pueden ser fluctuantes. Las enfermedades autoinmunitarias sistémicas coexisten en el 15% al 30% de los pacientes.
 Palabras clave
audición, enfermedades autoinmunitarias, oído interno
Palabras clave
audición, enfermedades autoinmunitarias, oído interno
 Abstract
Abstract
Incidence of autoimmune inner ear disease (AIED) is difficult to determine: probably it is a rare disease, accounting for less than 1% of all cases of hearing impairment or dizziness. Nevertheless, the diagnosis of AIED might be overlooked because of the lack of specific diagnostic tests. The hallmark of this clinically diagnosed condition is the presence of a rapidly progressive, often fluctuating, bilateral SNHL over a period of weeks to months. The progression of hearing loss is too rapid to be diagnostic for presbycusis and too slow to conclude a diagnosis of sudden SNHL. Vestibular symptoms, such as generalized imbalance, ataxia, positional vertigo and episodic vertigo may be present in almost 50% of patients. Occasionally only one ear is affected initially, but bilateral hearing loss occurs in most patients, with symmetric or asymmetric audiometric thresholds. Almost 25%-50% of patients have also tinnitus and aural fullness, which can fluctuate. Systemic autoimmune diseases coexist in 15%-30% of patients.
 Key words
Key words
hearing, autoimmune diseases, inner ear
Artículo completo
TRASTORNOS AUTOINMUNITARIOS DEL OIDO INTERNO
(especial para SIIC © Derechos reservados)
Introducción
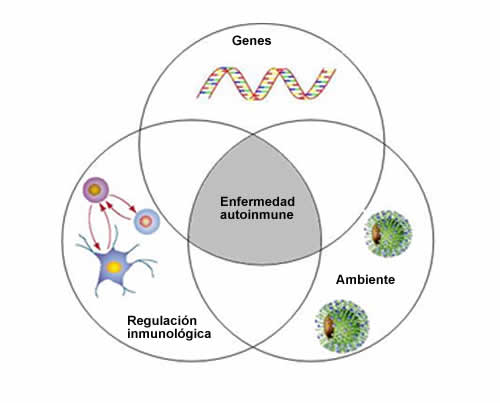
Las enfermedades autoinmunes son trastornos frecuentes y, muchas veces, tienen consecuencias devastadoras. La principal característica de la enfermedad autoinmune del oído interno (EAOI) es la presencia y persistencia de procesos inflamatorios en ausencia aparente de patógenos, lo que lleva a la destrucción de los tejidos blanco. Probablemente, estos trastornos tienen relación con una predisposición genética subyacente que genera la expresión del trastorno autoinmune como consecuencia de defectos inmunorreguladores de la respuesta inmunitaria a patógenos ambientales desconocidos (Figura 1).
El concepto de que el sistema inmunitario puede jugar un papel en algunos tipos de pérdida de audición idiopáticas o de trastornos vestibulares ha sido introducido durante las primeras décadas del siglo pasado por Joannovic1 y Masugi.2 En 1958, Lehnard3 postuló la sospecha de que algunos casos de pérdida auditiva bilateral repentina podían estar relacionados con la producción de anticuerpos anticocleares. Kikuchi4 escribió acerca de la “otitis simpática”, en la cual la cirugía de un oído afectaba la audición del oído contralateral. El autor propuso un fenómeno autoinmune como etiología. En 1961 Beickert,5 y tres años después Terayama,6 publicaron información que avalaba la autoinmunidad en cócleas experimentales de conejillos de Indias. Distintas hipótesis etiológicas relacionadas con mecanismos inmunológicos han sido propuestas en los años subsiguientes por otros autores.7-9
En 1960, Cody y Williams,10 mientras investigaban el síndrome de Cogan, postularon la hipótesis de que este síndrome no estaría confinado sólo a la córnea y al VIII par craneal, sino que, probablemente, formaría parte de una enfermedad generalizada, caracterizada por alteraciones vasculares e identificable como enfermedad del colágeno. En 1979, McCabe11 describió por primera vez una cohorte de 18 pacientes con pérdida de audición asimétrica bilateral progresiva durante semanas o meses que respondió a la terapia con esteroides. Este autor propuso la definición de pérdida auditiva autoinmune y declaró la importancia de mantener un alto índice de sospecha en estos pacientes dado que, si se llega a un diagnóstico en forma temprana, estos pueden ser tratados y preservar así su audición. El trabajo alentaba, además, la investigación sobre este tema.
Actualmente, se cuenta con gran cantidad de información que avala el mecanismo autoinmune para algunas de las afecciones del oído interno, entre las que se incluyen la enfermedad de Menière, la otoesclerosis, la pérdida auditiva neurosensitiva progresiva (que se asocia con síntomas vestibulares en el 50% de los casos) y, posiblemente, un pequeño porcentaje de sordera súbita.
Asimismo, en varias enfermedades autoinmunes sistémicas, el sistema vestibulococlear puede estar afectado. En otras palabras, una enfermedad autoinmune sistémica coexiste en el 15% al 30% de estos pacientes.
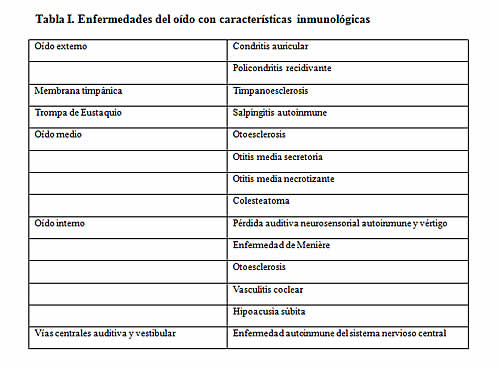
Yoo12 elaboró listas de enfermedades del oído con probables características inmunológicas (Tabla 1) y de enfermedades autoinmunes que afectan la audición y el equilibrio (Tabla 2). Las características clínicas de estas entidades pueden ser diferentes según la presencia de unilateralidad o bilateralidad, la forma de comienzo, la relación con el compromiso auditivo o vestibular, la tasa de progresión y la respuesta terapéutica.

Existen varias teorías acerca de cómo puede surgir una enfermedad autoinmune del oído interno, las cuales son análogas a las de otras afecciones de este tipo:
-Reacciones cruzadas: anticuerpos o linfocitos T alterados causan daño accidental al oído interno dado que el oído comparte antígenos comunes con una sustancia, virus o bacteria potencialmente perjudicial contra los cuales el organismo está actuando. En la actualidad, ésta es la principal teoría para explicar la EAOI.
-Daño ocasional: el daño al oído interno causa la liberación de citoquinas, las cuales generan (luego de un período de latencia) reacciones inmunes adicionales. Esta teoría podría explicar los ciclos de actividad y remisión que se observan en afecciones tales como la enfermedad de Menière.
-Intolerancia: el oído, como el ojo, puede constituir un sitio inmunológico parcialmente privilegiado. Esto significa que el organismo puede no conocer todos los antígenos del oído interno y, cuando estos se liberan (tal vez luego de una cirugía o una infección), el organismo puede iniciar erróneamente un ataque contra el antígeno “exógeno”. En el ojo, existe un síndrome llamado “oftalmía simpática” en el cual, luego de una lesión penetrante en un ojo, se afecta el ojo contralateral. En el oído, el mismo mecanismo podría verse involucrado en la llamada “cocleolaberintitis simpática”, la cual ha sido reproducida en modelos con animales (Gloddeck).13
-Factores genéticos: aspectos del sistema inmunitario controlados genéticamente pueden incrementar la susceptibilidad o estar asociados con un incremento en la susceptibilidad de trastornos auditivos frecuentes, tales como la enfermedad de Menière. Bernstein et al.,14 informaron que el 44% de los pacientes con enfermedad de Menière, otoesclerosis y presbiacusia estrial presentaban un halotipo particularmente extendido del complejo mayor de histocompatibilidad (CMH) (Dqw2-Dr3-c4Bsf-C4A0-G11: 15-Bf:0.4-C2a-HSP70:7.5-TNF), comparado con sólo el 7% de los controles.
Trastornos del oído interno mediados por el sistema inmune
EAOI
La incidencia de EAOI es difícil de determinar: probablemente, se trata de una enfermedad rara, responsable de menos del 1% de todos los casos de alteraciones auditivas o mareos. Sin embargo, el diagnóstico de EAOI puede pasarse por alto debido a la falta de pruebas diagnósticas específicas. La entidad parece ser más común en mujeres de entre 20 y 50 años, y se manifiesta mediante una pérdida de audición neurosensitiva (PANS) bilateral rápidamente progresiva, y generalmente fluctuante, que se produce en un período de semanas a meses.15 La progresión de la pérdida auditiva es, con frecuencia, demasiado rápida para ser diagnosticada como presbiacusia y demasiado lenta para llevar al diagnóstico de PANS súbita. Síntomas como inestabilidad generalizada, ataxia, intolerancia al movimiento, vértigo posicional y vértigo episódico se encuentran con frecuencia presentes en casi el 50% de los pacientes. En la serie de casos de McCabe,11 dos tercios de los pacientes tenían un grado bajo de síntomas vestibulares sin crisis de vértigo. Asimismo, una detallada historia clínica rara vez puede revelar trastornos endocrinos o fiebre recurrente. La pérdida de audición bilateral sucede en el 80% de los pacientes,15 con umbrales audiométricos simétricos o asimétricos, aunque sólo un oído se ve afectado en los estadios iniciales. Casi el 25% al 50% de los casos también sufren de acúfenos y sensación de plenitud auditiva, los cuales pueden ser fluctuantes. También, puede presentarse parálisis facial, así como destrucción del tejido de la membrana timpánica, del oído medio o del mastoides. No obstante, el examen físico del oído suele ser normal.
Estos casos son análogos a la glomerulonefritis rápidamente progresiva. Si no se trata, la inflamación del oído interno progresa a daño grave e irreversible dentro de los 3 meses del comienzo del cuadro (y con frecuencia, más rápido). Lamentablemente, la respuesta inmunitaria es perjudicial para el oído interno y da como resultado la degeneración del órgano de Corti, de la estría vascular y del ganglio espiral, así como cambios atróficos en el nervio coclear. Muchos estudios llevados a cabo en animales y en seres humanos han demostrado degeneración de las estructuras del oído interno, cambios atróficos del nervio acústico y formación de hidrops endolinfático.
Si bien podría ser deseable contar con pruebas específicas para detectar procesos autoinmunes del oído interno, al momento en que se escribió el presente trabajo no existía prueba alguna disponible comercialmente que haya demostrado ser de utilidad. Actualmente, el diagnóstico de la EAOI se realiza sobre la base del criterio clínico y la respuesta positiva a los esteroides. Existen escasos indicios derivados de pruebas de laboratorio que puedan indicar autoinmunidad. No se dispone de pruebas con antígenos específicos (prueba de inhibición de la migración, prueba de transformación de linfocitos y análisis de inmunotransferencia) que estén comercialmente disponibles y que hayan demostrado ser útiles en el diagnóstico de enfermedades sistémicas autoinmunes. En la práctica clínica, más allá de la tasa de eritrosedimentación, que resulta indispensable, puede ser útil una prueba de detección sistemática de antígeno no específico para comprobar una disfunción inmunitaria sistémica; aun así, ésta no se correlaciona, necesariamente, con el diagnóstico de enfermedad del oído interno mediada por el sistema inmunitario.
Se recomienda la realización de las siguientes pruebas:
-Análisis de sangre para enfermedades autoinmunes: ESG/PCR (proteína C-reactiva), inmunoglobulinas séricas (IgM, IgG, IgA, IgE), niveles de complejos inmunes circulantes, anticuerpos antinucleares (ANA), anticuerpos anticitoplasma de neutrófilos (ANCA), anticuerpos anticélulas endoteliales (AECA), anticuerpos antifosfolípidos/anticardiolipina, factor reumatoideo, complemento C1Q, anticuerpos antimúsculo liso, anticuerpos anti-TSH y antimicrosomales y pruebas de HLA.
-Análisis de sangre para afecciones que se asemejan a los trastornos autoinmunes: prueba de absorción de anticuerpos antitreponema fluorescentes (para sífilis), titulación para enfermedad de Lyme, hemoglobina glucosilada (HbA1c) (para diabetes, la cual con frecuencia también está mediada por el sistema inmune), VIH (el VIH está asociado con neuropatía auditiva).
De todos modos, llevar a cabo esta búsqueda inmunológica exhaustiva no es imprescindible cuando los recursos económicos son limitados.16 Se debe destacar que una prueba disponible comercialmente, conocida como “inmunotransferencia anti-68-kD (hsp-70)” (OTOblotTM) logró detectar un proceso autoinmune local en el oído interno en ausencia de procesos autoinmunes sistémicos y tuvo correlación con la respuesta a los esteroides. Esta prueba utiliza el antígeno hsp-70 purificado derivado de una línea celular de riñón bovino y se basa en la presunción de que la proteína 68-kDa es la proteína de choque térmico 70 (hsp-70). Lamentablemente, esta presunción ha sido recientemente refutada: de hecho, hay cada vez más indicios de que el antígeno blanco del anticuerpo de 68-kDa no es la hsp-70 (tal como se creyó en los últimos 15 años), sino la proteína 2 similar al transportador de colina humana.17,18 Además, esta prueba tiene una sensibilidad y especificidad muy bajas.
El diagnóstico diferencial comprende: síndrome del acueducto vestibular dilatado, hipertensión endocraneal, enfermedad sifilítica del oído interno, enfermedad de Lyme, toxoplasmosis, tratamiento con fármacos ototóxicos, enfermedad de Charcot-Marie-Tooth.
Para una revisión más detallada de los trastornos autoinmunes del oído interno, véase también Bovo et al.19
Enfermedad de Menière
Un mecanismo autoinmune parece ser el responsable del 6% de las formas unilaterales de la enfermedad de Menière y del 16% de las formas bilaterales. Esta hipótesis se ve respaldada por información experimental: el hidrops puede ser inducido experimentalmente mediante la inyección de antígenos o anticuerpos monoclonales; los antígenos del oído interno, con un peso molecular de 68 000, 58 000, 42 000 y 28 000, podrían ser los principales componentes que inducen la autoinmunidad de la enfermedad de Menière en conejillos de Indias; el depósito de complejos inmunes circulantes puede producir inflamación e interferir con la capacidad de filtración del saco; se ha demostrado la presencia de anticuerpos antivirales y blastogénesis linfocitaria; ciertos loci relacionados con el HLA D podrían estar asociados con la enfermedad de Menière; el saco endolinfático es el sitio de respuesta inmune del oído interno y constituye también el lugar más involucrado en su patogénesis. Podría ser blanco de mediadores liberados a partir de inhalantes sistémicos o reacciones alimentarias; los cambios del hueso temporal se asocian con cambios inmunológicos; la eficacia del tratamiento con esteroides.
La descripción de los aspectos clínicos de la enfermedad de Menière escapa al objetivo de este capítulo; para una revisión reciente y detallada, véase Sajjadi y Paparella.20
Hidrops endolinfático tardío (HET)
El HET es una entidad clínica que puede diferenciarse de la enfermedad de Menière y que se caracteriza por la aparición de síntomas hidrópicos ipsilaterales o contralaterales en el contexto de una pérdida auditiva neurosensitiva profunda de larga evolución en un solo oído. Esta asociación fue postulada por primera vez por Kamei et al.,21 y luego caracterizada con el nombre de “sordera unilateral con vértigo posterior” por Wolfson y Leiberman22 y Nadol et al.23 Por lo general, la sordera existente previamente es una pérdida unilateral profunda de comienzo en la niñez: el tiempo que transcurre desde la aparición de la pérdida auditiva hasta el comienzo del HET es de 1 a 74 años. Los niños que presentan pérdida de audición unilateral tienen un 30% de riesgo de padecer HET a lo largo de la vida, con un 17% del riesgo durante los primeros 15 años.21 El HET también puede presentarse en la sordera congénita bilateral, y es cada vez más reconocido como causa de mareos luego de un implante coclear.24,25 Existen dos tipos de HET: el ipsilateral, en el cual los pacientes experimentan un comienzo con vértigo episódico en el oído hipoacúsico, y el contralateral, en el cual se produce pérdida auditiva fluctuante o vértigo episódico en el oído opuesto, que previamente tenía una audición normal. La incidencia del tipo ipsilateral es mayor que la del contralateral, pero este último es más común en pacientes de más edad.
Existen indicios que señalan que, en forma análoga a la enfermedad de Menière, también el tipo contralateral de HET tendría etiología autoinmune.26 Asimismo, en estudios histopatológicos llevados a cabo en el hueso temporal de personas afectadas por HET contralateral se observaron cambios patológicos en los oídos hipoacúsicos, similares a los encontrados en la laberintitis viral, mientras que los cambios patológicos de los oídos no hipoacúsicos se asemejaban a aquellos que se producen en la enfermedad de Menière,27-29 lo que concuerda con la presunta fisiopatología común.
Los síntomas vestibulares son idénticos a los de la enfermedad de Menière. No obstante, es importante diferenciar estas dos entidades clínicas, dado que los síntomas y la evolución natural son generalmente más graves en el caso del HET.
Vestibulopatía bilateral (VB)
Rinne et al.30 estudiaron los factores causales de la VB mediante una revisión retrospectiva de 53 pacientes: se sospechó una etiología autoinmune en 5 casos (9%). En una reciente revisión retrospectiva más amplia, de la que participaron 255 pacientes, Zingler et al.31 determinaron la etiología de la VB en el 24% de los casos y encontraron una etiología probable en el 25%. Las causas más comunes fueron ototoxicidad por aminoglucósidos (13%), enfermedad de Menière (7%) y meningitis (5%). Sorprendentemente, un importante subgrupo de estos pacientes (25%) tenían una disfunción cerebelosa asociada y, de ellos, el 32% sufría también polineuropatía periférica, en comparación con el 18% de los pacientes con VB, pero sin signos cerebelosos. Por lo tanto, los autores sugirieron que, en muchos de estos casos, la VB podría estar causada por procesos neurodegenerativos o autoinmunes. A pesar de las dificultades en demostrar un mecanismo autoinmune en pacientes con oscilopsia e inestabilidad secundaria a VB, parece razonable admitir que alrededor del 5% de estos casos estén causados probablemente por una respuesta autoinmune.
Afecciones audiovestibulares asociadas con trastornos autoinmunes sistémicos
Síndrome de Cogan
El síndrome de Cogan típico es una enfermedad rara que se produce en adultos jóvenes y se caracteriza por queratitis intersticial no sifilítica, pérdida auditiva neurosensitiva, acúfenos y crisis de vértigo recidivantes, semejantes a las de la enfermedad de Menière. La pérdida de audición es generalmente bilateral, y progresa a sordera completa en un período de 1 a 3 meses en el 60% de los casos.32 La enfermedad atípica se presenta con lesión ocular inflamatoria (conjuntivitis, escleritis, iritis, coroiditis, hemorragia retiniana o subconjuntival) y queratitis intersticial o sin ella. Si los síntomas audiovestibulares no son similares a los de la enfermedad de Menière, o suceden más de 2 años antes del comienzo de los síntomas oculares o después de éste, el paciente es considerado como portador de síndrome de Cogan atípico.32 La enfermedad atípica se asocia con vasculitis sistémica y trastornos relacionados en el 20% de los casos. Además, se produce una insuficiencia aórtica de alto riesgo en el 10% de los casos. Con frecuencia, se ha informado una clara asociación entre las infecciones de las vías respiratorias altas y el comienzo de este síndrome, y cada vez hay más indicios de que una infección viral desencadenaría una respuesta de anticuerpos que generaría inmunidad cruzada con proteínas similares a las del oído interno, el ojo y, ocasionalmente, también otros órganos.
Estudios citopatológicos han demostrado que las células polimorfonucleares llegan primero a los sitios de inflamación, seguidas de los linfocitos T y B, mientras que la secreción de anticuerpos específicos podría ser un evento relativamente más tardío. En forma concomitante al incremento de los componentes celulares se produce la formación de una matriz extracelular densa. El oído interno parece tener gran dificultad en eliminar esta matriz, la que resulta finalmente en osificación. Las alteraciones del hueso temporal incluyen hidrops endolinfático, atrofia del órgano de Corti, osteoneogénesis, degeneración de las células del ganglio espiral, degeneración quística de la estría vascular, derrame del oído medio, desmielinización del nervio acústico y vasculitis de la arteria auditiva interna.33
A pesar de la instauración de un tratamiento inmunosupresor rápido y adecuado, la mayoría de los casos de síndrome de Cogan progresan a una pérdida auditiva profunda bilateral, con requerimiento de implante coclear.
Síndrome de Behçet
El síndrome de Behçet es una enfermedad multisistémica caracterizada por la presencia de ulceraciones genitales y orales recurrentes, así como de uveítis. El neuro-Behçet (NB), originalmente descrito por Knapp en 1941,34 sucede en el 5.3% al 38% de los pacientes, en los cuales constituye un factor adverso para el pronóstico. La pérdida de audición neurosensitiva ha sido informada en el 12% al 80% de los pacientes y la pérdida vestibular, en el 25% al 38%.35-38 Asimismo, Kocer et al.39 estimaron que la región bulboprotuberancial se ve afectada por lesiones focales en el 40% de los casos. Aunque la NB es rara en la niñez (1% al 2% de los casos), Hatachi et al.40 describieron el caso de un niño de 10 años que presentó fiebre, cefaleas, vértigo y pérdida auditiva.
Las trombosis de venas cerebrales son más frecuentes que las oclusiones arteriales y pueden ser la primera manifestación de la enfermedad de Behçet. Sin embargo, Lee et al.41 y Gan et al.42 informaron casos clínicos de vértigo recidivante debido a múltiples oclusiones recurrentes reversibles de la arteria basilar o de la arteria cerebelosa posteroinferior (PICA).
Síndrome de Vogt-Koyanagi-Harada
El síndrome de Vogt-Koyanagi-Harada (VKH) es una entidad autoinmune sistémica poco frecuente que afecta a los melanocitos localizados en la úvea, el oído interno, la piel, el cabello y las meninges, y que se caracteriza por uveítis aguda (que causa compromiso visual bilateral), vértigo, pérdida auditiva, alopecia, vitiligo, cefaleas y pleocitosis en el líquido cefalorraquídeo. Frecuentemente, el comienzo de la enfermedad se anuncia con signos de irritación meníngea, que incluyen cefaleas graves y dolor periocular. Ocasionalmente, rigidez de cuello y síntomas otológicos como acúfenos y vértigo aparecen tempranamente en el episodio inflamatorio. La presencia de disfunción vestibular periférica, con nistagmo horizontal o rotatorio horizontal y disminución de la función laberíntica en la prueba calórica, fue observada en la mayoría de los pacientes por Yoshimoto.43 Además, Thara y Sekitani44 informaron que las pruebas de función vestibular dieron resultados anormales en el 77% de los pacientes, mientras que raramente se demostraron signos y síntomas de compromiso del sistema nervioso central. Asimismo, en una serie reciente de 24 pacientes descrita por Ondrey et al.,45 sólo uno (4%) tuvo vértigo; la elevación del umbral de tonos puros fue prevalente en ocho de ellos (33.3%), y dos (8.3%) experimentaron acúfenos. Sin embargo, tal como destacaron estos autores, es posible que los pacientes con síndrome de VKH no tratado puedan sufrir alteraciones audiovestibulares más frecuentes y de mayor gravedad de lo que ha sido observado en esta cohorte de individuos.
Trastornos del sistema vestibular central
Diversos trastornos del sistema nervioso central que presentan un patrón inflamatorio pueden comprometer a la vía vestibular central debido a la frecuente localización de las lesiones en el tronco encefálico.
Ciertamente, su etiología no es infecciosa y podría tener relación con un mecanismo autoinmune. La prevalencia y relevancia de los síntomas vestibulares en las características clínicas de estos pacientes puede variar desde marginal hasta preeminente; en pocos casos, el vértigo y los mareos pueden presentarse como manifestaciones iniciales del trastorno autoinmune.46
Estos trastornos están representados por:
-Esclerosis múltiple.
-Encefalitis autoinmune.
-Vasculitis (síntomas vestibulares en el 20% de los casos)
Sistémica.
Angeítis primaria del sistema nervioso central.
Síndrome de Susac (también llamado síndrome SICRET: infartos pequeños en tejido coclear, retiniano y encefálico).47
-Encefalomielitis paraneoplásica.48
-Paquimeningitis hipertrófica crónica autoinmune.49
Tratamiento
Hasta la fecha, no existen registros de ensayos aleatorizados sobre el tratamiento de los trastornos del oído interno mediados por el sistema inmunitario. Si bien la mayoría de los clínicos concuerdan en que este tipo de afecciones requiere un tratamiento rápido y agresivo, es difícil iniciar una terapia con corticoides o inmunosupresores cuando el diagnóstico es incierto. Al igual que lo observado por Agrup,50 esto es especialmente cierto para el caso de la población pediátrica, debido a los riesgos que suponen los graves efectos colaterales y la posibilidad de implementar un tratamiento prolongado.
Más allá de estas consideraciones, por lo general se recomienda prednisolona, 1 mg/kg/día durante 4 semanas, seguido de un ajuste gradual por varias semanas hasta llegar a una dosis de mantenimiento de 10 a 20 mg/día. La terapia a corto plazo o a largo plazo con una dosis menor no fue eficaz o parece aumentar el riesgo de recidivas. Con frecuencia, los pacientes logran aprender cuál es la dosis de mantenimiento necesaria para preservar su audición, dado que la actividad de la enfermedad crece y decrece constantemente. Si durante la etapa de ajuste de dosis la audición empeora súbitamente o reaparecen los acúfenos en uno o ambos oídos, está indicada la repetición de la dosis alta utilizada en el tratamiento inicial. En un estudio pequeño,51 la administración transtimpánica de esteroides ha demostrado mejorar la audición y aliviar los síntomas del equilibrio de la EAOI. Son necesarios ensayos de mayor tamaño para determinar la verdadera eficacia de la administración oral o transtimpánica de fármacos.52 En pacientes que no responden a los esteroides luego de 6 a 8 semanas, se utilizó metotrexato y ciclofosfamida en terapias a largo plazo.53,54 Estos fármacos se asocian con toxicidad considerable, por lo que la decisión de cuándo y cómo utilizarlos debe ser siempre multidisciplinaria. Además, recientes estudios han cuestionado la eficacia del metrotrexato en la EAOI.55 La dosis oral habitual de esta sustancia es de 7.5 a 20 mg en forma semanal, con suplemento de ácido fólico. La ciclofosfamida combinada con esteroides ha sido utilizada con el siguiente régimen: ciclofosfamida, 5 mg/kg/día por vía intravenosa por 2 semanas, seguido de un período de descanso de 2 semanas y, luego, un período final de infusiones de 2 semanas. Otros tratamientos han sido utilizados sobre una base más o menos empírica y con resultados contradictorios: plasmaféresis,56 anticoagulación, agentes antitrombóticos, inmunoglobulinas intravenosas y oxígeno hiperbárico. También, varios laboratorios investigaron la posibilidad de emplear terapia celular o génica para reemplazar las células dañadas del oído en la EAOI. Las pruebas de laboratorio en modelos con animales son promisorias, pero aún se requiere mucha más información para determinar su eficacia y seguridad.57,58
Experiencia personal
Casos clínicos especiales de enfermedades autoinmunes con síntomas audiovestibulares
Esclerosis múltiple. En algunos casos de esclerosis múltiple, las primeras manifestaciones clínicas están representadas por síntomas audiovestibulares, por lo que el especialista en otorrinolaringología debe tener presente esta posibilidad.
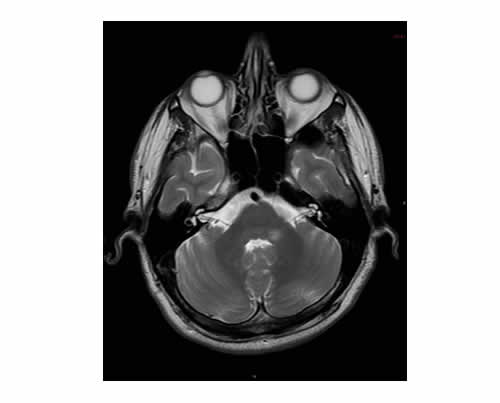
Un hombre de 34 años sufrió episodios de mareos sin pérdida de audición; al examen, presentaba nistagmo rotatorio horizontal espontáneo hacia la derecha en posición primaria y en la mirada a la derecha. No tenía disartria, diplopía, oftalmoparesia, debilidad de miembros, dismetría o pérdida sensitiva; los potenciales provocados auditivos de tronco encefálico (PEAT) eran normales. Diez días después, apareció súbitamente una pérdida de audición en el oído izquierdo, y en los PEAT, los movimientos sacádicos horizontales y la prueba de seguimiento visual eran patológicos. La resonancia magnética (RM) reveló lesiones con refuerzo en el bulbo raquídeo posterolateral izquierdo y en el pedúnculo cerebeloso inferior (Figura 2).
Enfermedad de Behçet. A veces, las manifestaciones audiovestibulares son preeminentes respecto de otras manifestaciones clínicas, como sucede en el siguiente caso.
Se trata de un hombre de 36 años, cuya primera manifestación clínica fue una trombosis venosa profunda cuando tenía 26 años, seguida de otro episodio similar 3 años después. Durante ese período, experimentó una súbita pérdida de audición del oído derecho, restringida a las frecuencias medias; la prueba de respuesta auditiva del tronco cerebral (ABR) y la RM eran normales. Durante los últimos seis años, el paciente sufrió episodios recurrentes de vértigo agudo y el umbral auditivo disminuyó progresivamente en las frecuencias altas en forma bilateral. Aparecieron escasas manifestaciones mucocutáneas: pequeñas úlceras orales o lesiones de tipo papulopústulas en tronco y miembros inferiores. No se diagnosticaron otras manifestaciones.
Paquimeningitis craneal hipertrófica autoinmune. La paquimeningitis craneal hipertrófica (PCH) es una forma rara de proceso inflamatorio crónico fibrosante, que se caracteriza por un notable engrosamiento de la duramadre intracraneal. En la mayoría de los casos (80%), se desconoce la etiología, aunque las formas secundarias pueden ser el resultado de enfermedades infecciosas o neoplásicas. La variedad idiopática constituye un diagnóstico de exclusión y, probablemente, representa una enfermedad autoinmune focal. La manifestación clínica más frecuente son las cefaleas y, en un pequeño porcentaje de pacientes, puede ser el único síntoma por muchos años; en general, las cefaleas se presentan diariamente en forma crónica, asemejándose a una migraña crónica.59 La segunda manifestación clínica más frecuente es la parálisis de nervios craneales, que se debe al atrapamiento o al daño isquémico que sufren las estructuras neurovasculares a nivel del agujero occipital de la calota basal debido al engrosamiento de la duramadre. El nervio acústico es el que se compromete más habitualmente y, en términos de frecuencia, es seguido por el nervio óptico, el ocular y el craneal inferior. En estos pacientes, se ha descrito pérdida de audición neurosensitiva progresiva, mareos y crisis de vértigo recidivantes.60,61 El diagnóstico se lleva a cabo mediante RM con gadolinio y biopsia abierta de la duramadre en casos seleccionados. Lamentablemente, la PCH tiene una progresión lenta e insidiosa; además, es común encontrar una mejoría transitoria, ya sea espontánea o posterior al tratamiento con esteroides. Por estas razones, es frecuente que el diagnóstico se retrase, lo cual puede tener graves consecuencias, especialmente en casos de compromiso del nervio óptico.
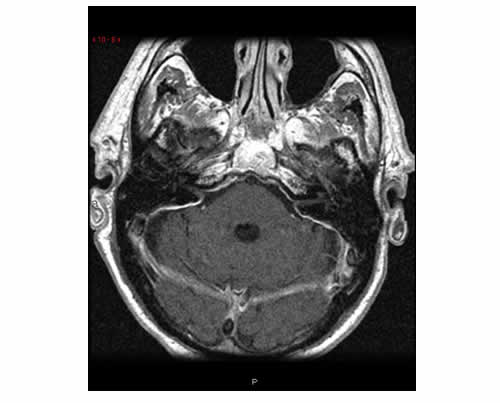
Un hombre de 68 años concurrió a la consulta por episodios recurrentes de vértigo, inestabilidad en la marcha, acúfenos bilaterales y pérdida de audición bilateral progresiva. También se quejaba de cefaleas crónicas refractarias al tratamiento analgésico. La historia clínica registraba antecedentes de hipertensión arterial leve y un episodio de diplopía transitoria y visión borrosa en el ojo derecho a los 53 años. Siete años después, a los 60 años, sufrió un cuadro de cefalea difusa asociada con dolor retroorbitario y ceguera monocular progresiva del lado izquierdo, con diagnóstico de neuropatía óptica. La audiometría de tonos puros mostró una pérdida auditiva neurosensitiva bilateral con pendiente hacia abajo. La ABR era normal; el examen vestibular mostró una paresia canalicular bilateral completa. El examen neurológico reveló marcha atáxica y ligera paresia del nervio motor ocular externo derecho. La RM de cerebro presentó un engrosamiento difuso de la duramadre intracraneal con un máximo de engrosamiento alrededor del hemisferio parietal izquierdo (Figura 3).
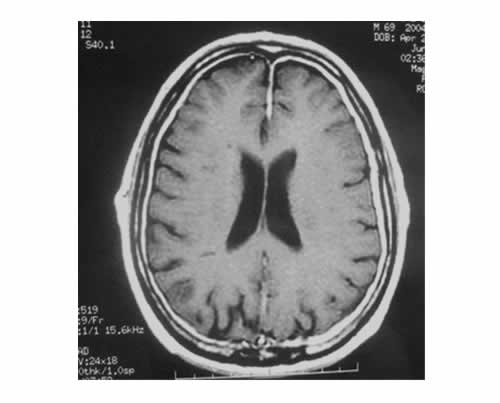
Además, los canales auditivos internos estaban ocupados por una extensión de la duramadre engrosada, por lo que los nervios facial y auditivo no eran visibles (Figura 4).
Implante coclear en el síndrome de Cogan. En nuestra serie de 500 pacientes adultos que recibieron un implante coclear en los últimos 10 años, 3 se habían vuelto sordos debido al síndrome de Cogan (0.6%). En 4 oídos, la matriz de electrodos fue insertada sin complicaciones en la escala timpánica en dirección posterolateral a través del receso facial, mientras que, en un oído, la inserción requirió una extensión mediante perforación de la porción basal del meato auditivo externo, lo que permitió la posterior introducción de todos los electrodos en la escala vestibular.
En un caso, se produjo osificación coclear luego del implante, y de los 22 electrodos de la matriz, 4 fallaron progresivamente y otros 6 debieron apagarse debido a la generación de sensaciones dolorosas agregadas en los estímulos de alta intensidad. Por lo tanto, luego de un buen resultado inicial a los 3 meses, que se correlacionó con la categoría más alta, la habilidad de percepción del discurso empeoró a identificación de palabras en ambiente cerrado al año posimplante y permaneció sin cambios luego de un seguimiento de 11 años.
El segundo paciente alcanzó el reconocimiento de palabras en ambiente abierto (90%) a los 3 meses posimplante, aunque, a los 18 meses, se quejó de una reducción abrupta del volumen con el implante derecho, que requirió un incremento del estímulo eléctrico. Asimismo, a los 30 meses posimplante, no se observó una variación significativa en la impedancia eléctrica en ninguno de los electrodos de ambos implantes, y continuaron los buenos resultados funcionales.
El tercer paciente alcanzó la categoría de identificación, aunque la impedancia eléctrica y el umbral asistido persistieron dentro de valores aceptables. Probablemente, el beneficio limitado obtenido en este último sujeto se deba a una falta de sincronía auditiva, consecuencia típica del síndrome de Cogan, o a factores cognitivos y psicológicos que interfieren con el proceso auditivo.
Conclusión
La fibrosis y la osificación coclear constituyen un desafío en el síndrome de Cogan: aun cuando un rápido implante coclear permite la inserción de una matriz de electrodos completa y regular, los buenos resultados iniciales pueden verse limitados por un progresivo incremento en la impedancia eléctrica de alguna porción de la matriz. Por lo tanto, en algunos casos, los buenos resultados perceptivos pueden deteriorarse en el período posimplante. No obstante, a pesar de la necesidad de estrategias de colocación específicas y de la aparición de complicaciones o estimulación del nervio facial, las mejorías obtenidas en las pruebas de discriminación del discurso avalan el uso del implante coclear en pacientes con este síndrome.
�
|
 Bibliografía del artículo
Bibliografía del artículo
1. Joannovic D. Zur Wirkung fermentativ gewonner spaltungsprodukte aus Geweben und Bakterien. Wein Klin Wschr 70:1410-11, 1920.
2. Masugi M, Tomizuka Y. Über die spezifisch zytotoxischen Veränderungen der Niere und sehr Leber durch das spezifische Antiserum (Nephrotoxin und Hepatoxin). Trans Jap Pathol 21:329-41, 1931.
3. Lehnhardt E. Plotzliche horstorungen auf beiden seiten gleichzeitig oder nacheinander aufgetreten. Z Laryngol Rhinol Otol 37:1, 1958.
4. Kikuchi m. On the "sympathetic otitis" Zibi Rinsyo Kyoto 52:600, 1959.
5. Beickert V. Zur Frage der empfindungs Schwerhörigkeit under Autoallergie. Z Laryngol Rhinol Otol 40:837-42, 1961.
6. Terayama Y, Sasaki U. Studies on experimental allergic (isoimmune) labyrinthitis in guinea pigs. Acta Oto-Laryngol 58:49-64, 1964.
7. Schiff M, Brown B. Hormones and sudden deafness. Laryngoscope 84:1959-81, 1974.
8. Quick C. Antigenic cause of hearing loss. Otolaryngol Clin North Am 8:385, 1975.
9. Arnold W, Weidaueer H, Seelig H. Experimentellerbeweiß einer gemeinsamen Anti-genizitat zwischen Innenohr und Niere. Arch Otorhinolaryngol 212:99, 1976.
10. Cody D, Williams H. Cogan's syndrome. Laryngoscope 70:447-78, 1960.
11. McCabe, B. Autoimmune Sensorineural Hearing Loss. Ann Otol 88:585-589, 1979.
12. Yoo TJ, Yazawa Y. Immunology of cochlear and vestibular disorders. In: L.Luxon, JM Furman, A. Martini, D.Stephens (Eds). Audiological Medicine: Clinical Aspect of Hearing and Balance. London: Martin Dunitz - Taylor & Francis Group; 2003. pp. 61-87.
13. Gloddek B, Arnold W. Clinical and Experimental Studies of Autoimmune Inner Ear Disease. Acta Otolaryngol Suppl 548:10-14, 2002.
14. Bernstein JM, Shanahan TC, Schaffer FM. Further observations on the role of the MHC genes and certain hearing disorders. Acta Otolaryngol 116(5):666-71, 1996.
15. Hughes G, Kinney S, Barna B, Calabrese L, Hamid M. Autoimmune reactivity in Menière's disease: preliminary report. Laryngoscope 43:410-17, 1983.
16. García-Berrocal JR, Trinidad A, Ramírez-Camacho R, Lobo D, Verdaguer M, Ibáñez A. Immunologic work-up study for inner ear disorders: looking for a rational strategy. Acta Otolaryngol 125(8):814-8, 2005.
17. Yeom K, Gray J, Nair TS, Arts HA, Telian SA, Disher MJ, et al. Antibodies to HSP-70 in normal donors and autoimmune hearing loss patients. Laryngoscope 113:1770-1776, 2003.
18. Nair TS, Kozma KE, Hoefling NL et al. Identification and characterization of choline transporter-like protein 2, an inner ear glycoprotein of 68 and 72 kDa that is the target of antibody-induced hearing loss. J Neurosc 24:1772-1779, 2004.
19. Bovo R, Aimoni C, Martini A. Immune-mediated inner ear disease. Acta Otolaryngol 126:1012-1021, 2006.
20. Sajjadi H, Paparella MM. Meniere's disease. Lancet 372(9636):406-14, 2008.
21. Kamei T, Noro H, Yabe K, Makino S. Statistical observation of unilateral total deafness and characteristics of unilateral total deafness among young children with tendency toward dizziness. Jibiinkoka 43(5):349-58, 1971.
22. Wolfson RJ, Leiberman A. Unilateral deafness with subsequent vertigo. Laryngoscope 85(10):1762-6, 1975.
23. Nadol JB Jr, Weiss AD, Parker SW. Vertigo of delayed onset after sudden deafness. Ann Otol Rhinol Laryngol 84(6):841-6, 1975.
24. Kubo T, Yamamoto K, Iwaki T, Doi K, Tamura M. Different forms of dizziness occurring after cochlear implant. Eur Arch Otorhinolaryngol 258(1):9-12, 2001.
25. Fina M, Skinner M, Goebel JA, Piccirillo JF, Neely JG, Black O. Vestibular dysfunction after cochlear implantation. Otol Neurotol 24(2):234-42, 2003.
26. Suzuki M, Hanamitsu M, Kitanishi T, Kohzaki H, Kitano H. Autoantibodies against inner ear proteins in patients with and unilateral juvenile deafness. Acta Otolaryngol 126(2):117-21, 2006.
27. Giannoni B, Pagnini P, Vannucchi P. Delayed endolymphatic hydrops. Acta Otorhinolaryngol Ital 18(4 Suppl 59):66-70, 1998.
28. Kamei T Delayed endolymphatic hydrops as a clinical entity. Int Tinnitus J 10(2):137-43, 2004.
29. Dodson KM, Kamei T, Sismanis A, Nance WE. Familial unilateral deafness and delayed endolymphatic hydrops. Am J Med Genetic 143A:1661-1665, 2007.
30. Rinne T, Bronstein AM, Rudge P, Gresty MA, Luxon LM. Bilateral loss of vestibular function. Acta Otolaryngol Suppl 520:247-50, 1995.
31. Zingler VC, Cnyrim C, Jahn K, Weintz E, Fernbacher J, Frenzel C et al. Causative factors and epidemiology of bilateral vestibulopathy in 255 patients. Ann Neurol 61(6):524-32, 2007.
32. Haynes BF, Kaiser-Kupfer MI, Mason P, Fauci AS. Cogan syndrome: studies in thirteen patients, long-term follow-up, and a review of the literature. Medicine (Baltimore) 59:426-441, 1980.
33. Schuknecht HF, Nadol JB Jr. Temporal bone pathology in a case of Cogan's syndrome. Laryngoscope 104:1135-1142, 1994.
34. Knapp A. Retinal Periphlebitis in the Course of Acute Exudative Choroiditis. Trans Am Ophthalmol Soc 39:86-93, 1941.
35. Gemignani G, Berrettini S, Bruschini P, Sellari-Franceschini S, Fusari P, Piragine F et al. Hearing and vestibular disturbances in Behçet's syndrome. Ann Otol Rhinol Laryngol 100:459-463, 1991.
36. Akman-Demir G, Serdaroglu P, Tasci B. Clinical patterns of neurological involvement in Behçet's disease: evaluation of 200 patients. The Neuro-Behçet Study Group. Brain 122:2171-2182, 1999.
37. Pollak L, Luxon LM, Haskard DO. Labyrinthine involvement in Behçet's syndrome. J Laryngol Otol 115:522-529, 2001.
38. Kulahli I, Balci K, Koseoglu E, Yuce I, Cagli S, Senturk M. Audio-vestibular disturbances in Behçet's patients: report of 62 cases. Hear Res 203:28-31, 2005.
39. Kocer N, Islak C, Siva A, Saip S, Akman C, Kantarci O, et al. CNS involvement in neuro-Behçet syndrome: an MR study. Am J Neuroradiol 20:1015-1024, 1999.
40. Hatachi S, Nakazawa T, Morinobu A, Kasagi S, Kogata Y, Kageyama G et al. A pediatric patient with neuro-Behçet's disease. Mod Rheumatol 16:321-323, 2006.
41. Lee H, Yi HA, Lee SR, Nam SI, Lee J. An unusual case of neuro-Behcet's disease presenting with reversible basilar artery occlusion. Neurological Sciences 27:70-73, 2006.
42. Gan J, Zheng HB, Xi J, Zhou D, Shang HF, Lai XH. A case of neuro-vasculo-Behcet disease Eur J Neurol 14:16-7, 2007.
43. Yoshimoto Y. Otoneurological observation and classification of Harada's disease presenting with aural symptoms, especially vertigo. Acta Otolaryngol Suppl 519:114-117, 1995.
44. Tahara T, Sekitani T. Neurotological evaluation of Harada's disease. Acta Otolaryngol Suppl 519:110-113, 1995.
45. Ondrey FG, Moldestad E, Mastroianni MA et al. Sensorineural hearing loss in Vogt-Koyanagi-Harada syndrome. Laryngoscope 116:1873-1876, 2006.
46. Scaravilli F. The pathology of the vestibular system In: L.Luxon, JM Furman, A. Martini, D.Stephens, eds. Audiological Medicine: Clinical Aspect of Hearing and Balance. London: Martin Dunitz - Taylor & Francis Group; 2003. pp. 648-649.
47. Gross M, Banin E, Eliashar R, Ben-Hur T. Susac syndrome. Otol Neurotol 2004; 25:470-473.
48. Gulya AJ. Neurologic paraneoplastic syndromes with neurotologic manifestations. Laryngoscope 103:754-761, 1993.
49. Bovo R, Berto A, Palma S, Ceruti S, Martini A. Symmetric sensorineural progressive hearing loss from chronic idiopathic pachymeningitis. Int J Audiol 46:107-110, 2007.
50. Agrup C. Immune-mediated audiovestibular disorders in the paediatric population: a review. Int J Audiol 47(9):560-5, 2008.
51. Rauch SD. Intratympanic steroids for sensorineural hearing loss. Otolaryng Clin of Nor Am 37:1061-74, 2004.
52. Alles MJ, der Gaag MA, Stokroos RJ. Intratympanic steroid therapy for inner ear diseases, a review of the literature. Eur Arch Oto-Rhino-Lyryngol 263(9):791-7, 2006.
53. Sismanis A, Thompson T, Willis HE. Methotrexate therapy for autoimmune hearing loss: a preliminary report. Laryngoscope 104:932-934, 1994.
54. Sismanis A, Wise CM, Johnson GD. Methotrexate management of immune-mediated cochleovestibular disorders. Otolaryngol HNS 116:146-52, 1997.
55. Ruckenstein MJ. Autoimmune inner ear disease. Curr Op Otolaryngol Head & Neck Surg 12(5):426-30, 2004.
56. Luetje CM, Berliner KI. Plasmaphereis in autoimmune inner ear disease: long-term follow-up. Am J Otol 18:572-576, 1997.
57. Nakagawa T. Ito J. Application of cell therapy to inner ear diseases. Acta Oto-Laryngol Suppl 551:6-9, 2004.
58. Pau H, Clarke RW. Advances in genetic manipulations in the treatment of hearing disorders. Clin Otolaryngol Allied Sci 29(6):574-6, 2004.
59. Wang, Y., Fuh, J., Limg, J., Lu, S., Wang, S. Headache Profile in Patients With Idiopathic Cranial Pachymeningitis. Headache 44:916-923, 2004.
60. Oghalai, J., Ramirez, A., Hegarty, J., Jackler, R. Chronic Pachymeningitis Presenting as Asymmetric Sensorineural Hearing Loss. Otol Neurotol 25:616-621, 2004.
61. Bovo R, Berto A, Palma S, Ceruti S, Martini A. Symmetric sensorineural progressive hearing loss from chronic idiopathic pachymeningitis. Int J Audiol 46(2):107-10, 2007.
62. Bovo R, Ciorba A, Trevisi P, Aimoni C, Cappiello L, Castiglione A et al. Cochlear implant in Cogan syndrome. Acta Otolaryngol 131:494-7, 2011.
|
|









































