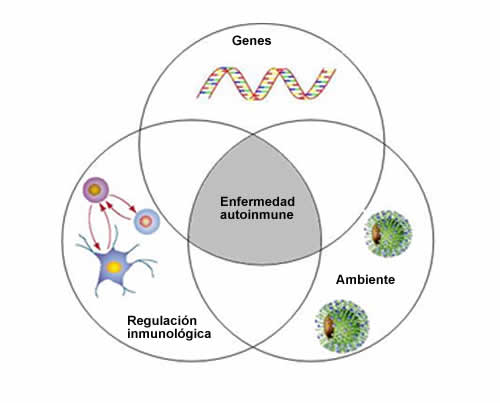
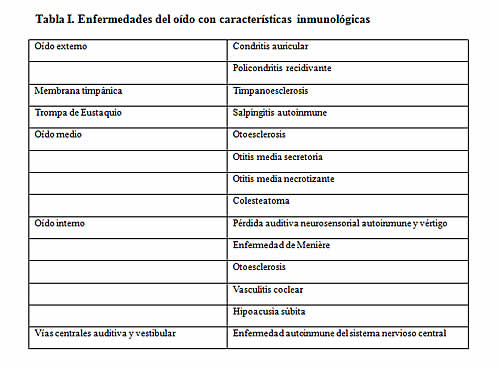
Bibliografía del artículo
Bibliografía del artículo
1. Joannovic D. Zur Wirkung fermentativ gewonner spaltungsprodukte aus Geweben und Bakterien. Wein Klin Wschr 70:1410-11, 1920.
2. Masugi M, Tomizuka Y. Über die spezifisch zytotoxischen Veränderungen der Niere und sehr Leber durch das spezifische Antiserum (Nephrotoxin und Hepatoxin). Trans Jap Pathol 21:329-41, 1931.
3. Lehnhardt E. Plotzliche horstorungen auf beiden seiten gleichzeitig oder nacheinander aufgetreten. Z Laryngol Rhinol Otol 37:1, 1958.
4. Kikuchi m. On the "sympathetic otitis" Zibi Rinsyo Kyoto 52:600, 1959.
5. Beickert V. Zur Frage der empfindungs Schwerhörigkeit under Autoallergie. Z Laryngol Rhinol Otol 40:837-42, 1961.
6. Terayama Y, Sasaki U. Studies on experimental allergic (isoimmune) labyrinthitis in guinea pigs. Acta Oto-Laryngol 58:49-64, 1964.
7. Schiff M, Brown B. Hormones and sudden deafness. Laryngoscope 84:1959-81, 1974.
8. Quick C. Antigenic cause of hearing loss. Otolaryngol Clin North Am 8:385, 1975.
9. Arnold W, Weidaueer H, Seelig H. Experimentellerbeweiß einer gemeinsamen Anti-genizitat zwischen Innenohr und Niere. Arch Otorhinolaryngol 212:99, 1976.
10. Cody D, Williams H. Cogan's syndrome. Laryngoscope 70:447-78, 1960.
11. McCabe, B. Autoimmune Sensorineural Hearing Loss. Ann Otol 88:585-589, 1979.
12. Yoo TJ, Yazawa Y. Immunology of cochlear and vestibular disorders. In: L.Luxon, JM Furman, A. Martini, D.Stephens (Eds). Audiological Medicine: Clinical Aspect of Hearing and Balance. London: Martin Dunitz - Taylor & Francis Group; 2003. pp. 61-87.
13. Gloddek B, Arnold W. Clinical and Experimental Studies of Autoimmune Inner Ear Disease. Acta Otolaryngol Suppl 548:10-14, 2002.
14. Bernstein JM, Shanahan TC, Schaffer FM. Further observations on the role of the MHC genes and certain hearing disorders. Acta Otolaryngol 116(5):666-71, 1996.
15. Hughes G, Kinney S, Barna B, Calabrese L, Hamid M. Autoimmune reactivity in Menière's disease: preliminary report. Laryngoscope 43:410-17, 1983.
16. García-Berrocal JR, Trinidad A, Ramírez-Camacho R, Lobo D, Verdaguer M, Ibáñez A. Immunologic work-up study for inner ear disorders: looking for a rational strategy. Acta Otolaryngol 125(8):814-8, 2005.
17. Yeom K, Gray J, Nair TS, Arts HA, Telian SA, Disher MJ, et al. Antibodies to HSP-70 in normal donors and autoimmune hearing loss patients. Laryngoscope 113:1770-1776, 2003.
18. Nair TS, Kozma KE, Hoefling NL et al. Identification and characterization of choline transporter-like protein 2, an inner ear glycoprotein of 68 and 72 kDa that is the target of antibody-induced hearing loss. J Neurosc 24:1772-1779, 2004.
19. Bovo R, Aimoni C, Martini A. Immune-mediated inner ear disease. Acta Otolaryngol 126:1012-1021, 2006.
20. Sajjadi H, Paparella MM. Meniere's disease. Lancet 372(9636):406-14, 2008.
21. Kamei T, Noro H, Yabe K, Makino S. Statistical observation of unilateral total deafness and characteristics of unilateral total deafness among young children with tendency toward dizziness. Jibiinkoka 43(5):349-58, 1971.
22. Wolfson RJ, Leiberman A. Unilateral deafness with subsequent vertigo. Laryngoscope 85(10):1762-6, 1975.
23. Nadol JB Jr, Weiss AD, Parker SW. Vertigo of delayed onset after sudden deafness. Ann Otol Rhinol Laryngol 84(6):841-6, 1975.
24. Kubo T, Yamamoto K, Iwaki T, Doi K, Tamura M. Different forms of dizziness occurring after cochlear implant. Eur Arch Otorhinolaryngol 258(1):9-12, 2001.
25. Fina M, Skinner M, Goebel JA, Piccirillo JF, Neely JG, Black O. Vestibular dysfunction after cochlear implantation. Otol Neurotol 24(2):234-42, 2003.
26. Suzuki M, Hanamitsu M, Kitanishi T, Kohzaki H, Kitano H. Autoantibodies against inner ear proteins in patients with and unilateral juvenile deafness. Acta Otolaryngol 126(2):117-21, 2006.
27. Giannoni B, Pagnini P, Vannucchi P. Delayed endolymphatic hydrops. Acta Otorhinolaryngol Ital 18(4 Suppl 59):66-70, 1998.
28. Kamei T Delayed endolymphatic hydrops as a clinical entity. Int Tinnitus J 10(2):137-43, 2004.
29. Dodson KM, Kamei T, Sismanis A, Nance WE. Familial unilateral deafness and delayed endolymphatic hydrops. Am J Med Genetic 143A:1661-1665, 2007.
30. Rinne T, Bronstein AM, Rudge P, Gresty MA, Luxon LM. Bilateral loss of vestibular function. Acta Otolaryngol Suppl 520:247-50, 1995.
31. Zingler VC, Cnyrim C, Jahn K, Weintz E, Fernbacher J, Frenzel C et al. Causative factors and epidemiology of bilateral vestibulopathy in 255 patients. Ann Neurol 61(6):524-32, 2007.
32. Haynes BF, Kaiser-Kupfer MI, Mason P, Fauci AS. Cogan syndrome: studies in thirteen patients, long-term follow-up, and a review of the literature. Medicine (Baltimore) 59:426-441, 1980.
33. Schuknecht HF, Nadol JB Jr. Temporal bone pathology in a case of Cogan's syndrome. Laryngoscope 104:1135-1142, 1994.
34. Knapp A. Retinal Periphlebitis in the Course of Acute Exudative Choroiditis. Trans Am Ophthalmol Soc 39:86-93, 1941.
35. Gemignani G, Berrettini S, Bruschini P, Sellari-Franceschini S, Fusari P, Piragine F et al. Hearing and vestibular disturbances in Behçet's syndrome. Ann Otol Rhinol Laryngol 100:459-463, 1991.
36. Akman-Demir G, Serdaroglu P, Tasci B. Clinical patterns of neurological involvement in Behçet's disease: evaluation of 200 patients. The Neuro-Behçet Study Group. Brain 122:2171-2182, 1999.
37. Pollak L, Luxon LM, Haskard DO. Labyrinthine involvement in Behçet's syndrome. J Laryngol Otol 115:522-529, 2001.
38. Kulahli I, Balci K, Koseoglu E, Yuce I, Cagli S, Senturk M. Audio-vestibular disturbances in Behçet's patients: report of 62 cases. Hear Res 203:28-31, 2005.
39. Kocer N, Islak C, Siva A, Saip S, Akman C, Kantarci O, et al. CNS involvement in neuro-Behçet syndrome: an MR study. Am J Neuroradiol 20:1015-1024, 1999.
40. Hatachi S, Nakazawa T, Morinobu A, Kasagi S, Kogata Y, Kageyama G et al. A pediatric patient with neuro-Behçet's disease. Mod Rheumatol 16:321-323, 2006.
41. Lee H, Yi HA, Lee SR, Nam SI, Lee J. An unusual case of neuro-Behcet's disease presenting with reversible basilar artery occlusion. Neurological Sciences 27:70-73, 2006.
42. Gan J, Zheng HB, Xi J, Zhou D, Shang HF, Lai XH. A case of neuro-vasculo-Behcet disease Eur J Neurol 14:16-7, 2007.
43. Yoshimoto Y. Otoneurological observation and classification of Harada's disease presenting with aural symptoms, especially vertigo. Acta Otolaryngol Suppl 519:114-117, 1995.
44. Tahara T, Sekitani T. Neurotological evaluation of Harada's disease. Acta Otolaryngol Suppl 519:110-113, 1995.
45. Ondrey FG, Moldestad E, Mastroianni MA et al. Sensorineural hearing loss in Vogt-Koyanagi-Harada syndrome. Laryngoscope 116:1873-1876, 2006.
46. Scaravilli F. The pathology of the vestibular system In: L.Luxon, JM Furman, A. Martini, D.Stephens, eds. Audiological Medicine: Clinical Aspect of Hearing and Balance. London: Martin Dunitz - Taylor & Francis Group; 2003. pp. 648-649.
47. Gross M, Banin E, Eliashar R, Ben-Hur T. Susac syndrome. Otol Neurotol 2004; 25:470-473.
48. Gulya AJ. Neurologic paraneoplastic syndromes with neurotologic manifestations. Laryngoscope 103:754-761, 1993.
49. Bovo R, Berto A, Palma S, Ceruti S, Martini A. Symmetric sensorineural progressive hearing loss from chronic idiopathic pachymeningitis. Int J Audiol 46:107-110, 2007.
50. Agrup C. Immune-mediated audiovestibular disorders in the paediatric population: a review. Int J Audiol 47(9):560-5, 2008.
51. Rauch SD. Intratympanic steroids for sensorineural hearing loss. Otolaryng Clin of Nor Am 37:1061-74, 2004.
52. Alles MJ, der Gaag MA, Stokroos RJ. Intratympanic steroid therapy for inner ear diseases, a review of the literature. Eur Arch Oto-Rhino-Lyryngol 263(9):791-7, 2006.
53. Sismanis A, Thompson T, Willis HE. Methotrexate therapy for autoimmune hearing loss: a preliminary report. Laryngoscope 104:932-934, 1994.
54. Sismanis A, Wise CM, Johnson GD. Methotrexate management of immune-mediated cochleovestibular disorders. Otolaryngol HNS 116:146-52, 1997.
55. Ruckenstein MJ. Autoimmune inner ear disease. Curr Op Otolaryngol Head & Neck Surg 12(5):426-30, 2004.
56. Luetje CM, Berliner KI. Plasmaphereis in autoimmune inner ear disease: long-term follow-up. Am J Otol 18:572-576, 1997.
57. Nakagawa T. Ito J. Application of cell therapy to inner ear diseases. Acta Oto-Laryngol Suppl 551:6-9, 2004.
58. Pau H, Clarke RW. Advances in genetic manipulations in the treatment of hearing disorders. Clin Otolaryngol Allied Sci 29(6):574-6, 2004.
59. Wang, Y., Fuh, J., Limg, J., Lu, S., Wang, S. Headache Profile in Patients With Idiopathic Cranial Pachymeningitis. Headache 44:916-923, 2004.
60. Oghalai, J., Ramirez, A., Hegarty, J., Jackler, R. Chronic Pachymeningitis Presenting as Asymmetric Sensorineural Hearing Loss. Otol Neurotol 25:616-621, 2004.
61. Bovo R, Berto A, Palma S, Ceruti S, Martini A. Symmetric sensorineural progressive hearing loss from chronic idiopathic pachymeningitis. Int J Audiol 46(2):107-10, 2007.
62. Bovo R, Ciorba A, Trevisi P, Aimoni C, Cappiello L, Castiglione A et al. Cochlear implant in Cogan syndrome. Acta Otolaryngol 131:494-7, 2011.




 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: