Bibliografía del artículo
Bibliografía del artículo
1. Deutsch JA, Young WG, Kalogern TJ. The stomach signals satiety. Science 201:165-167, 1978.
2. Schick RR, Schusdziarra V, Schröder B, Classen M. Effect of intraduodenal or intragastric nutrient infusion on food intake in humans. Z Gastroenterol 29:637-641, 1991.
3. Welch IM, Sepple CP, Read NW. Comparisons of the effects on satiety and eating behaviour of infusion of lipid into the different regions of the small intestine. Gut 29:306-311, 1988.
4. Drewe J, Gadient A, Rovati LC, Beglinger C. Role of circulating cholecystokinin in control of fat-induced inhibition of food intake in humans. Gastroenterology 102:1654-1659, 1992.
5. Hunt JN, Stubbs RJ. The volume and energy content of meals as determinants of gastric emptying. J Physiol 245:209-225, 1975.
6. McHugh PR, Moran TH. Calories and gastric emptying: a regulatory capacity with implications for feeding. Am J Physiol 236:R254-R260, 1979.
7. Oesch S, Degen L, Beglinger C. Effect of a protein preload on food intake and satiety feelings in response to duodenal fat perfusions in healthy male subjects. Am J Physiol Regul Integr Comp Physiol 289:R1042-R1047, 2005.
8. Geliebter A, Westreich S, Gage D. Gastric distention by balloon and test-meal intake in obese and lean subjects. Am J Clin Nutr 48:592-594, 1988.
9. Schick RR, Schusdziarra V. Regulation of food intake. In: Ditschuneit H, Gries FA, Hauner H, Schusdziarra V, Wechsler JG, editors. Obesity in Europe 1993. London: John Libbey, pp. 335-348, 1994.
10. Rolls BJ, Bell EA, Thorwart ML. Water incorporated into a food but not served with a food decreases energy intake in lean women. Am J Clin Nutr 70:448-455, 1999.
11. Rolls BJ, Roe LS. Effect of the volume of liquid food infused intragastrically on satiety in women. Physiol Behav 76:623-631, 2002.
12. Van Stratum P, Lussenburg RN, van Wezel LA, Vergroesen AJ, Cremer HD. The effect of dietary carbohydrate:fat ratio on energy intake by adult women. Am J Clin Nutr 31:206-212, 1978.
13. Stubbs RJ, van Wyk MC, Johnstone AM, Harbron CG. Breakfasts high in protein, fat or carbohydrate: effect on within-day appetite and energy balance. Eur J Clin Nutr 50:409-417, 1996.
14. Porrini M, Crovetti R, Testolin G, Silva S. Evaluation of satiety sensations and food intake after different preloads. Appetite 25:17-30, 1995.
15. Erdmann J, Töpsch R, Lippl F, Gussmann P, Schusdziarra V. Postprandial response of plasma ghrelin levels to various test meals in relation to food intake, plasma insulin and glucose. J Clin Endocrinol Metab 89:3048-3054, 2004.
16. Erdmann J, Leibl M, Wagenpfeil S, Lippl F, Schusdziarra V. Ghrelin response to protein and carbohydrate meals in relation to food intake and glycerol levels in obese subjects. Regul Pept 135:23-29, 2006.
17. Holt SH, Miller JC, Petocz P, Farmakalidis E. A satiety index of common foods. Eur J Clin Nutr 49:675-690, 1995.
18. Rolls BJ, Kim S, McNelis AL, Fischman MW, Foltin RW, Moran TH. Time course of effects of preloads high in fat or carbohydrate on food intake and hunger ratings in humans. Am J Physiol 260:R756-R763, 1991.
19. Vozzo R, Wittert G, Cocchiaro C et al. Similar effects of foods high in protein, carbohydrate and fat on subsequent spontaneous food intake in healthy individuals. Appetite 40:101-107, 2003.
20. De Graaf C, Hulshof T, Weststrate JA, Jas P. Short-term effects of different amounts of protein, fats, and carbohydrates on satiety. Am J Clin Nutr 55:33-38, 1992.
21. Driver CJ. The effect of meal composition on the degree of satiation following a test meal and possible mechanisms involved. Br J Nutr 60:441-449, 1988.
22. Hill AJ, Blundell JE. Macronutrients and satiety: the effects of a high-protein or high carbohydrate meal on subjective motivation to eat and food preferences. Nutr Behaviour 3:133-144, 1986.
23. Poppitt SD, McCormack D, Buffenstein R. Short-term effects of macronutrient preloads on appetite and energy intake in lean women. Physiol Behav 64(3):279-285, 1998.
24. Geliebter AA. Effects of equicaloric loads of protein, fat, and carbohydrate on food intake in the rat and man. Physiol Behav 22:267-273, 1979.
25. Stubbs RJ, Johnstone AM, O'Reilly LM, Barton K, Reid C. The effect of covertly manipulating the energy density of mixed diets on ad libitum food intake in 'pseudo free-living' humans. Int J Obes Relat Metab Disord 22:980-987, 1998.
26. Stubbs RJ, Ritz P, Coward WA, Prentice AM. Covert manipulation of the ratio of dietary fat to carbohydrate and energy density: effect on food intake and energy balance in free-living men eating ad libitum. Am J Clin Nutr 62:330-337, 1995.
27. Poppitt SD, Prentice AM. Energy density and its role in the control of food intake: evidence from metabolic and community studies. Appetite 26:153-174, 1996.
28. Rolls BJ, Bell EA. Intake of fat and carbohydrate: role of energy density. Eur J Clin Nutr 53(Suppl 1):S166-S173, 1999.
29. Bell EA, Rolls BJ. Energy density of foods affects energy intake across multiple levels of fat content in lean and obese women. Am J Clin Nutr 73:1010-1018, 2001.
30. Duncan KH, Bacon JA, Weinsier RL. The effects of high and low energy density diets on satiety, energy intake, and eating time of obese and nonobese subjects. Am J Clin Nutr 37:763-767, 1983.
31. Campbell RG, Hashim SA, Van Itallie TB. Studies of food intake regulation in man: responses to variations in nutritive density in lean and obese subjects. N Engl J Med 285:1402-1407, 1971.
32. Kral TV, Roe LS, Rolls BJ. Combined effects of energy density and portion size on energy intake in women. Am J Clin Nutr 79:962-968, 2004.
33. Malagelada JR. Quantification of gastric solid-liquid discrimination during digestion of ordinary meals. Gastroenterology 72:1264-1267, 1977.
34. Mattes RD. Dietary compensation by humans for supplemental energy provided as ethanol or carbohydrate in fluids. Physiol Behav 59:179-187, 1996.
35. Gonzalez MF, Deutsch JA. Vagotomy abolishes cues of satiety produced by gastric distension. Science 212:1283-1284, 1978.
36. Schick RR, Reilly WM, Yasksh TL, Roddy DR, Go VLW. Neuronal cholecystokinin-like immunoreactivity is postprandially released from primate hypothalamus. Brain Res 418:20-26, 1987.
37. Schick RR, Yaksh TL, Roddy DR, Go VL. Release of hypothalamic cholecystokinin in cats: effects of nutrient and volume loading. Am J Physiol 256:R248-R254, 1989.
38. Davis JD, Gallagher RJ, Ladove RF. Food intake controlled by a blood factor. Science 157:1247-1248, 1967.
39. Koopmans HS. A stomach hormone that inhibits food intake. J Auton Nerv System 9:157-171, 1983.
40. Schick RR, Schusdziarra V, Mössner J et al. Effect of CCK on food intake in man: physiological or pharmacological effect? Z Gastroenterol 29:53-58, 1991.
41. Pi-Sunyer X, Kissileff HR, Thornton J, Smith GP. C-terminal octapeptide of cholecystokinin decreases food intake in obese men. Physiol Behav 29:627-630, 1982.
42. Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 101:515-520, 1998.
43. Long SJ, Sutton JA, Amaee WB et al. No effect of glucagon-like peptide-1 on short-term satiety and energy intake in man. Br J Nutr 81:273-279, 1999.
44. Cohen MA, Ellis SM, Le RC et al. Oxyntomodulin suppresses appetite and reduces food intake in humans. J Clin Endocrinol Metab 88:4696-4701, 2003.
45. Batterham RL, Cohen MA, Ellis SM et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med 349:941-948, 2003.
46. Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 402:656-660, 1999.
47. Tschop M, Smiley DL, Heiman ML. Ghrelin induces adiposity in rodents. Nature 407:908-913, 2000.
48. Wren AM, Small CJ, Ward HL et al. The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion. Endocrinology 141:4325-4328, 2000.
49. Nakazato M, Murakami N, Date Y et al. A role for ghrelin in the central regulation of feeding. Nature 409:194-198, 2001.
50. Wren AM, Seal LJ, Cohen JA et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab 86:5992-5995, 2001.
51. Cummings DE, Purnell JQ, Frayo RS, Schmidova K, Wisse BE, Weigle DS. A preprandial rise in plasma ghrelin levels suggests a role in meal initiation in humans. Diabetes 50:1714-1719, 2001.
52. Tschop M, Wawarta R, Riepl RL et al. Post-prandial decrease of circulating human ghrelin levels. J Endocrinol Invest 24:RC19-RC21, 2001.
53. Erdmann J, Lippl F, Schusdziarra V. Differential effect of protein and fat on plasma ghrelin levels in man. Regul Pept 116:101-107, 2003.
54. Cummings DE, Frayo RS, Marmonier C, Aubert R, Chapelot D. Plasma ghrelin levels and hunger scores in humans initiating meals voluntarily without time- and food-related cues. Am J Physiol Endocrinol Metab 287:E297-E304, 2004.
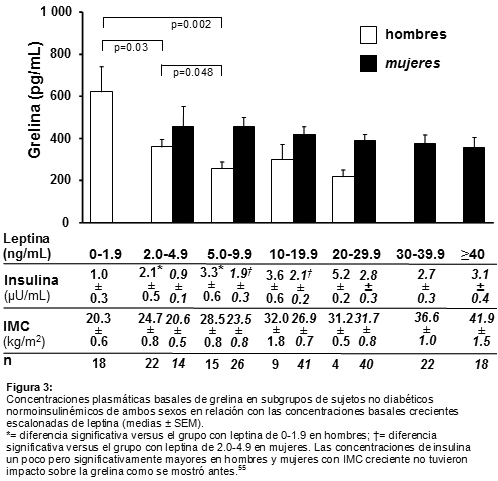
55. Erdmann J, Lippl F, Wagenpfeil S, Schusdziarra V. Differential association of basal and postprandial plasma ghrelin with leptin, insulin, and type 2 diabetes. Diabetes 54:1371-1378, 2005.
56. Asakawa A, Inui A, Kaga T et al. Antagonism of ghrelin receptor reduces food intake and body weight gain in mice. Gut 52:947-952, 2003.
57. Sun Y, Ahmed S, Smith RG. Deletion of ghrelin impairs neither growth nor appetite. Mol Cell Biol 23:7973-7981, 2003.
58. Wortley KE, Anderson KD, Garcia K et al. Genetic deletion of ghrelin does not decrease food intake but influences metabolic fuel preference. Proc Natl Acad Sci USA 101:8227-8232, 2004.
59. Wortley KE, Del Rincon JP, Murray JD et al. Absence of ghrelin protects against early-onset obesity. J Clin Invest 115:3573-3578, 2005.
60. Zigman JM, Nakano Y, Coppari R et al. Mice lacking ghrelin receptors resist the development of diet-induced obesity. J Clin Invest 115:3564-3572, 2005.
61. Tschop M, Weyer C, Tataranni PA, Devanarayan V, Ravussin E, Heiman ML. Circulating ghrelin levels are decreased in human obesity. Diabetes 50:707-709, 2001.
62. Otto B, Cuntz U, Fruehauf E et al. Weight gain decreases elevated plasma ghrelin concentrations of patients with anorexia nervosa. Eur J Endocrinol 145:669-673, 2001.
63. Saad MF, Bernaba B, Hwu CM et al. Insulin regulates plasma ghrelin concentration. J Clin Endocrinol Metab 87:3997-4000, 2002.
64. Mohlig M, Spranger J, Otto B, Ristow M, Tschop M, Pi-Sunyer F. Euglycemic hyperinsulinemia, but not lipid infusion decreases circulating ghrelin levels in humans. J Endocrinol Invest 25:RC36-RC38, 2002.
65. Lippl F, Kircher F, Erdmann J, Allescher HD, Schusdziarra V. Effect of GIP, GLP-1, insulin and gastrin on ghrelin release in the isolated rat stomach. Regul Pept 119:93-98, 2004.
66. Kamegai J, Tamura H, Shimizu S, Ishii S, Sugihara H, Oikawa S. Effects of insulin, leptin, and glucagon on ghrelin secretion from isolated perfused rat stomach. Regul Pept 119:77-81, 2004.
67. Murdolo G, Lucidi P, Di LC et al. Insulin is required for prandial ghrelin suppression in humans. Diabetes 52:2923-2927, 2003.
68. Friedman JM, Halaas J. Leptin and the regulation of body weight. Nature 395:763-770, 1998.
69. Maffei M, Halaas J, Ravussin E et al. Leptin levels in human and rodent: measurement of plasma leptin in ob RNA in obese and weight-reduced subjects. Nat Med 1:1155-1161, 1995.
70. Considine RV, Sinha MK, Heiman ML et al. Serum immunoreactive leptin concentrations in normal weight and obese humans. N Engl J Med 334:292-295, 1996.
71. Coleman DL. Obese and diabetes: two mutant genes causing diabetes-obesity syndromes in mice. Diabetologia 14:141-148, 1978.
72. Montague CT, Farrooqi IS, Whitehead JP et al. Congenital leptin deficiency is associated with severe early-onset obesity in humans. Nature 387:903-908, 1997.
73. Strobel A, Issad T, Camoin L, Ozata M, Strosberg AD. A leptin missense mutation associated with hypogonadism and morbid obesity. Nat Genet 18:213-215, 1998.
74. Wang HY, Tache Y, Sheibel AB, Go VLW, Wei JY. Two types of leptin-responsive gastric vagal afferents terminals: an in vitro single-unit study in rats. Am J Physiol 273:R833-R837, 1997.
75. Schwartz MW, Seeley RJ, Campfield LA, Burn P, Baskin BG. Identification of tagets of leptin action in rat hypothalamus. J Clin Invest 98:1101-1106, 1996.
76. Lippl F, Erdmann J, Atmatzidis S, Schusdziarra V. Direct effect of leptin on gastric ghrelin secretion. Horm Metab Res 37:123-125, 2005.
77. Huang L, Li C. Leptin: a multifunctional hormone. Cell Res 10:81-92, 2000.





 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo> Enviar correspondencia a:
Enviar correspondencia a: