 GRANULOMATOSIS
LINFOMATOIDEA EN EDAD TEMPRANA GRANULOMATOSIS
LINFOMATOIDEA EN EDAD TEMPRANA
|
|
|
Ayla Güven
Columnista Experto de SIIC
Pediatra, Departamento de Pediatría, Gazi University
Medical Faculty
Institucion:
Gazi University Medical Faculty, Zeytinburnu, Estambul,
Turquía
|
La granulomatosis linfomatoidea es
una patología poco frecuente en niños y adolescentes; los
individuos afectados presentan trastornos a nivel pulmonar, en el
SNC o en la piel. Se trata de una enfermedad con mal pronóstico,
que se agrava en los pacientes jóvenes.
La granulomatosis linfomatoidea es una forma poco conocida de
vasculitis y granulomatosis, y sus características fueron
descriptas por Liebow1,2 en 1972; en la actualidad, todavía
no se conoce su etiología. La enfermedad puede ser considerada
tanto previa como posterior a un proceso maligno; dentro del 12% de
los casos informados, algunos progresaron a linfoma, mientras que
otros ya lo padecían con anterioridad a la aparición de la
granulomatosis linfomatoidea.2 Entre las teorías sobre
su origen se incluye la presencia de linfoma de células T
polimorfas, una proliferación activa de células T posteriores al
timo, y un proceso reactivo frente a un estímulo antigénico viral.3
Esta patología se presenta principalmente en hombres adultos; la
frecuencia de aparición es baja entre niños y adolescentes. En los
estudios realizados hasta el momento, inclusive en los que contaron
con mayor número de participantes, es poco común encontrar
pacientes menores de 25 años. En los trabajos efectuados por
Katzenstein y colaboradores, 2 16 de los 152 pacientes
con esta enfermedad presentaban menos de dicha edad, mientras que en
los realizados por Beaty y colaboradores,4 se
determinaron las características clínicas y dermatológicas de 20
pacientes, y sólo 3 eran niños o adolescentes; por otro lado, en
el análisis llevado a cabo por Fauci y colaboradores,5
participaron 15 pacientes, de los que solamente 5 tenían menos de
25 años. Cabe mencionar que dentro de la literatura en idioma inglés,
el paciente mas jóven contaba con 11 meses de vida.6
En el presente trabajo evaluamos las características clínicas, las
determinaciones de laboratorio, el pronóstico y el tratamiento de
pacientes jóvenes con granulomatosis linfomatoidea informados en la
bibliografía en idioma inglés, y analizamos 16 casos en forma
detallada (tabla 1).7-23
Tabla 1
Del total de participantes, 9 eran hombres (relación hombre/mujer:
1.28/1); este índice fue similar al encontrado en pacientes adultos
(relación hombre/mujer: 1.7/1).2
Los síntomas que se encontraron con más frecuencia entre los
pacientes jóvenes fueron fiebre y tos (tabla 2).
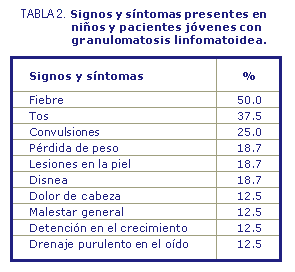
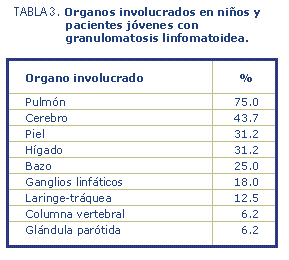
El compromiso pulmonar, característico en casi todos los pacientes
adultos, se determinó en el 75% de los jóvenes (tabla 3). El 25%
de los niños y adolescentes presentaron signos neurológicos como
convulsiones, letargo, debilidad, torpeza, ataxia, inestabilidad al
andar, parálisis de nervios craneales, pérdida de memoria y
fragilidad emocional (casos 10, 14, 15, 17).
Cinco de los participantes evidenciaron anemia (casos 2, 3, 4, 11,
12), mientras que en 3 se detectó leucopenia o linfopenia (casos 3,
11, 15). Al realizar pruebas inmunológicas, se encontró
hipogammaglobulinemia en los 6 individuos analizados (casos 2, 3, 5,
6, 8, 9); las pruebas de reacción inmune tipo IV, incluyendo la
reacción de tuberculina, coccidiomicosis e histoplasmosis, fueron
negativas en 3 pacientes (casos 3, 6, 8). En cuanto a las
determinaciones de IgG, IgM e IgA, resultaron positivas contra antígeno
nuclear y antígeno de cápside viral en quienes se analizó la
serología frente al virus de Epstein Barr. Estos resultados
muestran que tanto las funciones del sistema inmune humoral y
celular como los agentes infecciosos deben ser buscados
cuidadosamente en pacientes con granulomatosis linfomatoidea.
Las investigaciones radiológicas se basaron en los síntomas y
signos de los pacientes (tabla 1); entre las determinaciones
realizadas más comúnmente se encuentra la obtención de imágenes
craneales y torácicas. Se determinó infiltración pulmonar
bilateral en 10 pacientes, lesiones nodulares en el pulmón en 3
(casos 7, 12, 14) y masa sólida pulmonar en uno (caso 4). También
se practicó tomografía computada craneal o resonancia magnética
en 6 pacientes con signos neurológicos: 3 mostraron lesiones
craneales difusas o multifocales y masas sólidas, en 2 (casos 2 y
7) los resultados fueron normales, y el restante (caso 15) tenía
atrofia cerebral. La resonancia magnética de la columna vertebral
mostró lesión torácica 2-3 en el paciente número 14, mientras
que no hubo información sobre la prueba diagnóstica en el caso 1.
La principal herramienta para el diagnóstico en todos los pacientes
fue la realización de biopsia o autopsia. Se efectuaron biopsias a
nivel pulmonar en 7 casos (41.7%), cerebral en 3 individuos, de piel
en otros 4 participantes y sólo en uno a nivel laríngeo; en
algunos pacientes se realizó de forma conjunta biopsia pulmonar y
cerebral, mientras que en otros fue efectuada a nivel pulmonar y en
la piel. En cuanto a la realización de autopsia, solamente se
utilizó para efectuar el diagnóstico en un paciente. Los
resultados histopatológicos de las biopsias pulmonares fueron
similares, mostrando infiltración por linfocitos, por células
plasmáticas y por grandes células modificadas, cuyos alvéolos habían
desaparecido; además, se encontró infiltración linfática atípica,
la cual formó nódulos irregulares y destruyó las paredes de las células
sanguíneas. En cuanto a la biopsia de piel, se determinó
vascularización de la epidermis profunda junto con infiltración
mononuclear a nivel perivascular y en los vasos. Los marcadores de
superficie celular de la infiltración atípica revelaron un
fenotipo anómalo de células T, el cual fue CD3 positivo. Las
biopsias cerebrales se efectuaron en 3 casos en los que se
encontraron pequeños focos de necrosis con gliosis reactiva en el
tejido que envuelve al cerebro.
El tratamiento en niños y pacientes jóvenes usualmente consiste en
la administración de prednisona (75%), ciclofosfamida (56.2% y
vincristina (31.2%), las mismas drogas empleadas para adultos. En 2
individuos se adicionó irradiación cerebral a la terapia, mientras
que en uno se efectuó un transplante alogénico de células
precursoras de la médula.
El pronóstico de la granulomatosis linfomatoidea es extremadamente
malo, con una tasa de sobrevida a los 3 años de 10% a 40% de los
casos;2 además, se considera un factor negativo si el
paciente tiene menos de 25 años.2 En los trabajos de
Katzenstein,2 16 de los 152 participantes tenían menos
de esa edad, y se produjo la muerte de 13 de ellos (81%). Con
respecto a los estudios efectuados por Fauci y colaboradores,5
5 de los 15 pacientes eran menores de 25 años y 3 murieron (60%),
mientras que en los trabajos de Beaty y colaboradores,4
los autores informaron que de los 20 pacientes con esta patología,
murió 1 de los 3 participantes de corta edad (33%). Con relación
al estudio efectuado por nosotros, el análisis de los 16 jóvenes
mostró que la mortalidad fue del 50%; además, se verificó remisión
en 4 pacientes (25%), y uno de ellos fue tratado posteriormente por
compromiso de la coroides. Por otra parte, un individuo presentó
posteriormente linfoma de Hodgkin, mientras que en 2 participantes
no pudo continuarse el seguimiento. En los trabajos de Fauci y
colaboradores,5 se demostró que 8 de los 15 pacientes
(53.33%) desarrollaron linfoma maligno, al igual que 18 individuos
(12%) que intervinieron en los trabajos de Katzenstein.12
BIBLIOGRAFIA
- Liebow AA, Carrington CRB,
Friedman PJ. Lymphomatoid granulomatosis. Hum Pathol
1972;3:457-558
- Katzenstein A-L A, Carrington
CB, Liebow AA. Lymphomatoid granulomatosis. A clinicopathologic
study of 152 cases. Cancer 1979;43:360-373
- Jaffe ES, Wilson WH.
Lymphomatoid granulomatosis:Pathogenesis, pathology and clinical
implications. Cancer Surveys 1997;30:233-248
- Beaty MW, Toro J, Sorbara L,
Stern JB, Pittaluga S, Raffeld M, Wilson WH, Jaffe ES. Cutaneous
lymphomatoid granulomatosis. Correlation of clinical and
biological features. Am J Surg Pathol 2001; 25:1111-1120
- Fauci AS, Haynes BF, Costa J,
Katz P, Wolff SM. Lymphomatoid granulomatosis.Prospective
clinical and therapeutic experience over 10 years. N Eng J Med
1982;306:68-74
- Rogers M, de-Launey J, Kemp A,
Bishop A. Lymphomatoid papulosis in an 11-month-old infant.
Pediatr Dermatol 1984;2:124-130
- Lehman TJA, Church JA, Isaacs H.
Lymphomatoid granulomatosis in a 13-month-old infant. J
Rheumatol 1989;16:235-238
- Whelan HT, Moore P.Central
nervous system lymphomatoid granulomatosis. Pediatr Neurosci
1987;13:113-117
- Karnak I, Ciftci AO, Talim B,
Kale G, Senocak ME. Pulmonary lymphomatoid granulomatosis in a 4
year old. J Pediatr Surg 1999;34:103-1035
- LeSueur BW, Ellsworth L, Bangert
JL, Hansen RC. Lymphomatoid granulomatosis in a 4- year-old boy.
Pediatr Dermatol 2000;17:369-372
- Bekassy AN,Cameron R, Garwicz S,
Laurin S, Wiebe T.Lymphomatoid granulomatosis during treatment
of acute lymphoblastic leukemia in a 6-year old girl. Am J
Pediatr Hematol Oncol 1985; Winter:377-380
- Moertel CL, Carlson-Green
B,Watterson J,Simonton SC. Lymphomatoid granulomatosis after
childhood acute lymphoblastic leukemia:report of effective
therapy. Pediatrics 2001;107:e82
- ShenSC, Heuser ET, Landing BH,
Siegel SE, Cohen SR. Lymphomatoid granulomatosis- like lesions
in a child with leukemia in remission. Hum Pathol
1981;12:276-280
- Pearson ADJ, Kirpalani H,
Ashcroft T, Bain H, Craft AW. Lymphomatoid granulomatosis in a
10 year old boy. Br Med J 1983;286:1313-1314
- Pearson ADJ, Craft AW, Howe JM.
Choroidal involvement in lymphomatoid granulomatosis. B J
Ophthalmol 1991;75:688-689
- Paspala AB, Sundaram C, Purohit
AK, Immaneni D. Exclusive CNS involvement by lymphomatoid
granulomatosis in a 12-year-old boy: a case report. Surg Neurol
1999;51:258-260
- Ilowite NT, Flinger CL, Ochs HD,
Brichacek B, Harada S, Haas JE, Purtilo DT, Wedgwood RJ.
Pulmonary angiitis with atypical lymphoreticular infiltrates in
Wiskott-Aldrich Syndrome: possible relationship of Lymphomatoid
granulomatosis and EBV infection. Clin Immunol Immunopathol
1986;41:479-484.
- Guven A, Baskin D. Lymphomatoid
granulomatosis in a boy with long-term follow- up.Ped Hematol
Oncol 2001;18;377-382
- Herdershee D, Troost D, de
Visser M, Neve AJ. Lymphomatoid granulomatosis:clinical and
histopathological report of a patient presenting with spinal
cord involvement. J Neurol 1988;235:432-434
- Prapphal N, Limudomporn S,
Watana D, Yenrudee S, Viravaidya D, Chomdej S, Cutchavaree A.
Lymphomatoid granulomatosis with upper airway obstruction: a
case report.JMedAssocThai1991;74:526-530
- Amin SN, Gibbons CM, Lovell CR,
MacLeod TIF, Moss TH, Maddison PJ. A case of lymphomatoid
granulomatosis with a protracted course and prominent CNS
involvement. B J Rheumatol 1989;28:77-89
- Tawfik NH, Magro CMJ, Crowson
AN, Maxwell I. Lymphomatoid granulomatosis presenting as a
solitary cutaneous lesion. Int J Dermatol 1994;33:188-189
- Kleinschmidt-DeMasters BK,
Filley CM, Bitter MA. Central nervous system angiocentric,
angiodestructive T-cell lymphoma(Lymphomatoid
granulomatosis).Surg Neurol 1992;37:130-17
|
 MORTALIDAD POR CANCER DE ESTOMAGO EN ANDALUCIA, ESPAÑA
MORTALIDAD POR CANCER DE ESTOMAGO EN ANDALUCIA, ESPAÑA
|
|

|
Miguel Ruiz Ramos
Columnista Experto de
SIIC
Médico del Registro de Mortalidad de
Andalucía. Instituto de Estadística de Andalucía. Pabellón
de Nueva Zelanda, Sevilla, España
Institución:
Instituto de Estadística de Andalucía. Pabellón de Nueva
Zelanda, Sevilla, España
|
|
Introducción
El cáncer de estómago es la segunda localización tumoral más
frecuente en el mundo tanto para hombres como para mujeres. Su
incidencia en los países en vías de desarrollo difiere de la
observada en los países desarrollados: en los primeros, los nuevos
casos en hombres son muy parecidos en número a los de cáncer de
pulmón; y en los segundos, se sitúa por detrás del cáncer de próstata
y colorrectal.1 En las mujeres, las diferencias en la
incidencia entre los países desarrollados y en vías de desarrollo
son menores, pero se mantienen. Japón, Chile y Costa Rica se
encuentran entre los países que presentan mayor mortalidad, con
tasas entre los japoneses siete veces superiores a la de los hombres
blancos de Estados Unidos.2 En Europa, la Federación
Rusa tenía las tasas de mortalidad más elevadas y Dinamarca y
Francia, las más bajas.3 En la mayoría de los países
la tendencia ha sido descendente en las últimas décadas. Aunque no
se conoce el porqué de este fenómeno, se ha relacionado con
mejoras en la conservación de los alimentos debida a mayor
disponibilidad de la cadena del frío, reducción en el consumo de
conservas en salazón, ahumados y otras que utilizan nitratos, y
aumento del consumo de verduras y frutas.4,5 En años más
recientes, se ha comenzado el estudio de la relación entre los
tratamientos erradicadores del Helicobacter pylori y el
descenso en la incidencia y mortalidad por cáncer de estómago.6
España, en líneas generales, tiene evolución de la incidencia y
mortalidad parecida al resto de países de su entorno.7
La mortalidad se sitúa en una posición intermedia en relación con
los países europeos y, al igual que ellos, los hombres presentan
tasas más elevadas que las mujeres.8 Las provincias de
Castilla León tenían las tasas más altas de mortalidad con
riesgos de morir superiores en 50% a la media española y más del
doble con respecto a las provincias de baja mortalidad.9
El rápido descenso de la incidencia y mortalidad por esta
localización tumoral hace pensar que las causas determinantes están
más racionadas con factores ambientales que genéticos,2
aunque también se ha confirmado cierta susceptibilidad genética al
desarrollo de este tipo de cáncer, en estudios llevados a cabo en
grupos étnicos cerrados10 y familiares de pacientes11
tras controlar factores de confusión como la dieta.12 El
objetivo de este trabajo es describir la tendencia de la mortalidad
por cáncer de estómago en Andalucía entre los años de 1975 y
2001, así como conocer su distribución geográfica por distritos
de atención primaria de salud.
Material y métodos
Para realizar el análisis temporal de la mortalidad, se han
incluido las defunciones por cáncer de estómago (rúbrica 151 de
la octava y novena Clasificación Internacional de Enfermedades y
Causas de Muerte y C16 de la décima revisión) procedentes de los
datos publicados por el Instituto Nacional de Estadística, para los
años 1975- 1991,13 y por el Instituto de Estadística de
Andalucía (IEA), para los años 1992-2001 (los datos de este último
año son provisionales). El criterio de inclusión utilizado ha sido
el lugar de residencia, es decir, se analizan todas las defunciones
de residentes en Andalucía durante los años del periodo estudiado.
Las poblaciones proceden de las proyecciones realizadas por el IEA.
Para el cálculo de indicadores se han utilizado las poblaciones
estimadas a mitad de año en grupos quinquenales hasta 85 años y más.
Las franjas de menores de un año, de 1 a 4 años y 85 años y más
no se han agrupado en rangos quinquenales.
Los indicadores elaborados fueron: tasas brutas de mortalidad por cáncer
de estómago (TB); tasas ajustadas por edad, utilizando como estándar
la población europea (TED); tasas teóricas estimadas mediante los
modelos de regresión lineal (TT); tasas truncadas de 35 a 64 años
de edad ajustadas por edad mediante la población europea (Ttru);
tasas acumuladas de 0 a 74 años por 100 (TA), como una buena
aproximación al riesgo de morir por cáncer de estómago en
ausencia de otras causas;14 y las tasas ajustadas por
edad mediante el mismo procedimiento de años potenciales de vida
perdidos (APVP).
Todas las tasas se han calculado por 100 000 personas-año, para
mujeres y hombres por separado y para cada uno de los años de la
serie.
Los 27 años incluidos en el trabajo fueron divididos en dos períodos:
de 1975 a 1987 y de 1988 a 2001, para mujeres y hombres por
separado; se calcularon las tasas específicas por grupos de edad
por 100 000 personas-año y se graficaron las curvas de mortalidad
por edad.
Mediante análisis de regresión lineal, utilizando como variable
independiente el año de defunción (1975-2001) y como variable
dependiente la tasa ajustada por edad, se estimaron los coeficientes
de la regresión y se calcularon las tasas teóricas (TT) para cada
uno de los años. Además se calculó el porcentaje de cambio, a lo
largo de todo el período, de la mortalidad por cáncer de estómago:
a la tasa teórica de 2001 se restó el valor de la de 1975,
dividiendo la diferencia por la tasa de 1975 y multiplicando por
cien.
Para realizar el análisis espacial de la mortalidad por cáncer de
estómago, la unidad de observación ha sido el distrito sanitario
de atención primaria de salud de Andalucía (DS), definido como
"la demarcación geográfica para la planificación, prestación
y gestión de los servicios de atención primaria".15
La delimitación territorial de los DS fue la oficial, publicada en
el Boletín Oficial de la Junta de Andalucía.16 Para
cada DS y para mujeres y hombres por separado en el período de 1992
a 2001 fueron calculados los mismos indicadores que para el conjunto
de Andalucía en la serie de años estudiados. Es decir, se
calcularon las tasas brutas, ajustadas por edad, truncadas,
acumuladas y de APVP.
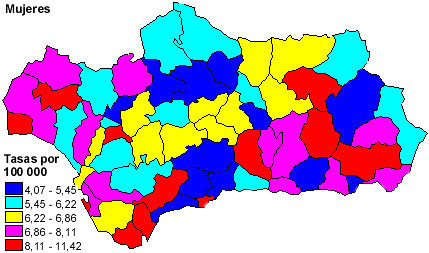
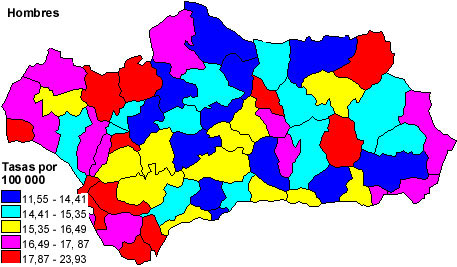
Con las tasas ajustadas por edad de mujeres y hombres se determinó
el patrón geográfico de la mortalidad por cáncer de estómago.
Para representarlos gráficamente fueron construidos sendos mapas,
uno para mujeres y otro para hombres, con las tasas ajustadas por
edad, organizadas en quintilos.
Resultados
La tendencia de la mortalidad por cáncer de estómago en Andalucía
entre 1975 y 2001 es claramente descendente (tablas 1 y 2).
Tabla
1
Tabla
2
En las mujeres, por 100 000 personas-año, las tasas brutas pasaron
de 14.75 defunciones en 1975 a 8.02 en el 2001; las tasas ajustadas
por edad, de 16.07 a 5.94 defunciones entre los mismos años; las
tasas truncadas, de 10.58 a 5.77 defunciones para el primer y último
año de la serie; los riesgos de morir por cáncer de estómago, de
1.08 por ciento en 1975 a 0.40 por ciento en el 2001; los APVP
igualmente descendieron de 71.2 años en 1975 a 46.18 años en 2001.
En los hombres, en el mismo período y por 100 000 personas año,
las tasas brutas descendieron de 22.79 a 14.00 defunciones; las
tasas ajustadas por edad, de 34.41 a 13.85 defunciones; las tasas
truncadas, 25.44 a 11.87 defunciones; las tasas acumuladas, de 2.51
por ciento a 1.04; y los APVP igualmente se han reducido de 179.54 años
por 100 000 personas-año en 1975 a 90.35 en el 2001. La razón de
las tasas ajustadas por edad entre hombres y mujeres se ha mantenido
superior a 2 a lo largo de toda la serie de años, con algunas
fluctuaciones.
En la figura 1 se representan las tasas ajustadas por edad, las
ecuaciones de regresión y las tendencias obtenidas para cada uno de
los sexos al aplicar el modelo lineal, que es el que mejor se ajusta
a la evolución observada.
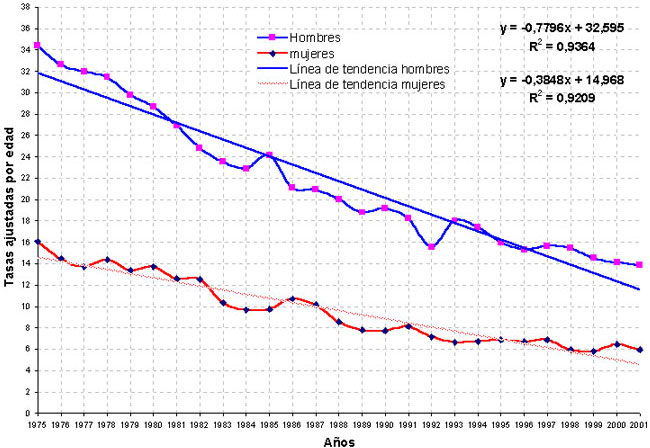
Figura 1. Evolución de la
mortalidad por cáncer de estómago en Andalucía, en el período
1975-2001.
Las TT se pueden estimar utilizando las ecuaciones que aparecen en
dicha figura. Mediante las mismas se ha obtenido un porcentaje de
descenso de las tasas ajustadas por edad de mortalidad por cáncer
de estómago de un 63,04% en las mujeres y de un 59,73% en los
hombres para todo el periodo.
En la figura 2 y tabla 3 se presentan las tasas de específicas de
mortalidad por grupos de edad, formando las curvas de mortalidad por
edad. Para los hombres y las mujeres, y para el periodo de 1975 a
1987 y de 1988 a 2001 las forma de la curva es muy similar ( en
forma de J), con una baja mortalidad en los grupos más jóvenes y
con un ascenso exponencial a partir de los 50 años de edad. También
se puede observar como la mortalidad se ha reducido en todos los
grupos de edad entre el primer y segundo periodo, y en el último
periodo tanto en los hombres cono en las mujeres el incremento se ha
enlentecido en el grupo de mayores de 84 años.
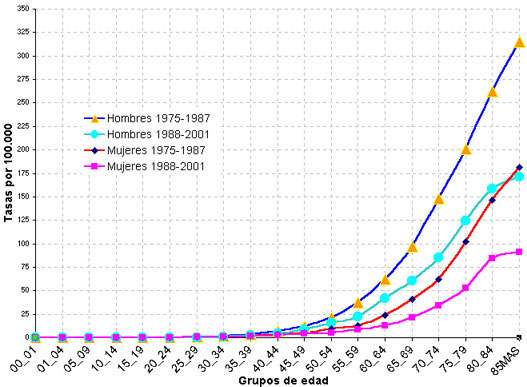
Figura 2. Curvas de
mortalidad por edad. Andalucía, 1975-1987 y 1988-2001.
Tabla
3
En las tablas 4 y 5 se presenta una serie de indicadores
correspondientes a los distintos DS, para mujeres y hombres, durante
el periodo de 1992 a 2001.
Tabla
4
Tabla 5
En las mujeres, los distritos de Costa de Huelva, Algeciras y Guadix
fueron los que mayor mortalidad presentaron, con tasas anuales
medias y ajustadas por edad de 11.41, 10.19 y 9.06 defunciones por
100 000 personas-año, respectivamente; y los distritos de Palma del
Río en Córdoba, Roquetas en Almería y Alcalá la Real en Jaén
fueron los de menor mortalidad, con tasas anuales medias ajustadas
por edad de 4.07, 4.51 y 4.78 defunciones por 100 000 personas-año.
La razón de tasas entre el distrito con mayor y menor mortalidad
fue de 2.8, es decir, el riesgo de morir fue de casi tres veces
superior en las zonas de alta mortalidad con respecto a las de baja
mortalidad por cáncer de estómago en las mujeres andaluzas. Las
diferencias aumentaron si se comparan los APVP: de 8.38 se pasó a
99.60 años por 100 000 entre Alpujarras en Granada y Costa de
Huelva. En los hombres, los distritos de Guadix, Bahía de Cádiz y
Algeciras, con tasas anuales medias ajustadas por edad de 23.92,
22.15 y 21.78 defunciones por 100 000 personas-año fueron los que
presentaron la mayor mortalidad; y Montilla, Osuna y Valle de los
Pedroches, con tasas de 11.55, 12.11 y 12.39 defunciones por 100 000
personas-año, las de más baja mortalidad por cáncer de estómago;
la razón de tasas entre el distrito de mayor y menor mortalidad fue
inferior que en las mujeres (ver mapas).
Discusión
Los resultados de este trabajo muestran notable descenso de la
mortalidad por cáncer de estómago en Andalucía entre 1975 y 2001,
más acusado en las mujeres que en los hombres. Esta tendencia
concuerda con la observada en España, que presentó sus tasas más
elevadas a mediados de los años sesenta y desde entonces el
descenso ha sido continuo.17 Las causas de este descenso,
observadas en otros países desarrollados, están asociadas con
disminución de la incidencia y aumento de la supervivencia. Durante
décadas la supervivencia al cáncer de estómago fue muy baja,
inferior al 10% a los 5 años, por lo que se aceptaba que la reducción
de la mortalidad era buen indicador del descenso de la incidencia18
en los registros de cáncer de España y de otros países
occidentales. Recientemente se han publicado estimaciones de
supervivencia a los 5 años ligeramente superiores, 19.3% en hombres
y 23.6% en mujeres, como promedio europeo, con un rango que oscila
entre 8.4% y 10.1% para hombres y mujeres respectivamente en
Polonia, hasta 25.3 en hombres en España, y 32.1% en mujeres en
Islandia, que claramente contribuyen al descenso de las tasas de
mortalidad. La tendencia observada en Andalucía, puesta ya de
manifiesto en otro trabajo publicado recientemente,19
coincide con la esperada.
La distribución geográfica por Distritos Sanitarios de Atención
Primaría muestra grandes diferencias entre ellos. Habría que
descartar que fuesen debidas a errores tanto de la fuente de
información como de los indicadores utilizados para medir las
desigualdades en mortalidad. En cuanto a los datos, la exahustividad
de los sistemas de información de mortalidad en Andalucía y en el
conjunto del Estado Español es cercana al cien por cien; en cuanto
a la fiabilidad de la información sobre las causas de mortalidad
por cáncer, no existen estudios específicos para Andalucía, pero
por trabajos realizados en otras zonas del Estado Español se conoce
su alta fiabilidad;20 y se ha elegido el intervalo de los
últimos diez años disponibles para disminuir la variabilidad de
los indicadores calculados. Otro aspecto relacionado con los datos y
la metodología son los usos de técnicas estadísticas
sofisticadas,21 que resultaron muy útiles para buscar
patrones de distribución geográfica pero que pueden alejar los
resultados de los datos reales22 necesarios sobre todo
para la planificación de los recursos sanitarios; por ello, se ha
optado por presentar las tasas de mortalidad ajustadas por edad.
Andalucía en conjunto presenta tasas de incidencia23 y
mortalidad bajas como para pensar programas de detección precoz
generalizados del tipo de los llevados a cabo en Japón. Estos
programas utilizan técnicas estandarizadas de doble contraste de
bario y posterior gastroscopia (en personas de más de cuarenta años),
que han hecho del cáncer de estómago una enfermedad curable
detectada en estadios precoces. Sí sería razonable pensar en
intervenciones parecidas en áreas pequeñas donde la mortalidad es
muy elevada y existe un dispositivo sanitario capaz de tomar medidas
apropiadas a la situación epidemiológica. Previamente sería
necesario analizar la morbilidad, los patrones dietéticos, la
susceptibilidad genética y la prevalencia de infección por H.
pylori a través de estudios analíticos que tuvieran en cuanta
posibles factores de confusión como las exposiciones ocupacionales
y el nivel socioeconómico. En este sentido, numerosos trabajos
recientes relacionan la presencia del H. pylori con el riesgo
de padecer cáncer de estómago24-26 y esto puede abrir
una nueva perspectiva en el tratamiento tanto curativo como
preventivo de esta enfermedad.
BIBLIOGRAFIA
- Parkin DM, Muir CS, Whelan SL,
Gao YT, Ferlay J, Powell J. Cancer incidence in five continents.
Vol I. IARC. Lyon, 1992.
- Hawson CP, Himaya T, Wynder
EL.The decline in gastric cancer: epidemiology of an unplanned
triumph. Epidemiologic Reviews 1986; 8: 1-27.
- Levi, Lucchini, Negri, Boyle P,
La Vecchia C. Cancer Mortality in Europe, 1990-1994, and
Overview of Trends from 1955 to 1994. European Journal of Cancer
1999; 35 (10): 1477- 1516.
- Wu AH, Yang D, Pike MC. A
meta-analysis of soyfoods and risl of stomach cancer: the
problem of potencial confounders. Cancer Epidemiology Biomedical
and Prevention 2000; 9: 1051-1058.
- Sano T, Sasako M. Green tea and
gastric cancer. Editorials. N Engl J Med 2001; 344(9): 675-676.
- Akre K, Signorello LB, Engstrand
L, Bergstróm R, Larson S, Eriksson BI, Nyrén O. Risl for
gastric cancer after antibiotic prophylaxis in patients
undergoing hip replacement. Cancer Research 2000; 60(22):
6376-6380.
- López-Abente G, Pollán M,
Vergara A, Ardanaz E, Moreno P, Moreno C, Ruiz M. Tendencia de
la cáncer en Navarra y Zaragoza. Gac Sanit 2000; 14(2):
100-109.
- Levi F, La Vecchia C, Lucchini
F, Negri E. Trends in cancer mortality sex ratio in Europe,
1950-1989. Wld hlth statist. Quart., 45 (1992)
- López-Abente G, Pollán M,
Escolar A, Errezola M, Abraira V. Atlas de mortalidad por cáncer
y otras causas en España 1978-1992. Fundación Científica de
la Asociación Española Contra el Cáncer. Madrid, 1996.
- Feldman GE. Do Ashkenazi Jews
have a higher than expected cancer burden? Implications for
cancer control priorization efforts. Isr Med Assoc J 2001; 3(5):
341-346.
- Bakir T, Can G Erkul S,
Siviloglu C. Stomach cancer history in sibling of patiens with
gastric cancer. Eur J Cancer Prev 2000; 9(6): 401-408.
- Dhillon PK, Farow DC; Vaughan
TL, Chow WH, Risch HA, Gammon MD et al. Family histori cancer
risk of esophageal and gastric cancer in the United States. Int
J Cancer 2001; 93 (1): 148-152.
- INE. Movimiento Natural de la
Población Española. Defunciones según la causa de muerte. Vol
III. Años 1975-1991. Madrid. Instituto Nacional de Estadística,
1993.
- Breslow NE, Day EN. Statistical
methods in cancer research. Vol II. The dising analysis of
cohorte studies. Lyon: IARC, 1987.
- Sánchez Burson JM. Compendio de
legislación sanitaria andaluza. Sevilla. Consejería de Salud y
Asuntos Sociales, 1989.
- Consejería de Salud y Asuntos
Sociales. Orden por la que se modifica el Mapa de Atención
Primaria de Salud de Andalucía. Sevilla, BOJA 1991; 11:
598-601.
- World Health Organization. WHO
Databank. WWW-dep.iarc.fr
- Coleman MP, Esteve J, Damiecki
P, Arsland A, Renard H. Trends in cancer incidence and
mortality. Lyon: IARC, 1993.
- Ruiz Ramos M, Nieto García MA,
Mayoral Cortés JM. Mortalidad por cáncer en Andalucía:
tendencia y distribución espacial. Aten Primaria 2001.
Diciembre. 28 (10): 634-461.
- Benavides F, Bolumar F, Peris R.
Quality of death certificates in Valencia, Spain. Am J Public
Health 1989; 79 (10): 1352-1354.
- Yasuri Y, Liu H, Benach J,
Winget M. An empirical evaluation of various priors in empirical
Bayes estimations of smoll area disease risks. Stat Med 2000; 19
(17-18): 2409- 2420.
- Hsio CK, Tzeng JY, Wang CH. The
performance of two indices for spartial model selection:
application to two mortality data. Stat Med 2000; 19
(14):1915-1930.
- Ferlay J, Black SL, Whelan SL,
Parkin DM. Electonic database of cancer incidence in five
continents. IARC Cancerbase 2. Lyon: IARC, 1997.
- Enroth E, Kraaz W, Engstrand L,
Nyrén O, Rohan T. Helicibacter pylory Strain Types and Risk of
Gastric Cancer: A Case-Control Study. Cancer Epidemiology
Biomarkers and Prevention 2000; 9: 981-985.
- Brown Morris L. Helicobacter
pylory: Epidemiology and routes of transmisión. Epidemiol Rev
2000; 22(2): 283-97.
- Yuan JM, Yu MC, Xu WW, Cockburn
M, Gao YT, Ross RK. Cancer epidemiology biomarkers and
prevention 1999; 8: 621-624. in Spain, 1975-98
|
 TERAPIA
DE REEMPLAZO HORMONAL EN LA MENOPAUSIA Y CANCER
TERAPIA
DE REEMPLAZO HORMONAL EN LA MENOPAUSIA Y CANCER
|
|

|
Carlo
La Vecchia
Columnista
Experto de SIIC
Jefe del Laboratorio of Epidemiología. Istituto
di Ricerche Farmacologiche «Mario Negri»,
Milán
Institución:
Istituto di Ricerche Farmacologiche «Mario
Negri», Milán, Italia
|
|
|
Los efectos potencialmente favorables y desfavorables más
marcados de la TRH sobre el riesgo de cáncer se restringen
a las usuarias actuales. Sobre la base de los datos
epidemiológicos de observación, la estimación de riesgo
relativo (RR) de cáncer mamario se encuentra moderadamente
elevada en usuarias actuales y recientes de TRH, y crece
2.3% por año al aumentar la duración de su empleo; este
efecto decae tras la cesación del tratamiento y, marcada o
totalmente, al cabo de cinco años. El uso de estrógenos
sin oposición se relaciona fuertemente con el riesgo de cáncer
endometrial, pero el tratamiento combinado cíclico con estrógenos-progestágenos
parece reducir en gran medida o totalmente este efecto
adverso si el progestágeno es utilizado por al menos 14 días
por ciclo. Sin embargo, la TRH combinada puede asociarse con
mayor riesgo de cáncer mamario, en comparación con los
estrógenos sin oposición. La TRH ha sido inversamente
relacionada con el cáncer colorrectal, pese a que este tema
de relación causal permanece abierto al debate. No se ha
informado una asociación consistente con el cáncer de
ovario, de hígado u otros cánceres digestivos o con las
neoplasias pulmonares.1 En un análisis conjunto
de estudios de casos y controles europeos acerca del cáncer
ovárico,2 participaron alrededor de 2 500
mujeres que padecían cáncer epitelial ovárico histológicamente
confirmado y 5 880 controles, que habían conformado la
población de 5 estudios de casos y controles: 2 llevados a
cabo en Grecia, 1 en el Reino Unido, 1 en Italia entre 1979
y 1991, y 1 realizado en cuatro localidades italianas entre
1992 y 1999. En comparación con las mujeres que nunca habían
utilizado TRH, el odds ratio (OR) para las que alguna
vez la habían utilizado era de 1.28 (intervalo de confianza
del 95% (IC 95%), 1.05-1.56). El riesgo fue 1.11 para la
utilización de por menos 2 años, y 1.41 para su uso por 2
años o más. En relación al tiempo transcurrido desde la
última utilización de TRH, el OR fue 1.37 para un
intervalo de menos de diez años desde el último uso, 1.13
para 10-14 años, y 0.95 para 15 o más años desde el último
uso (tabla 1).

La relación entre el TRH y el cáncer de vesícula biliar
fue analizada en mujeres con edades superiores a 45 años,
utilizando datos de un estudio de casos y controles llevado
a cabo en Italia entre 1985 y 1997 sobre 31 casos
incidentales, confirmados histológicamente, y 3 702
controles hospitalizados por condiciones agudas no neoplásicas.
El OR multivariado fue 3.2 (IC 95%, 1.1-9.3) para aquellas
mujeres que alguna vez habían utilizado TRH, y el OR tendió
aumentar con la mayor duración.3 Entre 1979 y
1998, en el estudio de cohorte Breast Cancer Detection
Demonstration Project (BCDDP) se observaron 329 casos de
cáncer de ovario.4 El riesgo relativo (RR) para
la TRH sólo con estrógenos fue de 1.6 (IC 95%, 1.2-2.0) en
las mujeres que alguna vez habían utilizado TRH, y
aumentaba hasta 1.8 para las que la habían utilizado por
10-19 años, y hasta 3.2 (95% CI 1.7-5.7) para un uso por más
de 20 años. Los datos fueron inadecuados para evaluar la
TRH combinada.
La información reciente más importante acerca del riesgo
de cáncer en usuarias de TRH combinada (estrógenos y
progestágenos) proviene del Women's Health Initiative
(WHI),5 un estudio aleatorizado controlado acerca
de la prevención primaria que incluyó 8 506 mujeres de
edades comprendidas entre 50 y 70 años, tratadas con TRH
combinada, y 8 102 mujeres no tratadas. La terapia combinada
fue suspendida el 9 de julio; en nese momento los Institutos
Nacionales de Salud de los EE.UU. emitieron un comunicado de
prensa6 donde se establecía que la medicación
hormonal combinada utilizada en el estudio producía más
riesgos que beneficios. Los NIH tuvieron en cuenta el
aumento del riesgo de cáncer mamario invasor, de enfermedad
cardiovascular, accidentes cerebrovasculares y trombosis
sanguínea. Se encuentra aún en marcha un estudio adicional
de estrógenos en comparación con placebo como único grupo
de tratamiento en el mismo estudio WHI. En relación con el
riesgo de cáncer, se proveyeron datos acerca de la
incidencia de cáncer mamario, endometrial y colorrectal. No
se hizo evidente diferencia alguna en el riesgo durante los
primeros cuatro años de iniciado el tratamiento, pero se
observó elevación del riesgo de cáncer mamario a partir
de ese momento, así como reducción del de cáncer
colorrectal. Globalmente, a los siete años de seguimiento,
166 casos de cáncer mamario fueron registrados en el grupo
de TRH, vs. 124 del grupo placebo, lo cual
corresponde a un RR de 1.24 (IC 95%, 1.3-1.66).
Se encuentran disponibles datos provenientes de otros dos
estudios aleatorizados más pequeños; el HERS, con una
terapia combinada de estrógenos y progestágenos,7
y el WEST, con estrógenos solamente.8 En un análisis
combinado de los tres estudios aleatorizados,9 se
observaron 205 casos de cáncer mamario en los grupos de
tratamiento vs. 156 en los de placebo; ello
corresponde a un RR agrupado de 1.27 (IC 95%, 1.03-1.56).
Se encuentran disponibles datos acerca de cáncer
endometrial provenientes del WHI y el HERS, ambos basados en
el empleo de TRH combinada. Globalmente, 24 casos fueron
observados en los grupos de TRH combinada, vs. 30 en
los grupos placebo; es decir, un RR agrupado de 0.76 (IC
95%, 0.41-0.92). El análisis combinado con los datos del
HERS incluyó 56 casos en el grupo de tratamiento con TRH
combinada y 83 casos en el grupo placebo (RR = 0. 64; IC
95%, 0.45-0.92).
Así, en relación a la TRH y el riesgo de cáncer, los
hallazgos recientes de los estudios aleatorizados concuerdan
ampliamente con los ensayos de observación (de cohortes y
de casos y controles)10 y proveen evidencias
concluyentes de que:
- La TRH, especialmente la combinación de estrógenos y
progestágenos, se asocia con moderada elevación del
riesgo de cáncer mamario, que se hace evidente luego de
pocos años de uso
- La TRH combinada no se asocia con aumento del riesgo
material de cáncer endometrial.
- La TRH ejerce un efecto favorable sobre el riesgo de cáncer
colorrectal, lo cual es de interés para cualquier
evaluación global de riesgos y beneficios.
BIBLIOGRAFIA
- La Vecchia C., Brinton
L.A., McTiernan A. Menopause, hormone replacement
therapy and cancer. Maturitas 39: 97-115, 2001.
- Bosetti C., Negri E.,
Franceschi S., Trichopoulos D., Beral V., La Vecchia C.
Relationship Between Postmenopausa Hormone Replacement
Therapy and Ovarian Cancer. JAMA 285: 3089, 2001.
- Gallus S., Negri E.,
Chatenoud L., Bosetti C., Franceschi S., La Vecchia C.
Post- menopausal hormonal therapy and gallbladder cancer
risk. Int. J. Cancer 99: 762-763, 2002.
- Lacey JV Jr, Mink PJ,
Lubin JH, Sherman ME, Troisi R, Hartge P, Schatzkin A,
Schairer C. Menopausal hormone replacement therapy and
risk of ovarian cancer. JAMA 288: 334-341, 2002.
- Writing Group for the
Women’s Health Initiative Investigators. Risks and
benefits of estrogen plus progestin in healthy
postmenopausal women: principal results from the
Women’s Health Initiative randomized controlled trial.
JAMA 288: 321-333, 2002.
- Digest Page:
Postmenopausal Hormone
Use.http://www.nci.nih.gov/clinical_trials
- Hulley S, Furberg C,
Barrett-Connor E, Cauley J, Grady D, Haskell W, Knopp R,
Lowery M, Satterfield S, Schrott H, Vittinghoff E,
Hunninghake D, HERS Research Group. Noncardiovascular
disease outcomes during 6.8 years of hormone therapy:
Heart and Estrogen/progestin Replacement Study follow-up
(HERS II). JAMA 288: 58-66, 2002.
- Viscoli CM, Brass LM,
Kernan WN, Sarrel PM, Suissa S, Horwitz RI. A clinical
trial of estrogen-replacement therapy after ischemic
stroke. N Engl J Med 345: 1243-1249, 2001.
- Beral V, Banks E, Reeves
G. Evidence from randomised trials on the long-term
effects of hormone replacement therapy. Lancet 360:
942-44, 2002.
-
La Vecchia C, Franceschi
S. Hormone replacement therapy and cancer: an update.
Eur J Cancer Prev 12:3-4, 2003.

Trabajos Distinguidos,
Serie Oncología,
integra el Programa
SIIC-ASARCA de Educación Médica Continuada
|
|

|



