

Volumen 3,
Número 1, Diciembre 2003
|
|
|
|
Expertos Invitados |
|
|
|
|
|
Autor: Dra. Margriet S. Westerterp Plantenga Columnista Experto de SIIC Institución: Diabetes Center, Sasebo Chuo Hospital, Nagasaki, Japón |
|
|
|
|
|
|
|
|
Autor: Dr. Karl-Heinz Wagner Columnista Experto de SIIC Institución: Institute of Nutritional Sciences, University of Vienna, Viena, Austria |
|
Introducción La enfermedad cardiovascular (ECV) es una de las principales causas de muerte en todo el mundo. Los niveles altos de colesterol asociado a lipoproteínas de baja densidad (cLDL), colesterol total (CT), triacilglicerol (TAG) y los niveles bajos de colesterol asociado a lipoproteína de alta densidad (cHDL) están vinculados con aumento del riesgo de padecer ECV.1,2 El cLDL y el CT se han identificado como los componentes principales en el desarrollo de aterosclerosis (acumulación de depósitos grasos en la íntima arterial). Fundamentalmente como consecuencia de esto, el cLDL y el CT aumentan el riesgo de las enfermedades isquémicas cardíacas, de los accidentes cerebrovasculares isquémicos y de otras enfermedades vasculares. Se estima que la hipercolesterolemia causa el 18% de la enfermedad cerebrovascular global y el 56% de la enfermedad cardíaca isquémica global. En conjunto, la cifra asciende a 4.4 millones de muertes, la cual representa el 7.9% del total de muertes en todo el mundo.3 Uno de los principales factores causales de la alta incidencia de hipercolesterolemia y, por lo tanto, del riesgo aumentado de aterosclerosis y ECV es un modelo cualitativamente deficiente de consumo de ácidos grasos, con alta proporción de ácidos grasos saturados (AGS) y ácidos grasos trans (AGT).4 Por otro lado, el consumo de lípidos con alto contenido de ácidos grasos monoinsaturados (AGMI) y, fundamentalmente, de ácidos grasos poliinsaturados (AGPI) se ha asociado con concentraciones bajas de cLDL y CT y, en consecuencia, con disminución de la incidencia de aterosclerosis en estudios humanos5,6 y animales.7 Desde que se conoce que el riesgo de ECV es multifactorial, diversas variables son materia de discusión en cuanto a su influencia sobre la susceptibilidad a las enfermedades coronarias, entre ellas los factores genéticos, el género, el estado hormonal, la homocisteína, la presión arterial, la obesidad o el sedentarismo.3,8 No obstante, este artículo examina la repercusión de la saturación de los ácidos grasos de la dieta sobre los factores de riesgo cLDL, CT y TAG. Durante la última década, los estudios clínicos y epidemiológicos constituyeron el fundamento para postular una relación entre el consumo de aceites vegetales y los niveles circulantes de lípidos plasmáticos. Los aceites comestibles disponibles en el comercio son diferentes en cuanto a la composición de ácidos grasos y sustancias no saponificables, y muestran diferentes consecuencias sobre el metabolismo lipídico. En especial, es sabido que la «dieta mediterránea», rica en AGMI, la cual se basa en el aceite de oliva como principal fuente de grasas en la dieta, se asocia con niveles plasmáticos reducidos de cLDL y triglicéridos.9,10 Además, se han informado las ventajas del aceite de oliva en relación a las enfermedades cardiovasculares11 y el cáncer de mama.12 En cambio, otros datos de experimentos controlados en seres humanos indican que, si el aceite de oliva es el componente principal de las grasas de la dieta, el colesterol total y el cLDL muestran niveles un tanto más altos que si la misma cantidad de grasa está constituida por aceite de canola o aceite de girasol, rico en ácido oleico, ambos monoinsaturados en forma predominante, pero con mayor contenido de AGPI que el aceite de oliva.13 En varios estudios realizados en seres humanos, los AGMI mostraron menor efecto reductor sobre el colesterol plasmático que los AGPI.14,15 Los niveles de cHDL se encuentran aumentados16 o no muestran cambios17 en las dietas ricas en AGMI o AGPI. Así, los aceites vegetales comestibles con composición modificada de ácidos grasos, como el aceite de colza (con poco contenido de ácido erúcico y rico en AGMI), el aceite de girasol (con alto contenido de ácido oleico) o las mezclas de aceites no muestran los mismos efectos sobre el metabolismo lipoproteico que los equivalentes convencionales o el aceite de oliva mismo.18,19 Breve descripción de sujetos y métodos Basados en esta incongruencia, planeamos un estudio de intervención humana con 28 individuos de sexo masculino, edad media de 23.7 años, para comprobar si una mezcla de aceites de oliva y girasol (relación 85:15) rica en AGMI, proporcionada a través de la dieta, influye sobre el plasma y las concentraciones lipídicas lipoproteicas en mayor grado que una dieta con aceite de maíz, abundante en AGPI. El experimento se realizó durante 42 días, seguidos de un período de seguimiento de 35 días, mientras que los períodos de ajuste y de intervención con entrecruzamiento duraron 14 días cada uno (figura 1). 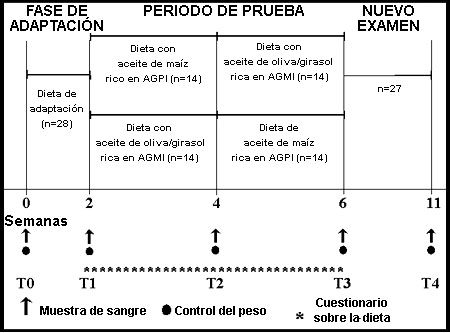 Figura 1. Diseño del estudio.20 Se informó a los individuos acerca del propósito, naturaleza y riesgos potenciales del estudio; además, dieron el consentimiento informado por escrito. El protocolo del estudio fue aprobado por el Comité de Etica de la Facultad de Medicina de la Universidad de Viena, Austria. Todos los participantes del estudio se encontraban en buenas condiciones de salud, según un cuestionario de antecedentes médicos y los resultados de análisis clínicos de laboratorio, eran normolipémicos y no fumadores, no presentaban enfermedad aguda o crónica alguna, se encontraban dentro de los límites normales del índice de masa corporal (20.3 ± 2.3), y no tomaron ninguna medicación ni suplementos vitamínicos o minerales durante las 4 semanas previas al comienzo y el transcurso del estudio. La elección de utilización de los aceites se basó en el perfil de ácidos grasos de cada uno, pero también para asegurar una diferente proporción de tocoferoles alfa y gamma (tabla 1). Para una descripción más detallada, véanse los artículos publicados.20-22 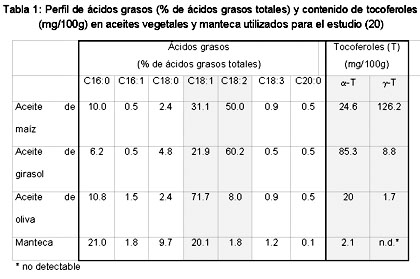 Resultados y discusión La totalidad de los voluntarios completó el estudio de manera exitosa y no comunicó efecto colateral alguno atribuible a las dietas, dentro del período de estudio. Todos mantuvieron el peso corporal y los cambios fueron inferiores a 0.6 kg. Esto último fue muy satisfactorio para nosotros y constituye una prueba favorable del diseño y realización del experimento. El consumo calórico diario medio de las dietas de prueba, salvo las fuentes de aceite, fue comparable con los antecedentes alimentarios respectivos (tabla 2). 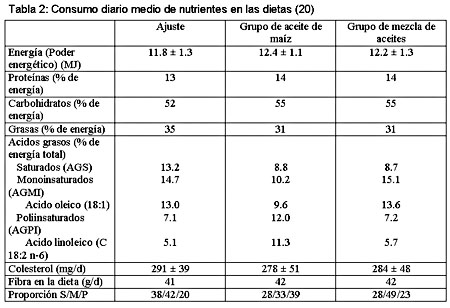 Desde el punto de vista del responsable del plan, esta compatibilidad fue de suma importancia para comparar y discutir los resultados. Numerosos estudios, basados en el efecto de las dietas de alto contenido de AGMI y AGPI sobre el colesterol total, se llevaron a cabo con individuos hipercolesterolémicos. Hemos realizado esfuerzos para estudiar el efecto de los aceites, incorporados a través de una dieta de equilibrio nutricional óptimo y sin modificar el consumo de otros nutrientes, en hombres jóvenes sanos, no fumadores y con niveles normales de colesterol. Excepción hecha de la ingestión de alimentos, los individuos mantuvieron las actividades habituales cotidianas. La proporción de grasas poliinsaturadas y saturadas (proporción P/S) de la dieta con aceite de maíz (AM) fue de 1.39, la de la dieta con mezcla de aceites (MA), 0.82, y durante un período de ajuste, 0.53. El contenido total de colesterol de las dietas se mantuvo constante durante el período de estudio (191-335 mg/día). El cumplimiento de la dieta se monitoreó mediante el análisis de ácidos grasos de las fracciones lipoproteicas LDL y HDL. La proporción promedio de ácido oleico (C 18:1n9) respecto del ácido linoleico (C 18:2n6) en las LDL fue de 0.46 ± 0.08 en la dieta de ajuste. La dieta AM se caracterizó por una proporción de 0.32 ± 0.02 significativamente menor que la dieta MA (0.62 ± 0.06) (p < 0.001). Luego del entrecruzamiento, se evaluó una evolución inversa significativa (p < 0.001) del perfil de ácidos grasos, correspondiente a los cambios de dieta (tabla 3). Tabla 3 Este fenómeno dependió de la diversa contribución de la dieta AM de alto contenido de ácido linoleico y de la dieta MA de alto contenido de ácido oleico, a los lípidos de las LDL. Estos últimos resultados dan cuenta de las incógnitas respecto de la duración del período de estudio, dado que fue posible demostrar que 14 días eran suficientes para cambiar el perfil de ácidos grasos en las fracciones de colesterol. Sólo el aceite de maíz, abundante en AGPI, fue capaz de reducir de manera significativa los niveles de cLDL, cVLDL, TAG y VLDL-TAG, y sólo los del CT no mostraron cambios significativos. Esto último puede obedecer al diseño de intervención breve; sin embargo, después del entrecruzamiento de las dietas de prueba, la dieta con aceite de maíz fue capaz de disminuir el CT en forma significativa, comparado con la mezcla de aceites de alto contenido en AGMI. De suma importancia, ni la dieta de alto contenido de AGMI ni la dieta de alto contenido de AGPI modificaron los niveles de HDL de manera significativa (tabla 4). Tabla 4 El efecto reductor de la colesterolemia observado en este estudio, por un lado, se basa en el alto contenido de AGPI del AM (proporción P/S = 4.2) pero, por el otro, también debe considerarse el alto contenido de sustancias no saponificables, como las quinonas, carotenoides, y principalmente de fitosteroles en el AM.23 En particular, la capacidad de los fitosteroles para disminuir las concentraciones de cLDL ya era conocida en las últimas décadas.24 En un estudio publicado recientemente, Howell y col. observaron un efecto reductor de la colesterolemia debido a la adición de fitosteroles al aceite de oliva, en comparación con el aceite de oliva sin el enriquecimiento con fitosteroles.25 Es sabido que el aceite de maíz es una de las fuentes más abundantes de fitosteroles entre los aceites vegetales, con una cantidad total superior a 800 mg cada 100 g de aceite.24 En el presente estudio no se evaluó el contenido total de fitosteroles en el régimen con aceite de maíz. El efecto de la reducción de cLDL por los AGPI no fue sorprendente, ya que había sido postulada por Mensink y Katan,26 quienes comprobaron que el nivel de cLDL aumentaba debido a los AGS, disminuía debido a los AGPI, y no presentaba cambios debido a los AGMI. Sin embargo, la ausencia de cambios respecto del cHDL fue bastante diferente de lo observado en algunos estudios previos, pero por otro lado, nuestros resultados también respaldan hallazgos anteriores que indican que las dietas abundantes en AGPI no disminuían los niveles de cHDL cuando el consumo de ácido linoleico es moderado (< 10- 13% de la calorías totales).17,25 En el estudio presentado, el consumo diario promedio de ácido linoleico en el grupo que consumía AM fue de 12.2% de las calorías diarias totales. Para concluir nuestros hallazgos, los resultados muestran un efecto reductor de la colesterolemia sólo en relación con el aceite de maíz, abundante en AGPI. La dieta con aceite de maíz también disminuyó los niveles plasmáticos de cLDL y cVLDL, así como los de VLDL-TAG, comparada con la dieta de mezcla de aceites, abundante en AGMI; en cambio, ambas dietas no modificaron la cHDL. Incluso, desde la publicación de este estudio,20-22 se publicaron varios artículos sobre este tema, enfocados fundamentalmente en las dietas abundantes en ácidos grasos omega-3 (AGO-3) y con alto contenido de aceite de oliva como el principal aceite vegetal consumido, abundante en AGMI. Puiggros y col. 27 compararon los dos últimos aceites en las dietas, y evaluaron la repercusión sobre el perfil de lípidos séricos y la oxidación de éstos. Comprobaron un efecto beneficioso sobre los lípidos séricos con la dieta de alto contenido de aceite de oliva, pero ausencia de cambios favorables adicionales en los lípidos séricos en 14 sujetos con hipercolesterolemia leve con aceite de pescado. Asimismo, la dieta enriquecida con AGO-3 aumentó la susceptibilidad oxidativa da la fracción de LDL. El Estudio de Nutrición Español describe un ensayo clínico en el cual pacientes españoles afectados por enfermedad vascular periférica (estadio Fontaine II) recibieron suplementos lipídicos específicos. Diseñado como un estudio de intervención longitudinal, los pacientes recibieron aceite de oliva durante 3 meses, seguidos por un período de lavado de otros 3 meses, y luego se les proporcionó un suplemento de combinación de aceite de pescado y aceite de oliva durante un período final de 3 meses. Se evaluaron los cambios plasmáticos y de la composición de ácidos grasos lipoproteicos, y la susceptibilidad de la LDL a la oxidación in vitro. Además, se midieron los cambios de las propiedades de la LDL inducidos por el suplemento lipídico, como la movilidad electroforética relativa y la captación de macrófagos. Por otro lado, trece pacientes que no fueron tratados con la mezcla de aceite de pescado y oliva se incluyeron como grupo control, y veinte individuos sanos - compatibles en cuanto a la edad- se tomaron como grupo de referencia. El consumo del suplemento de aceite de oliva produjo aumentos significativos de los niveles plasmáticos de ácido eicosapentanoico (20:5n-3) y ácido docosahexanoico (22:6n-3), en comparación con las concentraciones previas a la intervención, con el grupo de aceite de oliva y el grupo control. El consumo de aceite de pescado disminuyó en forma significativa los niveles plasmáticos de TAG, comparado con el período de consumo de aceite de oliva y con los grupos de control y referencia. La susceptibilidad de la LDL a la oxidación mediada por cobre fue menor en los pacientes que consumían el suplemento de aceite de oliva y pescado, que en el grupo control, y la captación de macrófagos fue significativamente menor en el grupo suplementado con aceite de pescado. Concluyeron que el consumo de aceite de oliva acompañado de un suplemento dietético de aceite de pescado puede ser útil para el tratamiento nutricional de los pacientes afectados por enfermedad vascular periférica, en términos del incremento de los ácidos grasos poliinsaturados de cadena larga n-3 y de la disminución de la susceptibilidad de la LDL a la oxidación.28 Este resultado fue notablemente diferente al del estudio mencionado anteriormente, el cual puede explicarse debido al consumo combinado de AGPI de cadena larga n-3 y de aceite de oliva, abundante en AGMI, que redujo la susceptibilidad de la LDL a la oxidación, debido al alto contenido de ácido oleico. Este resultado acerca de la peroxidación lipídica fue bastante similar al de nuestro estudio,21 donde también se evaluó la repercusión sobre los parámetros de oxidación lipídica. Sin embargo, ni la dieta de aceite de maíz, abundante en AGPI, ni la dieta de aceite de oliva y girasol, abundante en AGMI, disminuyeron la capacidad antioxidante total del plasma y LDL; el malondialdehído como indicador de oxidación lipídica, no estaba aumentado. Una explicación para estos hallazgos puede encontrarse en el alto contenido de antioxidantes y varios otros compuestos bioactivos de los aceites vegetales, y en el consumo adicional relativamente abundante. Esto parece ser suficiente para compensar la alta susceptibilidad para la oxidación lipídica debida a los AGPI. Otro abordaje consistió en observar si las comidas abundantes en aceite de oliva o de cártamo calentados proveen una dirección discriminadora de la oxidación del suero posprandial en hombres sanos.29 Este grupo comprobó que la susceptibilidad para la oxidación de las lipoproteínas en medios de baja capacidad antioxidativa, similares al suero diluido, puede estar aumentada en el período posprandial luego del consumo de alimentos abundantes en aceites vegetales modificados por el calor y en aceites no calentados con alto contenido de ácidos grasos poliinsaturados, pero no luego de la ingestión de alimentos con alto contenido de aceite de oliva natural. Basados en los datos bibliográficos en conjunto, las dietas con alto contenido de AGPI se recomiendan cada vez más para las poblaciones en riesgo de ECV. No obstante, es evidente la necesidad de una nueva evaluación de los beneficios de las dietas abundantes en AGMI, debido a estudios recientes que demuestran que los regímenes con alto contenido de aceite de oliva producen activación posprandial más intensa del factor VII de coagulación sanguínea que las dietas abundantes en ácidos grasos saturados. Kelly y col.30 evaluaron la evidencia de los efectos de las dietas con alta proporción de AGMI sobre los parámetros hemostáticos del ayuno y posprandiales, y describen datos de un estudio de intervención dietética controlada a largo plazo, recientemente finalizada. Los datos muestran que un régimen abundante en AGMI no presenta efectos adversos sobre las variables hemostáticas en el ayuno y que disminuye la activación posprandial del factor VII en respuesta a los alimentos con un contenido estándar de grasas. Dado que la observación también mostró significativa reducción de la activación de las plaquetas ex vivo en sujetos que consumían la dieta de alto contenido de AGMI, los autores concluyen que no hay motivos de preocupación respecto de las consecuencias adversas sobre la hemostasia de las dietas de alto contenido en AGMI. Desde el punto de vista nutricional, las dietas deberían ser abundantes en aceites vegetales con alta proporción de AGMI o de AGPI, preferibles a las dietas de saturación elevada, las cuales aumentan el riesgo de ECV. En consecuencia, un régimen que incluya una mezcla de una variedad de aceites vegetales con altas proporciones de AGMI y AGPI parece ofrecer mayor calidad que las dietas basadas en un sólo aceite vegetal. Pese a esto, también existen pruebas suficientes para recomendar fuentes alimenticias con alto contenido de compuestos bioactivos. Los aceites vegetales constituyen una de las fuentes más importantes de estos compuestos. Desde una perspectiva práctica, este hecho se traduce en la recomendación de una dieta abundante en aceites vegetales o de semilla mezclados. Bibliografía del artículo
|
![]()
[Bienvenidos a siicsalud]
[Acerca
de SIIC] [Estructura de
SIIC] [Círculo SIIC de
Lectores]
[Salud(i)Ciencia] [Trabajos
Distinguidos]
Sociedad Iberoamericana de
Información Científica (SIIC)
Av. Belgrano 430, (C1092AAR), Buenos
Aires, Argentina
Correo electrónico (e-mail): atencionallector@siicsalud.com;
Tels: +54 11 4342-4901; Fax: +54 11 4331-3305.
Correo SIIC: Casilla de Correo
2568, (C1000WAZ) Correo Central, Buenos Aires.
Copyright siicsalud© 1997-2003,
Sociedad Iberoamericana de Información Científica (SIIC)