 Resumen
Introducción: La diabetes mellitus tipo 2 es una de las enfermedades más frecuentes y con más complicaciones metabólicas que está presente en nuestros días. Se caracteriza por hiperglucemia persistente que puede conducir a daños en órganos, por lo que su realidad multisistémica representa un reto global en salud. La enzima glucosa-6-fosfatasa cataliza la última etapa de la neoglucogénesis y la glucogenólisis, formando parte del mecanismo homeostático de la glucosa en el torrente sanguíneo. Objetivo: Estudiar el efecto del extracto de algas sobre la actividad de la glucosa-6-fosfatasa existente en microsomas de hígado de rata de la cepa Sprague-Dawley. Métodos: Se realizó una investigación exploratoria de campo para analizar las propiedades antihiperglucemiantes del extracto de algas Caulerpa racemosa, Laurencia sp., Pterocladiella capilacea y Grateloupia doriphora. Estas especies fueron colectadas en la playa del estado La Guaira, Venezuela, durante el período enero-abril de 2020. A partir de los extractos obtenidos, se evaluó la actividad inhibitoria sobre la enzima glucosa-6-fosfatasa existente en microsomas hepáticos de ratas. Resultados: Entre los extractos analizados, se destacó el metanólico en DMSO de Caulerpa racemosa (especie invasora en Venezuela), con un porcentaje de inhibición en presencia de proteínas histónicas de 78.89%, y en su ausencia, un porcentaje
de 79.07%. Conclusiones: Estos hallazgos sugieren la existencia de metabolitos secundarios polares en esta alga, capaces de reaccionar con mayor acción sobre la subunidad catalítica de la glucosa-6-fosfatasa inhibiendo la capacidad neoglucogénica de los microsomas.
Resumen
Introducción: La diabetes mellitus tipo 2 es una de las enfermedades más frecuentes y con más complicaciones metabólicas que está presente en nuestros días. Se caracteriza por hiperglucemia persistente que puede conducir a daños en órganos, por lo que su realidad multisistémica representa un reto global en salud. La enzima glucosa-6-fosfatasa cataliza la última etapa de la neoglucogénesis y la glucogenólisis, formando parte del mecanismo homeostático de la glucosa en el torrente sanguíneo. Objetivo: Estudiar el efecto del extracto de algas sobre la actividad de la glucosa-6-fosfatasa existente en microsomas de hígado de rata de la cepa Sprague-Dawley. Métodos: Se realizó una investigación exploratoria de campo para analizar las propiedades antihiperglucemiantes del extracto de algas Caulerpa racemosa, Laurencia sp., Pterocladiella capilacea y Grateloupia doriphora. Estas especies fueron colectadas en la playa del estado La Guaira, Venezuela, durante el período enero-abril de 2020. A partir de los extractos obtenidos, se evaluó la actividad inhibitoria sobre la enzima glucosa-6-fosfatasa existente en microsomas hepáticos de ratas. Resultados: Entre los extractos analizados, se destacó el metanólico en DMSO de Caulerpa racemosa (especie invasora en Venezuela), con un porcentaje de inhibición en presencia de proteínas histónicas de 78.89%, y en su ausencia, un porcentaje
de 79.07%. Conclusiones: Estos hallazgos sugieren la existencia de metabolitos secundarios polares en esta alga, capaces de reaccionar con mayor acción sobre la subunidad catalítica de la glucosa-6-fosfatasa inhibiendo la capacidad neoglucogénica de los microsomas.
 Palabras clave
antihiperglucemiante, Caulerparacemosa, diabetes mellitus tipo 2, glucosa-6-fosfatasa, microsomas
Palabras clave
antihiperglucemiante, Caulerparacemosa, diabetes mellitus tipo 2, glucosa-6-fosfatasa, microsomas
 Abstract
Abstract
Introduction: Type 2 diabetes mellitus is one of the most frequent diseases and with the most metabolic complications that are present today. It is characterized by persistent hyperglycemia that can lead to organ damage, so its multisystem reality represents a global health challenge. The enzyme glucose-6-phosphatase catalyzes the last stage of neoglycogenesis and glycogenolysis, forming part of the homeostatic mechanism of
glucose in the bloodstream. Objective: To study the effect of the algae extract on the activity of glucose-6-phosphatase existing in rat liver microsomes of the Sprague-Dawley strain. Methods: An exploratory field investigation was carried out to analyze the antihyperglycemic properties of the seaweed extract Caulerpa racemosa, Laurencia sp., Pterocladiella capilacea, and Grateloupia doriphora. These species were collected on the
beach of La Guaira state, Venezuela, from January to April 2020. From the extracts obtained, the inhibitory activity on the glucose-6-phosphatase enzyme existing in rat liver microsomes was evaluated. Results: Among the extracts analyzed, the methanolic in DMSO of Caulerpa racemosa (invasive species in Venezuela) stood out, with a percentage of inhibition in the presence of histone proteins of 78.89%, and in their absence, a
percentage of 79.07%. Conclusions: These findings suggest the existence of polar secondary metabolites in these algae, capable of reacting with greater action on the catalytic subunit of glucose-6-phosphatase, inhibiting the neoglycogenic capacity of microsomes.
 Key words
Key words
antihiperglycemic, Caulerparacemosa, diabetes mellitus type 2, glucose-6-phosphatase, microsomes
Artículo completo
EFECTO DE EXTRACTOS ALGALES SOBRE LA ACTIVIDAD DE LA GLUCOSA-6-FOSFATASA PRESENTE EN MICROSOMAS DE HIGADO DE RATAS
(especial para SIIC © Derechos reservados)
Introducción
La diabetes mellitus (DBT) es un problema médico reconocido desde hace miles de años, cuya concepción ha cambiado gracias a la evolución científica. En la actualidad, describir la DBT implica abordar un conjunto de trastornos y desregulaciones metabólicas que subyacen en esta enfermedad. El denominador común de estos desequilibrios es el aumento de los niveles de glucosa en la sangre. En etapas avanzadas de hiperglucemia, pueden manifestarse síntomas como poliuria, polidipsia, fatiga, pérdida de rendimiento, pérdida de peso inexplicable, alteraciones visuales y mayor susceptibilidad a infecciones, entre otros. La hiperglucemia sostenida conlleva también alteraciones en la secreción o acción de la insulina, que se asocia a largo plazo con daño y disfunción en diversos tejidos y órganos, incluidos los ojos, los riñones, los nervios, el corazón y los vasos sanguíneos, así como con mayor riesgo de presentar cáncer.1
Debido a los avances en genética, se cuenta con información de la existencia de un modo diferente de herencia para la DBT, una que ocurría en la madurez de los pacientes y otras en la juventud: diabetes mellitus tipo 2 (DBT2) o no dependiente a la insulina (debido a la destrucción autoinmune de las células ß), diabetes mellitus tipo 1 (DBT1) o dependiente de la insulina (debido a una pérdida progresiva no autoinmune de la secreción adecuada de insulina de las células ß), diabetes gestacional y otros tipos específicos por otras causas (síndromes de diabetes monogénica, enfermedades del páncreas exocrino).2
Mientras el páncreas mantiene una secreción de insulina suficiente, para vencer la resistencia insulínica, el individuo con DBT2 se mantiene en condición de no insulinodependencia, pero con el paso de los años la secreción de insulina se hace insuficiente para controlar la glucemia y es allí cuando la situación funcional del paciente diabético cambia a insulinodependiente y se exacerba la hiperglucemia. Aunque, normalmente, esta situación aparece a una edad avanzada, cada vez se hace menor la edad de diagnóstico, y aparece en jóvenes y adolescentes con obesidad y predisposición genética.3
La causa principal de la hiperglucemia en la DBT2, si se encuentra en ayunas, es la tasa elevada en la producción basal de glucosa hepática; aun en presencia de hiperinsulinemia y después de una ingesta de comida, la supresión disminuida de la producción de glucosa hepática y la fijación disminuida de glucosa mediada por la insulina en el tejido muscular contribuyen a que aparezca la hiperglucemia posprandial. Aunque la hiperglucemia también posee su propio efecto independiente de supresión de la producción de glucosa hepática y de estimulación de fijación de glucosa por parte del tejido muscular, el efecto es modesto en comparación con los de la insulina.
Se atribuye a la neoglucogénesis acelerada ser la principal anormalidad responsable de la tasa incrementada de producción de glucosa hepática basal.2 Pero después de la ingestión de alimentos, el mantenimiento de la tolerancia normal a la glucosa depende de tres eventos que se presentan enforma interrelacionada: a) estimulación de la secreción de insulina; b) supresión de la producción de glucosa endógena mediada por la insulina (principalmente hepática) y c) estimulación de la fijación de la glucosa en los tejidos periféricos, mediada por la insulina principalmente en los tejidos muscular y adiposo. Por ello, resulta de interés buscar posibles alternativas que orienten la disminución favorable de la cantidad de glucosa en sangre, como a través de la inhibición de enzimas claves de esta vía metabólica, que puedan perfilarse como futuros tratamientos para pacientes con DBT2. Así, el objetivo de la presente investigación fue estudiar el efecto de las algas Caulerpa racemosa, Laurencias p., Pterocladiella capilacea y Grateloupia doriphora, presente en las costas del estado La Guaira, en Venezuela, sobre la actividad de la enzima glucosa-6-fosfatasa (enzima neoglucogénica y glucogenolítica), en microsomas de hígado de ratas.
Glucosa-6-fosfatasa
La existencia de la enzima glucosa-6-fosfatasa (EC 3.1.3.9) en núcleos y envoltura nuclear fue reportada desde 1964 por Widnell y Tata,4 lo que representa hasta el 20% del total de la enzima hepática; el 80% restante se encuentra ubicado en la fracción microsomal.5 Esta enzima hidrolítica es una proteína integral de membrana del retículo endoplasmático, que se supone contiene nueve hélices transmembrana, con su sitio activo en el lado luminal del retículo, conocido como subunidad catalítica. Esta enzima cataliza el paso final de los procesos de neoglucogénesis y glucogenólisis produciendo glucosa y fosfato inorgánico. La reacción se puede medir mediante la aparición del sustrato o de los productos. La glucosa-6-fosfato que se forma en el citosol entra a la luz del retículo endoplasmático por el transportador T1 y es hidrolizada por la subunidad catalítica en glucosa y fósforo inorgánico. La glucosa es transportada al citosol por el transportador T3; el fósforo inorgánico, el pirofosfato y el carbamilfosfato, por el transportador T2. Posteriormente, la glucosa sale de la célula por medio del transportador GLUT2 hacia la sangre.6
Algas y diabetes
Las macroalgas, o algas marinas, son un grupo filogenéticamente heterogéneo e importante para mantener el equilibrio de las sustancias y los organismos presentes en los océanos. Representan una prometedora fuente de nutrientes, que alberga proteínas, fibras, vitaminas, minerales, fitoquímicos y ácidos grasos que proporcionan defensa frente a diversas enfermedades neurodegenerativas.7 Debido al incremento a nivel mundial de pacientes con diabetes y el número limitado de fármacos, en años recientes se ha masificado el interés en el estudio de las propiedades antidiabéticas de las algas y su uso terapéutico alternativo.8,9 En el caso de las especies de estudio, Caulerpa racemosa es la que cuenta con mayor cantidad de ensayos, respecto a sus propiedades hipoglucemiantes, en la literatura reciente.10-12
Método
Muestras de algas
Las muestras de algas Caulerpa racemosa, Laurencias p., Pterocladiella capilacea y Grateloupia doryphora fueron recolectadas en las playas del estado La Guaira, durante los meses de enero a abril del año 2020, con el fin de disponer de mayor crecimiento de las floras (debido al período de surgencia marina alto en la región). Fueron recolectadas a mano, lavadas con agua salada y luego con agua bidestilada, para eliminar cualquier tipo de interferencias como rocas y otras especies, tanto vegetales como animales. Seguidamente, se depositaron en bolsas plásticas por separado, dentro de cavas termoajustables a -15 °C, para su traslado. Se determinó su masa total y fueron guardadas a -30 °C para posterior análisis. La identificación taxonómica de las especies estuvo a cargo del Prof. Juan Linares, de la Universidad Pedagógica Experimental Libertador.
Preparación de microsomas
Los microsomas (fuente de la enzima glucosa-6-fosfatasa) se prepararon siguiendo la metodología propuesta,4,13 a partir de ratas macho de la cepa Sprague-Dawley (180-200 g), sometidas a 24 horas de ayuno y sacrificadas por dislocación cervical para evitar el uso de fármacos o sustancias. El hígado se extrajo en frío y se determinó su masa total. Se lavó con sacarosa 0.32 M y MgCl2 3 mM. Posteriormente, se homogenizó usando 25 pases de un homogenizador teflón-vidrio rotando a 1200 rev/min, con sacarosa 0.32 M, MgCl2 3 mM (3 ml x g de hígado) y se centrifugó a 20000 g por 20 min entre 4 °C y 8 °C. El líquido sobrenadante se ultracentrifugó a 105000 g por 60 min entre 4 °C y 8 °C, y el sedimento obtenido fue nuevamente suspendido, pero con sacarosa 0.25 M, ácido N-2-hidroxietilpiperacina-N’-2’-etanosulfónico (HEPES) 5 mM y MgCl2 1mM a pH 6.5, para posteriormente ser almacenados a -80 °C. Todos los ensayos fueron realizados bajo protocolo bioético aprobado por el Instituto de Medicina Experimental-Consejo de Desarrollo Científico y Humanístico-Universidad Central de Venezuela (CDCH-UCV).
Fraccionamiento de los extractos de las algas
Se procedió a obtener un primer extracto acuoso con el fin de determinar las especies que ejercen mayor inhibición en la actividad enzimática, adicionando una cantidad de agua equivalente a cinco veces su masa y sometiendo a calentamiento moderado por 15 min. Se midió la actividad enzimática en el líquido obtenido. Seleccionada la muestra de alga con mayor actividad, se orientó el fraccionamiento con una primera extracción en metanol, desechando el sólido y secando el líquido. Luego se continuaron las extracciones con 10 mg de los sólidos con solventes de extracción (250 ml de metanol, 20 ml de acetona, 25 ml de cloroformo y 7.5 ml de etanol) en 10 ml de dimetilsulfóxido (DMSO), midiendo la actividad enzimática en cada uno.
Ensayo de la actividad enzimática
Para conocer la actividad de los componentes presentes en los extractos de las algas sobre la glucosa-6-fosfatasa, se empleó microsomas intactos y microsomas rotos, con ello se estableció si la inhibición es sobre los transportadores o sobre la subunidad catalítica de la enzima.14 El sustrato empleado contenía glucosa-6-fosfato a 5 mM (concentración final), tanto en ausencia de histonas como en su presencia (para romper la integridad de la membrana microsomal), preparados de la siguiente manera: 250 µl de glucosa-6-fosfato 100 mM a pH 6.5; 100 µl de ácido etildiaminotetraacético (EDTA) 0.1 M a pH 6.5; 80 µl HEPES 1 M a pH 6.5; 1750 µl de H2O; 200 µl histonas tipo II AS 20 mg/ml.
Se colocó en tubos de ensayo una cantidad del sustrato con el extracto ficológico para ser empleados como blancos y muestras experimentales, y otros en los que se adicionó agua o el solvente empleado en la extracción. Seguidamente, se añadieron los microsomas preparados en los tubos de ensayo de control a intervalos de tiempo de 15 s por cada tubo. Se dejó incubar por 10 min a 30 °C y se agregó a cada tubo el reactivo de parada (el cual contiene [NH3] Mo7O24·4H2O 0.42% en H2SO4 0.5 M, SDS 5% y ácido ascórbico 10%, en una proporción de 6:2:1). Se incubó nuevamente por 20 min a una temperatura de 46 °C. Se determinó la absorbancia del complejo molibdato de amonio-fosfato formado, por el fosfato liberado, mediante espectrofotometría de luz UV visible a 820nm. La actividad de la enzima se expresó en términos de actividad específica (µmol de Pi/h x mg de proteínas).15,16 La ruptura de los microsomas por parte de los compuestos presentes en los extractos acuosos de las algas se estimó tomando como sustrato manosa-6-fosfato 100 mM a pH 6.5, EDTA 0.1 M a pH 6.5, HEPES 1 M a pH 6.5, H2O e histonas tipo II AS 20 mg/ml,17debido a que la manosa-6-fosfato no entra a la cisterna del retículo endoplasmático.18
Métodos analíticos
La concentración de fosfatos se determinó comparando con una curva de calibración con un rango de concentración de 0.1 a 0.75 mM de KH2PO4, a la cual se le añadió el reactivo de parada. Se incubó a 46 °C por 20 min. La cantidad de proteínas presentes en los microsomas de cada ensayo se determinó por medio del método de Lowry, en el cual se combina la reacción de Biuret y la acción reductora del reactivo de Folin-Ciocalteu.
Resultados
Para estimar la acción de los extractos algales sobre la enzima glucosa-6-fosfatasa, se calculó el porcentaje de inhibición en la enzima, para la cual el extracto acuoso de Caulerparacemosa fue la muestra que arrojó porcentajes más altos y próximos entre sí (en presencia de histonas, de 32.0%, y en ausencia de estas, de 31.5%) (Tabla 1). Los extractos de Laurencias p., Grateloupia doryphora y Pterocladiella capilacea arrojaron valores más bajos en los ensayos, con mayor diferencia en ausencia y presencia de histonas, y significativos solo en microsomas rotos. Otros parámetros estimados fueron la latencia (porcentaje de la actividad presente en microsomas totalmente rotos que no se expresa en los intactos) y la actividad específica (cantidad de producto formado en el tiempo por miligramo de proteína presente). El extracto acuoso de C. racemosa tuvo mayor porcentaje de latencia y menor actividad específica, tanto en ausencia como en presencia de histonas. Esto sugiere la existencia de metabolitos secundarios, capaces de inhibir la acción de la glucosa-6-fosfatasa o actuar sobre el transportador T1.14
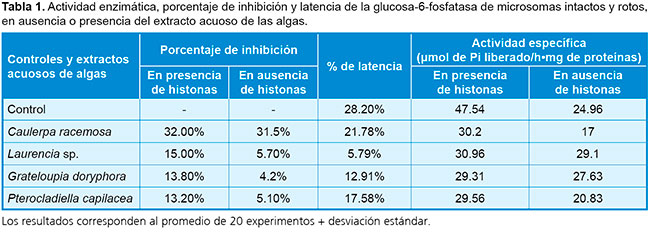
Para estimar la acción de los extractos acuosos de Caulerpa racemosa, Laurencias p., Grateloupia doryphora y Pterocladiella capilacea sobre la membrana de los microsomas y la subunidad catalítica, se realizó un ensayo con manosa-6-fosfato como sustrato. Se obtuvieron valores significativos solo para la muestra del alga C. racemosa, con un porcentaje de inhibición del 9.1% en presencia de histonas, y del 8.2% en ausencia de estas. Esto puede explicarse, al suponer que existen uno o varios compuestos presentes en el extracto de la mencionada alga, que inhiben la acción de la subunidad catalítica de la glucosa-6-fosfatasa.19,20
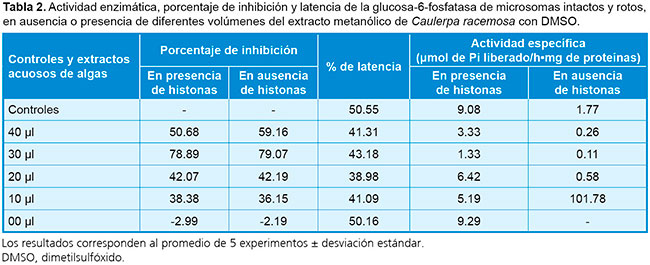
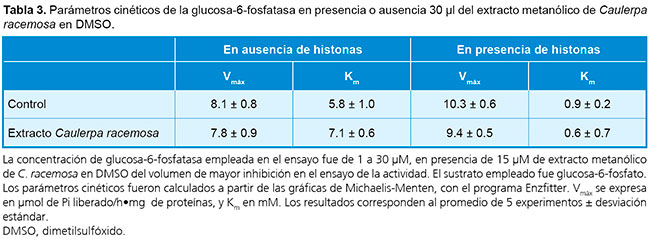
Considerando los resultados anteriores, se decidió continuar el bioensayo solamente con Caulerpa racemosa, para intervalos de 0 a 40 µl de extracto metanólico en DMSO (Tabla 2). Resulta más relevante el empleo de 30 µl del mencionado extracto con DMSO, ya que mostró una fuerte inhibición de la glucosa-6-fosfatasa, tanto en presencia (78.89%) como en ausencia de histonas (79.07%), y menor actividad específica. Los resultados obtenidos con los solventes acetona, cloroformo y etanol de C. racemosa fueron inferiores numéricamente en comparación con los metanólicos, y se destacó el porcentaje de inhibición del extracto etanólico, con 24.52% en presencia de histonas y 26.41% en su ausencia. En cuanto a los parámetros cinéticos estimados (Tabla 3), se observó un aumento significativo de Km y poca alteración del Vmáx en microsomas intactos, lo que indica la inhibición competitiva de la subunidad catalítica de la glucosa-6-fosfatasa, adicional al efecto sobre el transportador T1.14
Conclusiones
De las muestras de algas analizadas, solo la de C. racemosa recolectada durante el período alto de surgencia marina en la zona mostró valores realmente significativos de inhibición sobre el sistema de la glucosa-6-fostasa, tanto en el transportador T1 como en la subunidad catalítica, durante el ensayo de la actividad enzimática propuesto. Esto permite considerar la realización de futuros estudios para determinar el o los metabolitos presentes en C. racemosa, causantes del efecto inhibitorio, y orientarse una posible diana de tratamiento antihiperglucemiante para pacientes con DBT2.
|
 Bibliografía del artículo
Bibliografía del artículo
1. Harreiter J, Roden M. Diabetes mellitus: definition, classification, diagnosis, screening and prevention. WienKlinWochenschr 135(suppl1):7-17, 2023.
2. ElSayed NA, Aleppo G, Aroda VR, Bannuru RR, Brown FM, et al. Classification and diagnosis of diabetes: standards of care in diabetes-2023. Diabetes Care 46(suppl 1):19-40, 2023.
3. Chiquete J, Nuño P, Panduro A. Perspectiva histórica de la diabetes mellitus: comprendiendo la enfermedad. InvestigaciónenSalud 3:5-10, 2001.
4. Widnell C, Tata J. A procedure for the isolation of enzymically active rat-liver nuclei.Biochem J 92(2):313-317, 1964.
5. González-Mujica F. Glucosa-6-fosfatasa de envoltura nuclear de hígado de ratas. InvestClínica 49(2):169-180, 2008.
6. Foster J, Nordlie R. The biochemistry and molecular biology of the glucose-6-phosphatase system.E Biol Med 227(8)601-608, 2002.
7. Bocanegra A, Macho González A, Garcimartín A, Bendi J, Sánchez-Muniz F. Whole alga, algal extracts, and compounds as ingredients of functional foods: composition and action mechanism relationships in the prevention and treatment of type-2 diabetes mellitus. Int J MolSci 22(8):3816, 2021.
8. Sun Z, Chen F. Evaluation of the green alga Chlorella pyrenoidosa for management of diabetes. J Food Drug Anal 20(suppl 1):246-249, 2012.
9. Lauritano C, Ianora A. Marine organisms with anti-diabetes properties. Mar Drugs 14(12):220, 2016.
10. Qudus B, Aroyehun A, Abdul Razak S, Palaniveloo K, Nagappan T, et al. Bioprospecting cultivated tropical green algae, Caulerparacemosa (Forsskal) J. Agardh. A perspective on nutritional properties, antioxidative capacity and anti-diabetic potential. Foods 9(9):1313, 2020.
11. Dissanayake IH, Bandaranayake U, Keerthirathna LR, Manawadu C, Silva RM, et al. Integration of in vitro and in-silico analysis of Caulerparacemosa against antioxidant, antidiabetic, and anticancer activities. Sci Rep 12(1):20848, 2022.
12. Permatasari HK, Nurkolis F, Hardinsyah H, Taslim NA, Sabrina N, et al. Metabolomic assay, computational screening, and pharmacological evaluation of Caulerparacemosa as an anti-obesity with anti-aging by altering lipid profile and peroxisome proliferator-activated receptor-B3; coactivator 1-B1; Levels. Front Nutr 9:939073, 2022.
13. Marcucci O, González-Mujica F, Perez-Ayuso E. Alterations of liver nuclear envelopes accompanying thioacetamide administration in rats. Acta CientVenez 34(2):109-117, 1983.
14. González-Mujica F, Motta N. Actividad antihiperglicemiante de Bauhiniamegalandra. Vitae 43, 2010.
15. Burchell A, Hume R, Burchell B. A new microtechnique for the analysis of the human hepatic microsomal glucose-6-phosphatase system.ClinChimActa 173(2):183-192, 1988
16. Taussky HH, Shorr E, Kurzmann G. A microcolorimetric method for the determination of inorganic phosphorus. J BiolChem 202(11):675-685, 1953.
17. Arion WJ, Schulz LO, Lange AJ, Telford JN, Walls HE. The characteristics of liver glucose-6-phosphatase in the envelope of isolated nuclei and microsomes are identical. J BiolChem 258(9):12661-12669, 1983.
18. Igarashi Y, Kato S, Narisawa K, Tada K, Amano Y, et al. A direct evidence for defect in glucose-6-phosphate transport system in hepatic microsomal membrane of glycogen storage disease type IB. BiochemBiophys Res Commun 119(2):593-597, 1984.
19. Westergaard N, Madsen P, Lundbeck JM, Jakobsen P, Varming A, Andersen B. Identification of two novel and potent competitive inhibitors of the glucose-6-phosphatase catalytic protein. Diabetes ObesMetab 4(2):96-105, 2002.
20. Singh J, Nordlie RC, Jorgenson RA. Vanadate: a potent inhibitor of multifunctional glucose-6-phosphatase. BiochimBiophys Acta 678(3):477-482, 1981.
|
|






































