Casos Clínicos
ULCERAS DE PIE DIABETICO Y PLASMA RICO EN PLAQUETAS
El plasma rico en plaquetas es un preparado autólogo de fácil obtención y aplicación, si se cuenta con recursos materiales tales como una centrífuga, pipetas, anticoagulante, gluconato de calcio, jeringas, agujas y personal con experiencia en cuidados de las heridas crónicas. Es un producto de eficacia comprobada que brinda la posibilidad de curar úlceras de pie diabético sin necesidad de trasladarse a centros de mayor complejidad.
Coautores
Daiana Magali Posdeley* Claudia Mariela Torres** Mercedes Ledesma***
Licenciada en Enfermería, Hospital Seccional Eduardo Canosa, Puertro Santa Cruz, Bahamas*
Licenciada en Enfermería, Hospital Seccional Eduardo Canosa, Puerto Santa Cruz, Argentina**
Enfermera universitaria, Hospital Seccional Eduardo Canosa, Puerto Santa Cruz, Argentina***
Daiana Magali Posdeley* Claudia Mariela Torres** Mercedes Ledesma***
Licenciada en Enfermería, Hospital Seccional Eduardo Canosa, Puertro Santa Cruz, Bahamas*
Licenciada en Enfermería, Hospital Seccional Eduardo Canosa, Puerto Santa Cruz, Argentina**
Enfermera universitaria, Hospital Seccional Eduardo Canosa, Puerto Santa Cruz, Argentina***
Clasificación en siicsalud
Artículos originales > Expertos del Mundo >
página /dato/casiic.php/173115
Especialidades






Artículos originales > Expertos del Mundo >
página /dato/casiic.php/173115
Especialidades






Primera edición en siicsalud
8 de noviembre, 2023
8 de noviembre, 2023
Introducción
El plasma rico en plaquetas (PRP) se encuentra en desarrollo desde la década del 80, asociado con aplicaciones en medicina cardíaca, cirugía máxilo-facial y dermatología.El PRP es una preparación autóloga, con una concentración de plaquetas por sobre el valor normal en sangre periférica.Las primeras aplicaciones fueron realizadas bajo un protocolo de centrifugación única por 7 minutos a 1400 rpm en procedimientos odontológicos.1 Una revisión sistemática del año 2017 valoró los distintos métodos de preparación, dando como resultado una mediana de 51 ml de sangre extraída, el uso de citrato de dextrosa y una única centrifugación de 3200 rpm durante 15 minutos.2
Un metanálisis de distintos métodos de centrifugación estableció que las muestras centrifugadas dos veces consecutivas a 160 xg (fuerza g) durante 10 minutos y 250 xg durante 15 minutos, mostraron plaquetas y factores de crecimiento con mejor función.3Luego, el plasma puede activarse por medio de trombina o cloruro cálcico (liberación plaquetaria) o por lisis física (ultrasonido, frizado). El producto es aplicado en solución o gel.
El PRP contiene factores de crecimiento, citoquinas y proteínas de adhesión que, al aplicarse en la lesión, favorecen la hemostasia, la síntesis de tejido conectivo y la revascularización.Numerosos estudios lo definen solo con la presencia de plaquetas, mientras otros tienen en cuenta las concentraciones de glóbulos rojos, leucocitos, fibrina y proteínas para su definición.
La primera mención es del año 1954 en la revista Nature, donde se acuñó el término PRP.4 Más tarde, se propuso un sistema de clasificación teniendo en cuenta plaquetas, leucocitos y fibrina.5 Se formularon otras clasificaciones, como el sistema PAW, que valora el contenido de plaquetas, su activación y la existencia de leucocitos.6 Otros autores demostraron la importancia del recuento de plaquetas, la presencia de leucocitos, neutrófilos y glóbulos rojos, y su activación.7 La clasificación DEPA se basa en la cantidad de plaquetas inyectadas, el mecanismo de producción, la pureza del PRP y su activación.8 La clasificación de MARSPILL gravita sobre la presencia de células mononucleares en sangre periférica.9 Por último, el comité de estandarización científica recomendó el sistema de clasificación de la Sociedad Internacional de Trombosis y Hemostasia, que presenta consensos sobre el proceso de preparación y aplicación en medicina regenerativa. Aun en la actualidad no fue posible establecer un sistema de clasificación que permita la estandarización del PRP.
El PRP de aplicación clínica propuesto por Everts en el año 2020, debe cumplir con los requisitos de determinación alta de plaquetas, mínima concentración de glóbulos rojos y presencia de leucocitos, para tener buenos resultados.10
La necesidad de minimizar la presencia de glóbulos rojos esconsecuencia de la lesión de su membrana celular durante el proceso de centrifugación, que provoca la liberación de hemoglobina toxica.11 Esta última genera estrés oxidativo, perdida de óxido nítrico y activación de procesos proinflamatorios. Será responsable de la eriptosis, que provoca la liberación de un factor de inhibición de migración de macrófagos con bloqueo en la migración de células madre, la proliferación de fibroblastos y los efectos citotóxicos locales.11
Los neutrófilos son importantes en los procesos de curación y representan una barrera contra patógenos. Tienen funciones angiogénicas y restauran tejidos. Pueden tener efectos dañinos al liberar citoquinas y metaloproteasas con efectos catabólicos.12
Los linfocitos actúan a través de citoquinas reforzando la polarización macrofágica,13 y son efectores importantes en el proceso de curación de la herida.
En relación con la seguridad, existen numerosas revisiones que evalúan dicho desenlace y refieren no presentar reacciones adversas significativas.14
El presente artículo tiene por finalidad transmitir el protocolo que usamos actualmente en nuestra institución para el tratamiento de úlceras de pie diabético con PRP, y destacar la facilidad de preparación y aplicación de este último,lo cual permite su uso en centros de primer nivel como en el que actualmente implementamos el tratamiento.
Presentación del protocolo y casos
Nuestra experiencia comenzó con la aplicación del PRP en procedimientos traumatológicos, con buenos resultados. Posteriormente, se realizó una revisión sistemática sobre el tratamiento de úlceras de pie diabético con PRP gel, en comparación con cuidados estándar, que permitió evaluar su efectividad en úlceras de pie diabético.15 Luego, se constituyó el consultorio de curación de heridas, integrado por enfermeras capacitadas en el tratamiento de heridas, médico traumatólogo con formación en pie y por diabetólogo diplomado en pie diabético y curación de heridas. Posteriormente se resolvió el abordaje terapéutico de úlceras de pie diabético con PRP.
Se utilizó el protocolo de centrifugación única durante 7 minutos a 1400 rpm.1 Primero se valora la herida mediante el protocolo TIME (tejido, infección, humedad, bordes), que nos proporciona una guía para el tratamiento. Es importante desbridar la herida antes de la aplicación de cualquier apósito o fármaco, y el PRP no está exento de dicha premisa.
Se extrae sangre con jeringas de 10 ml; una jeringa equivale a 3 tubos de muestra. Se realizan en total 2 extracciones, con la aclaración de que la cantidad a extraer depende del tamaño de la herida. Se obtiene la sangre en tubos de citrato de sodio al 3.8%; luego, se centrifuga según protocolo.Se recupera el plasma y se obtienen 2 ml por tubo. Debemos tener precaución en la extracción y evitar contaminación con glóbulos rojos. Posteriormente se activa congluconato de calcio, según la siguiente proporción:3 ml plasma/0.4 ml gluconato cálcico.Se obtienen 6 ml de plasma y se mezclan con 0.8 ml de gluconato de calcio (de acuerdo con la proporción), y se dejan 45 minutos a temperatura ambiente hasta la formación del gel.Se aspira el líquido y se infiltran los bordes de la herida y el lecho. Luego, se manipula el gel colocándolo sobre la herida y se tapa con gasa estéril. Se deja esta curación por 7 días, lo que genera un beneficio adicional, ya que el paciente se valora una vez a la semana. En cada control se realiza desbridamiento de la herida, ya que se forman detritos que deben ser removidos.
Presentaremos tres casos de úlceras de pie diabético tratados con el protocolo descripto.
Caso 1
El primer caso corresponde a un paciente de sexo masculino, de 38 años, conantecedentes de diabetes tipo 1, nefropatía diabética, neuropatía sensitiva de miembros inferiores y úlceras plantares recurrentes, que ingresa por fiebre, malestar general y úlcera en planta de pie izquierdo. Se observa tres úlceras, en la base del hallux, la cara lateral del hallux y el dorso, que se conecta con la herida en la cara lateral. Presenta edema y eritema marcado (Figuras 1 y 2).
El paciente no refiere dolor a consecuencia de la neuropatía sensitiva. Se constató pérdida de la sensibilidad bilateral, pulsos pedios y tibiales posteriores conservados; se solicita eco-Doppler vascular, que se informa sin alteraciones. Se realiza control de temperatura con cámara termográfica en región plantar, constatándose un aumento de la temperatura de 35.6°C (Figura 3).
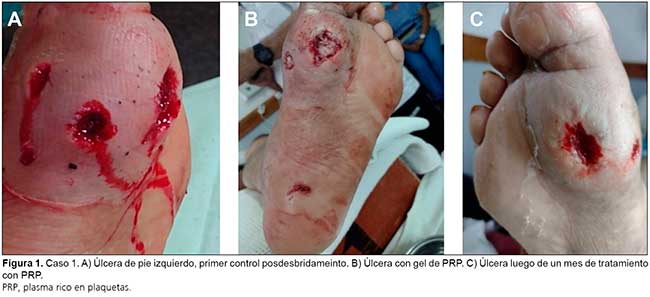
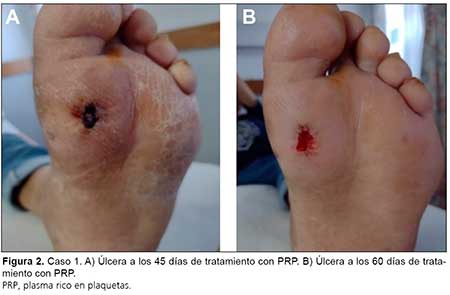
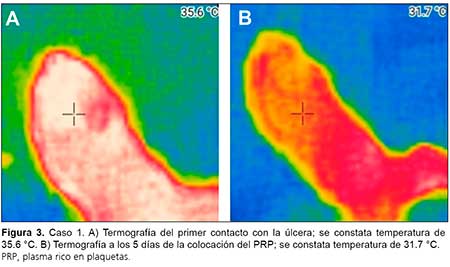
Se realiza limpieza de la herida con solución fisiológica y clorhexidina. Luego, se realiza desbridamiento quirúrgico y se procede a la aplicación de PRP en forma inyectable y en gel en todas las úlceras, y se tapa con gasa estéril. Se indicó al paciente la descarga del pie, y se programa curación en 5 días. En el control se observa disminución del edema y descenso de la temperatura plantar a 31.7 °C. Se pone de manifiesto la reducción de la superficie de la herida y la presencia de detritos, que fueron desbridados apropiadamente. Durante el transcurso de 2 meses, se efectuaron curaciones una vez por semana, con mejoría sostenida. El paciente fue dado de alta, con plantillas de descarga y controles mensuales.
Caso 2
El segundo caso corresponde a una paciente de 74 años, con antecedentes de diabetes tipo 2, que consulta por úlcera en la cara plantar del hallux.
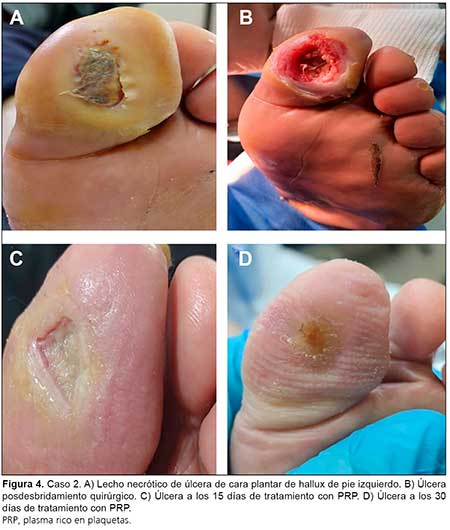
Se interconsulta con servicio de traumatología, el cual realiza toilette quirúrgico extenso y se procede a colocación de PRP semanal, acompañada de miel, con control cada 48 horas.Luego de un mes de tratamiento con evolución satisfactoria, se da el alta (Figura 4).
Caso 3
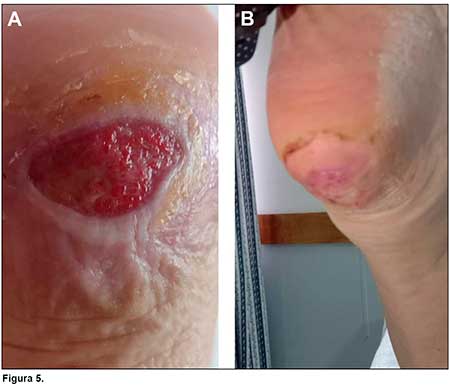
El tercer caso corresponde a una paciente de 88 años, con antecedentes de diabetes tipo 2 y movilidad reducida, que presenta ampollas en ambos talones, las cuales, luego de ser pinchadas por la médica de guardia para evaluar su contenido,presentan infección local que evoluciona formando una úlcera. La paciente continúa con curaciones estándar por 3 meses, sin mejoría. Se requiere valoración por nuestro consultorio. Se solicita eco-Doppler, que informa calcificaciones en territorios arteriales de miembros inferiores y se constata trastorno de la sensibilidad. La herida presenta fondo fibrinoso, sin signos de infección, con bordes hiperqueratinizados. Se procede al desbridamiento quirúrgico y a la aplicación de PRP inyectable y en gel. Luego de un mes de tratamiento con buena respuesta se da el alta, con aplicación de cremas de urea al 10% y controles mensuales.
Conclusión
Se pone en evidencia una respuesta más rápida en las heridas profundas que en las superficiales. Asimismo, el PRP permite asociar otros productos. Nuestra práctica sugiere que el uso combinado de apósitos con miel brinda la humedad necesaria para la herida.El procedimiento no presenta complejidad, aunque no está exento de complicaciones, por lo que es importante informar adecuadamente al paciente, firmar el consentimiento informado y valorar cada 48 horas la evolución de la herida. Las limitaciones para la preparación radican en la falta de elementos para centrifugar la muestra, así como de recursos materiales necesarios para su activación. Mantener condiciones de asepsia durante el procedimiento minimizará el riesgo de sobreinfección de la herida. La aplicación de PRP demostró utilidad en múltiples escenarios, por lo que su uso debe considerarse en cualquier institución que cuente con los elementos necesarios para su preparación y con profesionales que busquen ampliar las opciones para el tratamiento de las úlceras crónicas, incluso en el primer nivel de atención.
El plasma rico en plaquetas (PRP) se encuentra en desarrollo desde la década del 80, asociado con aplicaciones en medicina cardíaca, cirugía máxilo-facial y dermatología.El PRP es una preparación autóloga, con una concentración de plaquetas por sobre el valor normal en sangre periférica.Las primeras aplicaciones fueron realizadas bajo un protocolo de centrifugación única por 7 minutos a 1400 rpm en procedimientos odontológicos.1 Una revisión sistemática del año 2017 valoró los distintos métodos de preparación, dando como resultado una mediana de 51 ml de sangre extraída, el uso de citrato de dextrosa y una única centrifugación de 3200 rpm durante 15 minutos.2
Un metanálisis de distintos métodos de centrifugación estableció que las muestras centrifugadas dos veces consecutivas a 160 xg (fuerza g) durante 10 minutos y 250 xg durante 15 minutos, mostraron plaquetas y factores de crecimiento con mejor función.3Luego, el plasma puede activarse por medio de trombina o cloruro cálcico (liberación plaquetaria) o por lisis física (ultrasonido, frizado). El producto es aplicado en solución o gel.
El PRP contiene factores de crecimiento, citoquinas y proteínas de adhesión que, al aplicarse en la lesión, favorecen la hemostasia, la síntesis de tejido conectivo y la revascularización.Numerosos estudios lo definen solo con la presencia de plaquetas, mientras otros tienen en cuenta las concentraciones de glóbulos rojos, leucocitos, fibrina y proteínas para su definición.
La primera mención es del año 1954 en la revista Nature, donde se acuñó el término PRP.4 Más tarde, se propuso un sistema de clasificación teniendo en cuenta plaquetas, leucocitos y fibrina.5 Se formularon otras clasificaciones, como el sistema PAW, que valora el contenido de plaquetas, su activación y la existencia de leucocitos.6 Otros autores demostraron la importancia del recuento de plaquetas, la presencia de leucocitos, neutrófilos y glóbulos rojos, y su activación.7 La clasificación DEPA se basa en la cantidad de plaquetas inyectadas, el mecanismo de producción, la pureza del PRP y su activación.8 La clasificación de MARSPILL gravita sobre la presencia de células mononucleares en sangre periférica.9 Por último, el comité de estandarización científica recomendó el sistema de clasificación de la Sociedad Internacional de Trombosis y Hemostasia, que presenta consensos sobre el proceso de preparación y aplicación en medicina regenerativa. Aun en la actualidad no fue posible establecer un sistema de clasificación que permita la estandarización del PRP.
El PRP de aplicación clínica propuesto por Everts en el año 2020, debe cumplir con los requisitos de determinación alta de plaquetas, mínima concentración de glóbulos rojos y presencia de leucocitos, para tener buenos resultados.10
La necesidad de minimizar la presencia de glóbulos rojos esconsecuencia de la lesión de su membrana celular durante el proceso de centrifugación, que provoca la liberación de hemoglobina toxica.11 Esta última genera estrés oxidativo, perdida de óxido nítrico y activación de procesos proinflamatorios. Será responsable de la eriptosis, que provoca la liberación de un factor de inhibición de migración de macrófagos con bloqueo en la migración de células madre, la proliferación de fibroblastos y los efectos citotóxicos locales.11
Los neutrófilos son importantes en los procesos de curación y representan una barrera contra patógenos. Tienen funciones angiogénicas y restauran tejidos. Pueden tener efectos dañinos al liberar citoquinas y metaloproteasas con efectos catabólicos.12
Los linfocitos actúan a través de citoquinas reforzando la polarización macrofágica,13 y son efectores importantes en el proceso de curación de la herida.
En relación con la seguridad, existen numerosas revisiones que evalúan dicho desenlace y refieren no presentar reacciones adversas significativas.14
El presente artículo tiene por finalidad transmitir el protocolo que usamos actualmente en nuestra institución para el tratamiento de úlceras de pie diabético con PRP, y destacar la facilidad de preparación y aplicación de este último,lo cual permite su uso en centros de primer nivel como en el que actualmente implementamos el tratamiento.
Presentación del protocolo y casos
Nuestra experiencia comenzó con la aplicación del PRP en procedimientos traumatológicos, con buenos resultados. Posteriormente, se realizó una revisión sistemática sobre el tratamiento de úlceras de pie diabético con PRP gel, en comparación con cuidados estándar, que permitió evaluar su efectividad en úlceras de pie diabético.15 Luego, se constituyó el consultorio de curación de heridas, integrado por enfermeras capacitadas en el tratamiento de heridas, médico traumatólogo con formación en pie y por diabetólogo diplomado en pie diabético y curación de heridas. Posteriormente se resolvió el abordaje terapéutico de úlceras de pie diabético con PRP.
Se utilizó el protocolo de centrifugación única durante 7 minutos a 1400 rpm.1 Primero se valora la herida mediante el protocolo TIME (tejido, infección, humedad, bordes), que nos proporciona una guía para el tratamiento. Es importante desbridar la herida antes de la aplicación de cualquier apósito o fármaco, y el PRP no está exento de dicha premisa.
Se extrae sangre con jeringas de 10 ml; una jeringa equivale a 3 tubos de muestra. Se realizan en total 2 extracciones, con la aclaración de que la cantidad a extraer depende del tamaño de la herida. Se obtiene la sangre en tubos de citrato de sodio al 3.8%; luego, se centrifuga según protocolo.Se recupera el plasma y se obtienen 2 ml por tubo. Debemos tener precaución en la extracción y evitar contaminación con glóbulos rojos. Posteriormente se activa congluconato de calcio, según la siguiente proporción:3 ml plasma/0.4 ml gluconato cálcico.Se obtienen 6 ml de plasma y se mezclan con 0.8 ml de gluconato de calcio (de acuerdo con la proporción), y se dejan 45 minutos a temperatura ambiente hasta la formación del gel.Se aspira el líquido y se infiltran los bordes de la herida y el lecho. Luego, se manipula el gel colocándolo sobre la herida y se tapa con gasa estéril. Se deja esta curación por 7 días, lo que genera un beneficio adicional, ya que el paciente se valora una vez a la semana. En cada control se realiza desbridamiento de la herida, ya que se forman detritos que deben ser removidos.
Presentaremos tres casos de úlceras de pie diabético tratados con el protocolo descripto.
Caso 1
El primer caso corresponde a un paciente de sexo masculino, de 38 años, conantecedentes de diabetes tipo 1, nefropatía diabética, neuropatía sensitiva de miembros inferiores y úlceras plantares recurrentes, que ingresa por fiebre, malestar general y úlcera en planta de pie izquierdo. Se observa tres úlceras, en la base del hallux, la cara lateral del hallux y el dorso, que se conecta con la herida en la cara lateral. Presenta edema y eritema marcado (Figuras 1 y 2).
El paciente no refiere dolor a consecuencia de la neuropatía sensitiva. Se constató pérdida de la sensibilidad bilateral, pulsos pedios y tibiales posteriores conservados; se solicita eco-Doppler vascular, que se informa sin alteraciones. Se realiza control de temperatura con cámara termográfica en región plantar, constatándose un aumento de la temperatura de 35.6°C (Figura 3).



Se realiza limpieza de la herida con solución fisiológica y clorhexidina. Luego, se realiza desbridamiento quirúrgico y se procede a la aplicación de PRP en forma inyectable y en gel en todas las úlceras, y se tapa con gasa estéril. Se indicó al paciente la descarga del pie, y se programa curación en 5 días. En el control se observa disminución del edema y descenso de la temperatura plantar a 31.7 °C. Se pone de manifiesto la reducción de la superficie de la herida y la presencia de detritos, que fueron desbridados apropiadamente. Durante el transcurso de 2 meses, se efectuaron curaciones una vez por semana, con mejoría sostenida. El paciente fue dado de alta, con plantillas de descarga y controles mensuales.
Caso 2
El segundo caso corresponde a una paciente de 74 años, con antecedentes de diabetes tipo 2, que consulta por úlcera en la cara plantar del hallux.
Se interconsulta con servicio de traumatología, el cual realiza toilette quirúrgico extenso y se procede a colocación de PRP semanal, acompañada de miel, con control cada 48 horas.Luego de un mes de tratamiento con evolución satisfactoria, se da el alta (Figura 4).

Caso 3
El tercer caso corresponde a una paciente de 88 años, con antecedentes de diabetes tipo 2 y movilidad reducida, que presenta ampollas en ambos talones, las cuales, luego de ser pinchadas por la médica de guardia para evaluar su contenido,presentan infección local que evoluciona formando una úlcera. La paciente continúa con curaciones estándar por 3 meses, sin mejoría. Se requiere valoración por nuestro consultorio. Se solicita eco-Doppler, que informa calcificaciones en territorios arteriales de miembros inferiores y se constata trastorno de la sensibilidad. La herida presenta fondo fibrinoso, sin signos de infección, con bordes hiperqueratinizados. Se procede al desbridamiento quirúrgico y a la aplicación de PRP inyectable y en gel. Luego de un mes de tratamiento con buena respuesta se da el alta, con aplicación de cremas de urea al 10% y controles mensuales.

Conclusión
Se pone en evidencia una respuesta más rápida en las heridas profundas que en las superficiales. Asimismo, el PRP permite asociar otros productos. Nuestra práctica sugiere que el uso combinado de apósitos con miel brinda la humedad necesaria para la herida.El procedimiento no presenta complejidad, aunque no está exento de complicaciones, por lo que es importante informar adecuadamente al paciente, firmar el consentimiento informado y valorar cada 48 horas la evolución de la herida. Las limitaciones para la preparación radican en la falta de elementos para centrifugar la muestra, así como de recursos materiales necesarios para su activación. Mantener condiciones de asepsia durante el procedimiento minimizará el riesgo de sobreinfección de la herida. La aplicación de PRP demostró utilidad en múltiples escenarios, por lo que su uso debe considerarse en cualquier institución que cuente con los elementos necesarios para su preparación y con profesionales que busquen ampliar las opciones para el tratamiento de las úlceras crónicas, incluso en el primer nivel de atención.
Sebastián Brescia, Hospital Seccional Eduardo Canosa, Puerto Santa Cruz, Argentina,
e-mail: sebabrescia@hotmail.com
1. Marx R. Platelet-rich plasma (PRP): What is PRP and what is not PRP? Implant Dent 10:225-228, 2001.
2. Chahla J, Cinque ME, Piuzzi NS, Mannava S, Geeslin AG, Murray IR, et al. A call for standardization in platelet-rich plasma preparation protocols and composition reporting: A systematic review of the clinical orthopaedic literature. J Bone Jt Surg 99:1769-1779, 2017.
3. Yin W, Xu H, Sheng J, Zhu Z, Jin D, Hsu P, et al. Optimization of pure platelet-rich plasma preparation: A comparative study of pure platelet-rich plasma obtained using different centrifugal conditions in a single-donor model. Exp Ther Med 14(3):2060-2070, 2017.
4. Kingsley CS. Blood coagulation; evidence of an antagonist to factor VI in platelet-rich human plasma. Nature 173:723-724, 1954.
5. Dohan Ehrenfest DM, Rasmusson L, Albrektsson T. Classification of platelet concentrates: from pure platelet-rich plasma (P-PRP) to leucocyte- and platelet-rich fibrin (L-PRF). Trends Biotechnol 27:158-167, 2009.
6. Delong JM, Russell RP, Mazzocca AD. Platelet-rich plasma: the PAW classification system. Arthroscopy 28:998-1009, 2012.
7. Mautner K, Malanga GA, Smith J, Shiple B, Ibrahim V, Sampson S, Bowen J. A call for a standard classification system for future biologic research: the rationale for new PRP nomenclature. PM R 7:S53-59, 2015.
8. Magalon J, Chateau AL, Bertrand B, Louis ML, Silvestre A, Giraudo L, et al. DEPA classification: a proposal for standardising PRP use and a retrospective application of available devices. BMJ Open Sport Exerc Med 2(1):e000060, 2016.
9. Lana JFSD, Purita J, Paulus C, Huber SC, Rodrigues BL, Rodrigues AA, et al. Contributions for classification of platelet rich plasma - proposal of a new classification: MARSPILL. Regen Med 12:565-574, 2017.
10. Everts P, Onishi K, Jayaram P, Lana JF, Mautner K. Platelet-rich plasma: New performance understandings and therapeutic considerations in 2020. Int J Mol Sci 21(20):1-36, 2020.
11. Everts PA, Malanga GA, Paul RV, Rothenberg JB, Stephens N, Mautner KR. Assessing clinical implications and perspectives of the pathophysiological effects of erythrocytes and plasma free hemoglobin in autologous biologics for use in musculoskeletal regenerative medicine therapies. A review. Regen Ther 11:56-64, 2019.
12. Kolaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation. Nat Rev Immunol 13(3):159-175, 2013.
13. Louiselle AE, Niemiec SM, Zgheib C, Liechty KW. Macrophage polarization and diabetic wound healing. Transl Res 236:109-116, 2021.
14. Qu W, Wang Z, Hunt C, Morrow AS, Urtecho M, Amin M, et al. The effectiveness and safety of platelet-rich plasma for chronic wounds: A systematic review and meta-analysis. Mayo Clin Proc 96:2407-2417, 2021.
15. Brescia S, Ramos R, Jemar G, Ruiz A. Plasma rico en plaquetas autólogo tópico para el tratamiento de la úlcera de pie diabético. Salud(i)Ciencia 25(3):145-153, 2022.
Está expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC.
ua91218






























